Письмо Федеральной службы по надзору в сфере здравоохранения от 14 апреля 2016 г. N 01И-773/16 "О недоброкачественном медицинском изделии"
Федеральная служба по надзору в сфере здравоохранения на основании экспертизы качества, эффективности и безопасности эксплуатационной документации медицинского изделия ФГБУ "ЦМИКЭЭ" Росздравнадзора N 06-ГЗ/РЗ-16 от 04.03.2016 сообщает о выявлении недоброкачественного медицинского изделия "Монитор медицинский фетальный матери и плода", модели: G6A Plus, G6A, G6B Plus, G6B", производства Дженерал Медитеч Инк. (General Meditech Inc.), Китай, регистрационное удостоверение N ФСЗ 2012/12020 от 12.05.2012, срок действия не ограничен, в связи с несоответствием сведений о технических характеристиках и функциональных параметрах в эксплуатационной документации медицинского изделия требованиям документации производителя в части: назначения; диапазона измерения среднего артериального давления (СрАД) (от 2,7 до 31,9) кПа или (от 20 до 240) мм рт.ст.; наличия кроме автоматического и ручного режима обнуления; использования ультразвуковых датчиков с несущей частотой ультразвуковых колебаний не только 1 МГц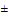 1 кГц, но и 1,5 МГц
1 кГц, но и 1,5 МГц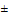 1 кГц, 2 МГц
1 кГц, 2 МГц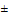 1 кГц; использования беспроводных датчиков; наличия разъема USB; увеличения времени хранения данных до не менее 450 часов; увеличения емкости аккумулятора до 4000 мА/ч; увеличения времени зарядки аккумулятора; изменения диапазона измерений температуры и диапазона предупредительных сигналов (от 0 до 50,0)°С при мониторинге температуры.
1 кГц; использования беспроводных датчиков; наличия разъема USB; увеличения времени хранения данных до не менее 450 часов; увеличения емкости аккумулятора до 4000 мА/ч; увеличения времени зарядки аккумулятора; изменения диапазона измерений температуры и диапазона предупредительных сигналов (от 0 до 50,0)°С при мониторинге температуры.
Федеральная служба по надзору в сфере здравоохранения предлагает субъектам обращения медицинских изделий провести проверку наличия в обращении указанного медицинского изделия, изъять из обращения и о результатах проинформировать соответствующий территориальный орган Росздравнадзора.
Территориальным органам Росздравнадзора провести мероприятия в соответствии с порядком, предусмотренным Административным регламентом Федеральной службы по надзору в сфере здравоохранения по исполнению государственной функции по контролю за обращением медицинских изделий, утвержденным приказом Минздрава России от 05.04.2013 N 196н (регистрация Минюста России от 07.08.2013 N 29290).
| Руководитель | М.А. Мурашко |
Обзор документа
Сообщается о выявлении недоброкачественного медицинского изделия "Монитор медицинский фетальный матери и плода", модели: G6A Plus, G6A, G6B Plus, G6B", производства Дженерал Медитеч Инк. (General Meditech Inc.) (Китай).
Выявлено несоответствие сведений о технических характеристиках и функциональных параметрах в эксплуатационной документации медизделия требованиям документации производителя. В том числе: назначения; диапазона измерения среднего артериального давления (СрАД) (от 2,7 до 31,9) кПа или (от 20 до 240) мм рт.ст.; наличия кроме автоматического и ручного режима обнуления; увеличения емкости аккумулятора до 4000 мА/ч; увеличения времени зарядки аккумулятора; изменения диапазона измерений температуры.
Субъектам обращения медицинских изделий следует проверить наличие в обращении указанного медизделия, изъять из обращения. О результатах проинформировать территориальный орган Росздравнадзора.



(1).jpg)


