Письмо Федеральной службы по надзору в сфере здравоохранения от 1 февраля 2016 г. N 01И-146/16 "О недоброкачественном медицинском изделии"
Федеральная служба по надзору в сфере здравоохранения на основании экспертизы качества, эффективности и безопасности образцов медицинского изделия ФГБУ "ВНИИИМТ" Росздравнадзора N 13/ГЗ-15-400Э-027 от 03.11.2015 сообщает о выявлении в обращении недоброкачественного медицинского изделия "Шприцы одноразовые стерильные объёмом 1 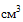 (мл), 2
(мл), 2 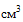 (мл), 3
(мл), 3 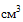 (мл), 5
(мл), 5 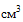 (мл), 10
(мл), 10 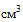 (мл), 20
(мл), 20 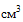 (мл), 30
(мл), 30 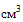 (мл), 50
(мл), 50 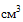 (мл), 60
(мл), 60 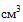 (мл), 100
(мл), 100 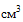 (мл), 150
(мл), 150 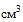 (мл) с иглами и без", вариант исполнения: "Шприцы одноразовые стерильные объёмом 10 ml с иглами 21 Gx11/2; 21Gx2", производства "Тяньжинь Медик Медикал Эквипмент Ко., Лтд.", Китай, регистрационное удостоверение N ФСЗ 2009/03552 от 28.01.2009, партия 10140425, дата выпуска 2014.04.25, в связи с несоответствием требованиям нормативной документации ГОСТ ISO 7886-1-2011 "Шприцы инъекционные однократного применения стерильные. Часть 1. Шприцы для ручного использования" в части п.п. 10.3 "Общая длина шкалы", 16.1 "Маркировка потребительской упаковки", ГОСТ Р ИСО 9626-2013 "Трубки игольные из нержавеющей стали для изготовления медицинских игл" в части п. 7 "Обозначение размеров", ГОСТ ISO 7864-2011 "Иглы инъекционные однократного применения стерильные" в части п. 7 "Обозначение размеров", и комплекту регистрационной документации в части "Наименование изделия" и "Срок годности", "Длина канюли" и "Упаковка канюли".
(мл) с иглами и без", вариант исполнения: "Шприцы одноразовые стерильные объёмом 10 ml с иглами 21 Gx11/2; 21Gx2", производства "Тяньжинь Медик Медикал Эквипмент Ко., Лтд.", Китай, регистрационное удостоверение N ФСЗ 2009/03552 от 28.01.2009, партия 10140425, дата выпуска 2014.04.25, в связи с несоответствием требованиям нормативной документации ГОСТ ISO 7886-1-2011 "Шприцы инъекционные однократного применения стерильные. Часть 1. Шприцы для ручного использования" в части п.п. 10.3 "Общая длина шкалы", 16.1 "Маркировка потребительской упаковки", ГОСТ Р ИСО 9626-2013 "Трубки игольные из нержавеющей стали для изготовления медицинских игл" в части п. 7 "Обозначение размеров", ГОСТ ISO 7864-2011 "Иглы инъекционные однократного применения стерильные" в части п. 7 "Обозначение размеров", и комплекту регистрационной документации в части "Наименование изделия" и "Срок годности", "Длина канюли" и "Упаковка канюли".
Федеральная служба по надзору в сфере здравоохранения предлагает субъектам обращения медицинских изделий провести проверку наличия в обращении указанного медицинского изделия, провести мероприятия по предотвращению обращения указанного медицинского изделия и о результатах проинформировать соответствующий территориальный орган Росздравнадзора.
Территориальным органам Росздравнадзора провести мероприятия в соответствии с порядком, предусмотренным Административным регламентом Федеральной службы по надзору в сфере здравоохранения по исполнению государственной функции по контролю за обращением медицинских изделий, утвержденным приказом Минздрава России от 05.04.2013 N 196н (регистрация Минюста России от 07.08.2013 N 29290).
| Руководитель | М.А. Мурашко |
Обзор документа
Сообщается о выявлении в обращении недоброкачественного медицинского изделия "Шприцы одноразовые стерильные объёмом 1 куб.см (мл), 2 куб.см (мл), 3 куб.см (мл), 5 куб.см (мл), 10 куб.см (мл), 20 куб.см (мл), 30 куб.см (мл), 50 куб.см (мл), 60 куб.см (мл), 100 куб.см (мл), 150 куб.см (мл) с иглами и без", вариант исполнения: "Шприцы одноразовые стерильные объёмом 10 ml с иглами 21Gx11/2; 21Gx2", производства "Тяньжинь Медик Медикал Эквипмент Ко., Лтд." (Китай). Выявленное изделие не соответствует требованиям нормативной документации ГОСТ ISO 7886-1-2011.
Субъектам обращения медицинской продукции следует проверить наличие в обращении указанного медизделия и предотвратить его обращение на территории России. О результатах проинформировать территориальный орган Росздравнадзора.



(1).jpg)


