Проект Приказа Министерства сельского хозяйства РФ "Об утверждении Методических указаний по разработке нормативов качества воды водных объектов рыбохозяйственного значения, в том числе нормативов предельно допустимых концентраций вредных веществ в водах водных объектов рыбохозяйственного значения" (подготовлен Минсельхозом России 09.06.2018)
Досье на проект
В соответствии с постановлением Правительства Российской Федерации от 28 июня 2008 г. N 484 "О порядке разработки и утверждения нормативов качества воды водных объектов рыбохозяйственного значения, в том числе нормативов предельно допустимых концентраций вредных веществ в водах водных объектов рыбохозяйственного значения" (Собрание законодательства Российской Федерации, 2008, N 27, ст. 3286; 2012, N 44, ст. 6026) и постановлением Правительства Российской Федерации от 22 октября 2012 г. N 1082 "О некоторых вопросах Министерства сельского хозяйства Российской Федерации и внесении изменений в некоторые акты Правительства Российской Федерации" (Собрание законодательства Российской Федерации, 2012, N 44, ст. 6026; 2014, N 8, ст. 800; N 21, ст. 2907), приказываю:
1. Утвердить прилагаемые Методические указания по разработке нормативов качества воды водных объектов рыбохозяйственного значения, в том числе нормативов предельно допустимых концентраций вредных веществ в водах водных объектов рыбохозяйственного значения.
2. Настоящий приказ вступает в силу по истечении шести месяцев со дня его официального опубликования.
| Министр | Д.Н. Патрушев |
Утверждены
приказом Минсельхоза России
от ________________ N ____
Методические указания
по разработке нормативов качества воды водных объектов рыбохозяйственного значения, в том числе нормативов предельно допустимых концентраций вредных веществ в водах водных объектов рыбохозяйственного значения
1. Назначение и область применения
1.1. Методические указания по разработке нормативов качества воды водных объектов рыбохозяйственного значения, в том числе нормативов предельно допустимых концентраций вредных веществ (далее - ПДК) в водах водных объектов рыбохозяйственного значения, предназначены для научно-исследовательских и иных организаций, осуществляющих проведение специализированных исследований в целях определения качества воды водных объектов рыбохозяйственного значения ПДК.
1.2. Нормативы качества воды водных объектов рыбохозяйственного значения определяются в соответствии с физическими, химическими, биологическими и иными показателями для оценки состояния среды обитания водных биологических ресурсов (далее - водные биоресурсы) в целях сохранения водных биоресурсов и обеспечения безопасности продукции из них.
1.3. Показатели состава и свойств естественного природного состояния воды поверхностных водных объектов определяются физическими, химическими, биологическими и иными показателями, соответствующими природным условиям, не затронутым антропогенным воздействием.
1.4. Нормативы качества воды водных объектов рыбохозяйственного значения в связи с широким влиянием различных видов хозяйственной деятельности на водные объекты рыбохозяйственного значения установлены на взвешенные вещества, плавающие примеси (вещества), окраску, запахи и привкусы, температуру, водородный показатель, минерализацию воды, растворенный кислород, биохимическое потребление кислорода (далее - БПК), химические вещества, токсичность воды.
1.5. Нормативы ПДК являются показателями предельно допустимого содержания химических веществ и микроорганизмов в среде обитания водных биоресурсов, несоблюдение которых может привести к деградации и гибели водных биоресурсов.
1.6. Методические указания по разработке ПДК веществ устанавливают требования к проведению научно-исследовательских работ по определению и обоснованию указанных нормативов для воды водных объектов рыбохозяйственного значения, или их участков.
2. Общие положения
2.1. ПДК вещества в воде характеризует максимально допустимую концентрацию самого вещества или продуктов его трансформации в воде, при постоянстве которой в водном объекте не возникают последствия, снижающие его рыбохозяйственную ценность.
2.2. Временный норматив ПДК вещества, который оценивается на основе экспресс-экспериментальных и расчетных методов оценки токсичности, может применяться не более двух лет.
2.3. Нормативы ПДК разрабатываются для веществ, используемых в хозяйственной и иной деятельности, связанной с неизбежным сбросом или риском их поступления в водный объект (при транспортировке, погрузочно-разгрузочных операциях и т.д.). Основанием для разработки нормативов является заявка заказчика. Основанием для пересмотра величины норматива является выявление дополнительных негативных последствий при непосредственном использовании вещества в хозяйственной или иной деятельности, а также запрет его применения на территории Российской Федерации.
2.4. При установлении ПДК или временного норматива ПДК вещества по критерию действия вещества на показатели водной среды или на показатели жизнедеятельности различных трофических уровней водных организмов устанавливается лимитирующий показатель вредности (далее - ЛПВ) вещества.
Если вещество оказывает прямое токсическое действие на водные организмы, тогда ЛПВ характеризуется как токсикологический и обозначается "токс".
При нарушении экологических условий при попадании вещества в воду водного объекта рыбохозяйственного значения: изменение трофности водных объектов; гидрохимических показателей, нарушение способности самоочищения воды водного объекта (биохимическое потребление кислорода (БПК5), численность сапрофитной микрофлоры), - тогда ЛПВ характеризуется как санитарный и обозначается "сан".
При действии вещества, как на водные организмы, так и на санитарные показатели водного объекта ЛПВ характеризуется как санитарно-токсикологический и обозначается "сан-токс".
Если вещество при попадании в воду образует пленку или пену на поверхности воды, появляются посторонние привкусы и запах воды, наблюдается выпадение осадка, появление опалесценции, мутности и взвешенных веществ, тогда ЛПВ характеризуется как органолептический и обозначается "орг". При этом указывается расшифровка характера изменения органолептических свойств воды (зап. - запах; мутн. - мутность; окр. - окраска; пен. - пена; пл. - пленка; привк. - привкус; оп. - опалесценция и т.д.).
2.5. К образцам веществ, представляемых на токсикологические исследования, должны прилагаться документы, характеризующие их строение, химический состав, физико-химические свойства, и подтверждающие соответствие образцов заявленным к исследованию веществам.
2.6. Для каждого вещества может быть установлена только одна величина норматива (за исключением случаев, предусмотренных условиями нормирования вещества с учетом природных особенностей водных объектов - регионального норматива данного вещества).
2.7. Если исследуемое вещество является аналогом другого вещества, для которого норматив утвержден ранее (т.е. имеет идентичную химическую структуру, но иное товарное название), проводится токсикологическое исследование вещества-аналога лишь по лимитирующим звеньям без выполнения исследований в полном объеме. При совпадении результатов токсикологических исследований с ранее установленным нормативом наименование исследуемого вещества включается в перечень синонимов в соответствующей позиции приказа об утверждении ПДК. Если токсичность исследуемого вещества оказывается иной, проводится химический анализ и полный цикл исследований, предусмотренных настоящими Методическими указаниями.
2.8. При разработке нормативов, как для индивидуальных веществ, так и для смесей используются одинаковые методические приемы. При наличии официальной зарубежной информации и опубликованных фактических данных об опасных свойствах веществ и количественных параметрах опасности, представленных показателями, соответствующими нормативно - методическим документам, утвержденным в установленном порядке при гигиеническом нормировании, если оно проводилось, возможно использование этих сведений для принятия решения о необходимости установления ПДК в рыбохозяйственных водных объектах.
2.9. Совокупность индивидуальных веществ, смешанных до поступления в окружающую среду, характеризует полученную совокупность веществ как смесевое вещество или смесь.
2.10. При разработке ПДК смесевого вещества состав исследуемого препарата должен быть полностью расшифрован заказчиком. Разработчик ПДК обеспечивает конфиденциальность информации о составе исследуемого вещества в соответствии с законодательством Российской Федерации о коммерческой тайне.
2.11. При разработке ПДК диспергента, применяемого при нефтяных разливах, проводятся исследования как самого диспергента и его компонентов, так и смеси диспергента с нефтью в соотношении 1:10.
2.12. Если исследуемое вещество не растворяется в воде или растворимость его незначительна, изучение влияния этого вещества на тест-организмы проводится при внесении в воду навесок вещества для создания его смесей с водой в различных соотношениях (пункт 2 приложения N 1 к настоящим Методическим указаниям).
2.13. При отсутствии информации в открытых источниках (справочная литература, статьи, паспорт вещества, информационная карта Российского регистра потенциально опасного химического и биологического вещества) по срокам распада 50% и 95% нормируемого вещества в водной среде проводят оценку стабильности вещества химико-аналитическим или биологическим методом исследования. Далее классифицируют вещество по степени его стабильности в водной среде (пункт 3 приложения N 1 к настоящим Методическим указаниям) и определяют частоту смены опытных растворов в хронических экспериментах.
2.14. Оценка мутагенного и канцерогенного действия веществ проводится в том случае, если имеются научные сведения или косвенные данные, свидетельствующие о потенциальной генотоксичности самого вещества или его метаболитов.
2.15. Не требуется разработка ПДК вещества для химически инертных и биологически неактивных веществ (природные минералы - графит, силикатное стекло и др.), используемых в хозяйственной и иной деятельности, если данные вещества не содержат токсичных примесей, растворимых в воде.
К биологически инертным веществам относятся те вещества, у которых величина ЛК50 за 96 ч составляет 1000 мг/л и более.
Содержание водорастворимых примесей в веществах оценивается в химической лаборатории, аккредитованной в национальной системе аккредитации.
2.16. Уровень физиологической чувствительности лабораторных культур и выборок тест-организмов контролируется по эффекту на них эталонного (стандартного) токсиканта, для чего определяется ЛК50 (ЭК50) - концентрация 50% гибели или изменение какого-либо показателя жизнедеятельности организма. В качестве эталонного токсиканта рекомендуется бихромат калия (K2Cr2O7). Если реакция тест-организма не соответствует определенному диапазону полулетальных концентраций, тогда с таким тест-организмом эксперименты не проводят.
2.17. При наличии утвержденной величины ПДК вещества для пресноводных водных объектов, при разработке ПДК этого вещества для морских водных объектов используются морские тест-организмы, относящиеся к определенным в ходе пресноводных исследований лимитирующим экологическим звеньям.
2.18. Для веществ, на которые разработаны нормативы ПДК или временный норматив ПДК вещества, должны быть разработаны и аттестованы методики количественного химического анализа (далее - КХА) этих веществ в воде. Сведения об аттестованных методиках КХА в соответствии со статьей 5 Федерального закона от 26 июня 2008 года N 102-ФЗ "Об обеспечении единства измерений" передаются в Федеральный информационный фонд по обеспечению единства измерений проводящими аттестацию юридическими лицами и индивидуальными предпринимателями.
3. Общие условия разработки ПДК веществ различного назначения
3.1. ПДК веществ устанавливаются по результатам (приложения N 1-4 к настоящим Методическим указаниям) токсикологических исследований вещества на тест-организмах разных экологических звеньев водного объекта (микроорганизмы, фито-, зоопланктон, зообентос, рыбы); оценки влияния веществ на санитарные показатели водной среды; определения стабильности вещества в воде; исследования генотоксичности; обобщения полученных данных; определения наиболее чувствительного звена, для которого максимальная недействующая концентрация вещества оказалась наименьшей (приложение N 5 к настоящим Методическим указаниям). Наиболее чувствительное звено называют также лимитирующим звеном, максимальная недействующая концентрация которого определяет ПДК вещества. Исследуемый показатель (численность, биомасса, физиологический или гематологический показатель и проч.), для которого определена максимальная недействующая концентрация, называется лимитирующим показателем.
3.2. Для каждого тест-организма установлен круг тест-параметров (или тест-функций), которые являются основными и контролируются в обязательном порядке. Иные тест-параметры являются вспомогательными и могут быть использованы для уточнения пределов действующих концентраций или для установления особенностей действия исследуемого вещества.
3.3. При выборе схемы эксперимента, если это допускается методикой (приложения N 2 и 3 к настоящим Методическим указаниям), следует учитывать, что величина эффекта, которая может быть выявлена статистическими методами, зависит от таких аспектов плана эксперимента, как количество повторностей и количество организмов в повторности.
Увеличение количества повторностей, как правило, повышает статистическую надежность испытаний.
Если уменьшают количество организмов в повторности, то чувствительность теста может понизиться более или менее существенно в зависимости от измеряемой тест-функции. Например, по показателю выживаемости чувствительность теста может значительно снизиться за счет увеличения вариабельности частот гибели между "повторностями" (приложение N 4 к настоящим Методическим указаниям); по показателю плодовитости, при достаточно высоких его значениях, снижение чувствительности будет пренебрежимо мало.
Поэтому планировать количество повторностей и количество организмов в повторности необходимо с учетом ключевой тест-функции. Например, для зоопланктона в острых опытах это выживаемость, в хронических - плодовитость. В первом случае целесообразнее максимизировать количество организмов в повторности, во втором - количество повторностей.
В ряде случаев при выполнении статистического анализа возможно рассмотрение отдельных организмов в качестве "повторностей" (приложение N 4 к настоящим методическим указаниям), когда есть основания считать, что вариабельность между емкостями мала по сравнению с вариабельностью между организмами. В таких случаях решающую роль для чувствительности статистического теста играет суммарное количество организмов.
3.4. При выборе концентраций для исследования каждого вещества следует исходить из правил:
а) для острых и предварительных исследований выбираются 5-6 концентраций, различающихся между собой в 10 раз;
б) при проведении острых опытов определяется ЛК50 для рыб за 96 ч, для одноклеточных водорослей - за 72 ч, для зоопланктона - за 48-72 ч. Результаты заносятся в аннотационную карту;
в) для более точного определения пороговой концентрации разведения могут различаться в 2-5 раз.
3.5. При разработке ПДК веществ, характерных для природных вод, необходимо определять концентрацию веществ в воде, которая используется для ведения культур и для опытов. В этом случае норматив определяется (рассчитывается) с учетом природного фонового содержания этого вещества в воде.
3.6. Основные правила анализа полученных данных с целью выведения ПДК вещества:
а) результаты, полученные при действии исследуемого вещества ("опыт"), сопоставляются с результатами наблюдений при отсутствии данного вещества в среде ("контроль"). Особенности вариантов опыта и контроля указаны при описании конкретных методов;
б) в эксперименте концентрации считаются действующими, если вызывают не только токсический, но и эвтрофирующий эффект (увеличение численности, биомассы организмов или других регистрируемых параметров) или изменяют органолептические свойства среды;
в) статистическая значимость отличия данных в опыте от данных в контроле оценивается соответствующими методами (приложение N 4 к настоящим Методическим указаниям);
г) на основании статистической обработки данных устанавливаются максимальные допустимые концентрации для каждого тест-параметра используемого тест-организма, а также для тест-организма в целом;
д) максимальная недействующая концентрация для наиболее чувствительного тест-организма принимается как ПДК исследуемого вещества. Звено, к которому относится данный тест-организм, определяется как лимитирующее.
3.7. При исследовании вещества оценивается характер загрязнения водной среды в опыте: опалесценция, пленка, изменение цвета раствора, истинность или коллоидностъ раствора, для мелкодисперсных взвесей - скорость оседания частиц, органолептическое определение запаха и вкуса (привкуса) воды и пр.
3.8. При величине ПДК вещества 0,00001 мг/л и менее или при лимитирующем показателе "генотоксичность" вещество не рекомендуется для внедрения в производство и в практику.
3.9. Все результаты специализированных научно-исследовательских работ по разработке нормативов обобщаются в Аннотационной карте (приложение N 5 к настоящим Методическим указаниям).
4. Общие условия разработки временного норматива ПДК веществ различного назначения
4.1. Временные нормативы разрабатываются для веществ различного назначения.
4.2. Временный норматив ПДК химических и биологических веществ для пресноводных водных объектов и морей, включая внутренние морские воды Российской Федерации, устанавливается по сокращенной схеме в соответствии с пунктом 6 приложения N 2 и пунктом 6 приложения N 3 к настоящим Методическим указаниям.
4.3. Если исследуемое вещество или его химические аналоги по литературным источникам (справочная литература, статьи, паспорт вещества, информационная карта государственной регистрации потенциально опасного химического и биологического вещества) или по показаниям, выявленным в процессе исследований, обладают потенциальной мутагенной активностью, необходимо проведение оценки такой активности.
4.4. В случае если мутагенное действие оказывается лимитирующим показателем при разработке временного норматива ПДК вещества, данный норматив не утверждается, проводится разработка ПДК вещества в полном объеме в соответствии с настоящими Методическими указаниями.
4.5. Рекомендуемые величины временных нормативов ПДК веществ после их утверждения в установленном порядке используются на протяжении срока их действия (до двух лет), после чего исключаются из действующих списков нормативов качества воды.
5. Требования к разработке ПДК и временного норматива ПДК биологических препаратов
5.1. Нормативы для бактериальных и иных биологических препаратов разрабатываются в соответствии с общими требованиями настоящих Методических указаний по методикам (пункт 4.2 приложения N 1, приложение N 2, приложение 3 к настоящим Методическим указаниям) с частичными модификациями (указанными ниже в подпунктах 5.2-5.9).
5.2. При исследовании воздействия биологического препарата на гидрохимический режим определение БПК5 и оценка стабильности токсичности препарата не являются обязательными. Контролируется концентрация кислорода в водной среде.
5.3. Должны быть проведены исследования динамики прироста исследуемого штамма в чистой (отстоянной водопроводной) воде, в воде водного объекта с природной сапрофитной микрофлорой, и выявлены антагонистические отношения между исследуемым штаммом и природной сапрофитной микрофлорой.
5.4. Если в состав препарата входят два или несколько бактериальных штаммов, исследуется динамика прироста каждого штамма в отдельности.
5.5. При исследованиях штаммов, предназначенных для разложения других веществ, проводится также оценка токсичности продуктов разложения.
5.6. Оценка мутагенного действия биологических препаратов должна проводиться всегда, поскольку модифицированные штаммы бактерий сами способны вызвать мутации.
5.7. Исследования с бактериальными препаратами, предназначенными для деструкции нефти и других субстанций, проводят одновременно в двух вариантах - для оценки биологического действия бактериального препарата в отдельности и в сочетании его с веществом, подвергающимся деструкции.
5.8. Нормативы на биологические препараты приводятся в двойном виде - в мг/л и в виде титра клеток на 1 мл (кл/мл). Если препарат представляет собой смесь штаммов, то указывается общий титр клеток с указанием процентного соотношения штаммов в препарате.
5.9. Временный норматив ПДК биологических препаратов определяют по сокращенной схеме: исследуют влияние препарата на органолептические показатели воды, на кислородный режим, динамику сапрофитной микрофлоры, динамику прироста численности исследуемого штамма; оценивают действие вещества в хронических исследованиях на зоопланктон и на ранние стадии онтогенеза рыб (икра, личинки), а препаратов - биоцидов - также на тест-организмах (из числа включенных в настоящие Методические указания), близких по систематическому положению к организмам, против которых направлены препараты.
6. Требования к разработке ПДК и временного норматива ПДК для смесей постоянного состава
6.1. Под смесями постоянного состава (например, пестициды, компоненты буровых растворов и проч.) подразумеваются рецептуры (препараты), полученные в результате намеренного смешивания двух или более индивидуальных веществ (пункт 2.8 раздела 2 "Общие положения разработки нормативов вещества"), имеющих, наряду с индивидуальными веществами), соответствующие номера ГОСТа или ТУ, которые определяют свойства этих смесевых веществ (количество и качество примесей). Такие смесевые вещества (препараты) могут иметь свое фирменное (или товарное) название.
6.2. При определении норматива на смесь постоянного состава эта смесь исследуется как единое вещество в соответствии с общими правилами. При этом устанавливается итоговая (общая) величина норматива с указанием лимитирующего признака вредности и класса опасности.
6.3. Величина норматива смеси используется для экспертной оценки экологического риска поступления такого вещества в водные объекты, а также для различных технологических расчетов сброса смеси в водные объекты и при оценке ущерба водным биоресурсам.
6.4. Все индивидуальные вещества, входящие в состав смеси, с точки зрения влияния на водную биоту, рассматриваются как потенциально опасные или токсичные. На каждый компонент смеси также должна быть установлена величина норматива, за исключением химически инертных и биологически неактивных веществ.
6.5. Нормативы для смеси рассматриваются только в том случае, если установлены нормативы для ее отдельных компонентов. Не нормируются только те компоненты, для которых доказано отсутствие биологической активности на основании представляемых в отчете литературных или собственных экспериментальных данных (например, по оценке величины ЛК50 пункт 2 приложения N 2, пункт 2.1 приложения N 3 к настоящим Методическим указаниям).
Если хотя бы для одного биологически активного компонента смеси в качестве норматива определен только временный норматив ПДК, для всей смеси в качестве норматива также может быть установлен только временный норматив ПДК.
6.6. ПДК смеси может определяться по сокращенной схеме:
а) если ПДК для всех компонентов смеси определены и их нормативы установлены по одному и тому же лимитирующему показателю вредности, а наиболее чувствительное звено совпадает для всех компонентов, достаточно оценить эффект смеси на это звено и убедиться в отсутствии действия большего, чем аддитивное;
б) если лимитирующие показатели вредности и лимитирующие звенья для компонентов смеси различаются, необходимо исследовать влияние смеси на те показатели, которые были определяющими при обосновании ПДК для каждого из компонентов.
6.7. На смесевое вещество устанавливается такая ПДК, при которой с поступлением смеси в водоем не превышаются нормативы ни на один из ее компонентов.
Пример. В состав некоторой смеси входят компоненты "а", составляющий 10%, "b", составляющий 1% от общей массы смеси, и наполнитель, составляющий 89%. Ранее установленные ПДК для этих компонентов равны, соответственно, 0,01, 0,0001 и 0,25 мг/л. Результаты исследований выявляют в качестве допустимой для всей смеси концентрацию 0,1 мг/л. При такой концентрации смеси в среде концентрация компонента "а" составит 10% от 0,1 мг/л, т.е. 0,01 мг/л (нет превышения ПДК), компонента "b" - 1% от 0,1 мг/л, т.е. 0,001 мг/л (ПДК для этого компонента превышена в 10 раз), а наполнителя - 89% от 0,1 мг/л, т.е. 0,089 мг/л (превышения ПДК нет). Следовательно, для соблюдения нормативов отдельных компонентов смеси ПДК для всей смеси необходимо уменьшить в 10 раз, чтобы не превышался норматив для компонента "b". Поэтому ПДК для смеси не должна превышать 0,01 мг/л.
6.8. Аналитический контроль за содержанием смеси в водной среде ведется по индикаторному компоненту или компонентам смеси. Выбор индикаторного компонента проводится на основе следующих принципов: выявление наиболее токсичного и опасного компонента; выбор наиболее стабильного компонента, за исключением химически инертных и биологически неактивных веществ; определение относительной массы (процентного содержания) компонентов смеси; наличие аттестованной методики КХА вещества в воде.
7. Разработка нормативов ПДК веществ с учетом природных особенностей водных объектов (региональные нормативы)
7.1. С целью сохранения состава воды водных объектов, сформировавшегося под влиянием природных факторов, региональные нормативы разрабатываются:
а) для химических элементов, встречающихся в природных водах в повышенных или пониженных концентрациях;
б) для техногенных аналогов природных веществ, сброс которых требует учета типа принимающего водного объекта и особенностей водосборной территории. К ним относятся вещества, способные повышать сапробность и эвтрофность вод (легко утилизируемые органические соединения и соединения биогенных элементов), изменять солевой режим (минерализацию) и рН природных вод, изменять концентрацию взвешенных (минеральных) веществ природного происхождения, а также соединения и комплексы гуминовых кислот.
7.2. Территории, или водные объекты рыбохозяйственного значения, для которых предполагается разработка нормативов с учетом природных особенностей водных объектов, должны быть охарактеризованы:
а) по содержанию нормируемого ингредиента в поверхностных водах;
б) по интегральным показателям качества воды на водосборе, в том числе по физико-химическим факторам (водные объекты определенной жесткости, трофности и т.д.).
7.2.1. Критерием аномальности естественного уровня (Кларка) содержания нормируемого вещества может служить статистически значимое отличие его (при уровне значимости Р < 0,05) от среднего содержания в поверхностных водах в меженный период года 95% обеспеченности.
7.2.2. Границы водных объектов, или их отдельных участков, для которых предлагается величина регионального норматива, должны быть указаны максимально точно, либо указаны наименования конкретных водных объектов.
7.3. Нормативы определяются с использованием тест-организмов, предусмотренных настоящими Методическими указаниями, культивируемых на местной воде.
7.4. В случае необходимости в общий список тест-организмов могут быть добавлены чувствительные местные виды, в том числе организмы доминирующих видов зоопланктонных ракообразных, например Calanus finmarchicus, Idyaea furcata (северные моря России), Calanipeda aquaedulcis (Каспийское море) и т.д.
7.5. Если на вещество существует утвержденный общероссийский норматив, то региональный норматив может устанавливаться по сокращенной схеме. Для этого на местной воде должны быть проведены исследования на тест-организмах, оказавшихся лимитирующими при установлении общероссийского норматива (с учетом требований подпунктов 7.3-7.4 настоящих методических указаний).
Приложение 1
к Методическим указаниям по разработке нормативов качества воды водных объектов
рыбохозяйственного значения, в том числе нормативов предельно допустимых
концентраций вредных веществ в водах водных объектов рыбохозяйственного значения
Общие требования к разработке ПДК веществ в водах водных объектов рыбохозяйственного значения
1. Оценка класса опасности вещества
1.1. В основу классификации опасности вещества положены показатели, характеризующие различную степень опасности для водных биоресурсов химических соединений, загрязняющих воду водных объектов рыбохозяйственного значения, в зависимости от токсичности, способности вызывать отдаленные эффекты, лимитирующего показателя вредности.
1.2. Класс опасности вещества учитывает:
а) степень опасности вещества в связи с его появлением в водных экосистемах;
б) приоритет при контроле загрязнения среды;
в) обоснование рекомендаций о замене хозяйственного использования высоко опасных веществ на менее опасные.
1.3. Выявляются четыре класса опасности веществ, загрязняющих воду водных объектов рыбохозяйственного значения и токсичных для водных биоресурсов. При отнесении вещества к определенному классу опасности учитывается токсичность вещества по величине его ПДК и стабильность этого вещества в водном объекте
1-й класс - чрезвычайно опасные вещества антропогенного происхождения, лимитируемые по токсикологическому ЛПВ. Степень вредного воздействия на водные биоресурсы очень высокая.
Выделяется по следующим признакам:
а) ПДК вещества ниже 0,00001 мг/л;
б) для органических веществ - если стабильность самого вещества или токсичных продуктов его трансформации превышает 180 суток при 20°С ().
2-й класс - высоко опасные вещества антропогенного происхождения, лимитируемые по токсикологическому ЛПВ. Степень вредного воздействия на водные биоресурсы высокая.
Выделяется по следующим признакам:
а) ПДК вещества от 0,0001 до 0,00001 мг/л;
б) для органических веществ - если стабильность самого вещества или токсичных продуктов его трансформации - 60-180 суток при 20°С (). В северных районах, где преобладают низкие температуры воды, эти вещества лимитируются по классу 1.
3-й класс - опасные вещества, лимитируемые по токсикологическому ЛПВ. Степень вредного воздействия на водные биоресурсы средняя.
Выделяется по следующим признакам:
а) ПДК вещества от 0,01 до 0,0001 мг/л;
б) стабильность вещества или токсичных продуктов его трансформации менее 60 суток при 20°С ().
К данному классу относятся вещества как антропогенного, так и природного происхождения (например, сероводород, сульфиды и др.).
4-й класс - умеренно опасные вещества, лимитируемые по любому ЛПВ. Степень вредного воздействия на водные биоресурсы низкая.
Выделяются по следующим признакам:
а) ПДК вещества выше 0,01 мг/л;
б) стабильность меньше 10 суток при 20°С ().
К данному классу относятся частично вещества антропогенного происхождения (обычно биологически относительно инертные), но в значительной степени - вещества природного происхождения.
В 4-м классе выделяются вещества (4-й класс "экологический" - 4э), действие которых проявляется в изменении экологических условий в водном объекте. Это вещества, входящие в состав органики сапробного типа, компоненты минерализации природных вод, биогенные вещества и др.
1.4. Если показатель стабильности, характеризующий класс опасности вещества, является более жесткой величиной (при температуре 20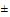 5°С), чем указано для класса опасности вещества в соответствии со значением его ПДК, тогда класс опасности данного вещества ужесточается на единицу.
5°С), чем указано для класса опасности вещества в соответствии со значением его ПДК, тогда класс опасности данного вещества ужесточается на единицу.
1.5. В связи с тем что Россия расположена в различных климатических зонах, учитывается температурный фактор прогрева водных объектов в течение года, и при необходимости класс опасности при высокой среднегодовой температуре воды (20°С) можно снижать, а при более низкой температуре воды (10°С и ниже) повышать, так как в этом случае деградация вещества соответственно увеличивается или замедляется в 3-10 раз.
2. Требования к приготовлению растворов исследуемых веществ при разработке норматива ПДК
2.1. Все вещества (индивидуальные и смесевые) независимо от их растворимости в воде (полной, частичной или отсутствие таковой) должны исследоваться по единой схеме.
2.2. Исходные (маточные) растворы высокой концентрации при установлении норматива вещества для пресноводных и морских водных объектов готовят на дистиллированной воде или среде для культивирования.
2.3. Исследуемые концентрации веществ (растворимых в воде) готовят из исходного раствора на той воде, которая используется для содержания тест-организма.
Для стабильных веществ возможно приготовление исходных растворов высокой концентрации с последующим приготовлением рабочих растворов на протяжении срока, за который в исходном растворе концентрация вещества практически не меняется.
Для нестабильных веществ, когда концентрация их быстро изменяется в растворе, исходные растворы готовят регулярно к каждой очередной замене растворов в экспериментальных сосудах.
2.4. Нерастворимые в воде вещества (минеральные и органические порошки; маслянистые вещества; масла, жиры и их формы; смолистые, вязкие и клейкие органические вещества), как правило, являются высокостабильными.
Подход к созданию опытных концентраций должен быть всегда индивидуальным в отношении каждого из вышеуказанных веществ - в зависимости от его формы, химической природы и физико-химических свойств.
2.5. При исследовании нерастворимых в воде веществ важнейшими показателями будут органолептические - образование на поверхности воды мелких масляных шариков, пленки, снижение прозрачности и др., а также гидрохимические и микробиологические показатели (сапрофитная микрофлора, БПК5).
2.6. Маслянистые вещества. Исходный раствор готовится в момент постановки опыта. Навеска таких веществ помещается в определенное количество воды и размешивается на магнитной мешалке при 1000 об/мин. не менее 1-2 ч. Образуется раствор определенной мутности. Полученную мелкодисперсную водно-масляную эмульсию используют для приготовления опытных концентраций заданного диапазона. При этом каждую опытную емкость перемешивают в течение 1 минуты для образования гомогенной среды, затем вносят тест-организмы.
2.7. Смолистые, вязкие и клейкие вещества. Исходный раствор вещества готовят аналогично тому, как указано в пункте 2.6 настоящих Методических указаний. Навеска вещества должна постепенно, путем подогрева или без него, механическим путем дробиться и растираться до образования максимально однородной массы с водой. Ультразвуковые мешалки полностью гомогенизируют вещество в воде. Полученный исходный раствор используют для приготовления опытных концентраций как указано в пункте 2.6 настоящих Методических указаний.
2.8. Твердые вещества (порошки, гранулы и т.п.), не смешиваемые с водой (всплываемые на поверхность или осаждающиеся на дно).
Навеску вещества необходимо тщательно растереть в ступке с небольшим количеством воды до образования однородной гомогенной массы. Продолжая растирание, в ступку постепенно добавлять все большее количество воды. Полученную водную суспензию вещества переливают из ступки в мерную колбу, ступку несколько раз ополаскивают чистой водой и переливают в ту же мерную колбу. Затем в мерную колбу доливают чистую воду до метки, закрывают пробкой, встряхивают. Полученную суспензию используют для приготовления опытных концентраций заданного диапазона. При этом в толще воды опытного сосуда большая часть препарата равномерно распределяется. Часть вещества оседает на дно или всплывает на поверхность. Периодически растворы перемешивают, встряхивая опытный сосуд.
2.9. Газообразные вещества (на примере метана, опыт в закрытых сосудах). Исходный раствор газа для проведения опытов с фитопланктоном готовят на дистиллированной воде, далее разбавляют его до нужной концентрации культуральной средой. Для проведения опытов на других трофических звеньях исходный раствор газа готовят на контрольной воде (отстойной водопроводной, аквариумной; природной или искусственной морской), разбавляя далее этой же водой до нужной концентрации.
Для приготовления исходных растворов газа используют пластиковые бутыли емкостью 5 л, заливая их соответствующей контрольной или дистиллированной водой. Бутыль закрывают пробкой с двумя отверстиями, в которые вставлены трубки длиной почти до дна сосуда. Трубки имеют зажимы. Газ с помощью редуктора из газового баллона подается в сосуд через одну из трубок. При этом 1/3 воды вытесняется из бутыли через вторую трубку, над водой оказывается только данный газ. Растворение газа в воде происходит при барбатации и встряхивании бутыли. Аналитическое определение концентрации исходного раствора газа проводят газохроматографическим методом.
2.10. Искусственную морскую воду готовят внесением соответствующих солей в дистиллированную воду, аэрируют ее 10-12 ч, отстаивают 2 недели ("созревание воды"). Используют искусственную морскую воду при токсикологических исследованиях только после ее "старения". До нужной солености ее разбавляют дистиллированной водой.
3. Определение требований к оценке стабильности вещества и стабильности его токсичности в водной среде
3.1. Химико-аналитическое исследование
3.1.1. Время, в течение которого вещество разрушается или улетучивается из раствора, характеризует его стабильность (устойчивость). На основании аналитических определений вычисляют время убывания концентрации вещества в растворе на 95%. Химико-аналитические определения проводят в лабораториях, аккредитованных в национальной системе аккредитации.
Метод химического анализа вещества в воде предоставляется заказчиком разработки норматива ПДК вещества.
До начала проведения исследований проводят подготовку необходимого оборудования, приборов, посуды и реактивов согласно методу анализа.
Для исследований используют 8 стеклянных емкостей объемом не менее 20 дм3. Число емкостей соответствует определенному дню исследований.
Емкости наполняют отстоянной природной профильтрованной водой пресноводного водного объекта (природной или искусственной морской водой). В воде, заливаемой в емкости для приготовления растворов исследуемого вещества, определяют его фоновое содержание.
Для создания в емкостях исходной исследуемой концентрации вещества, хорошо растворимого в воде, соответствующие его навески вносят непосредственно в подготовленные емкости с водой и тщательно перемешивают. При наличии фонового содержания исследуемого вещества в воде в опытном растворе учитывается суммарная концентрация вещества при внесении в воду. При выборе концентраций для оценки стабильности меньшая из них должна быть как минимум на 2 порядка выше чувствительности метода.
Для исследования веществ, не растворимых или мало растворимых в воде, используют емкости объемом до 20 дм3 (малые емкости) с целью проведения полной экстракции вещества в сосуде (учитывая осаждение вещества на стенках сосуда).
Число емкостей соответствует определенному дню исследований.
Опыты проводят в емкостях с открытой поверхностью, при температуре 20  2°С и при естественном освещении. Оценивают изменение токсичности со временем растворов вещества в трех концентрациях (по две повторности). Наименьшая концентрация должна быть на порядок выше чувствительности тест-организма.
2°С и при естественном освещении. Оценивают изменение токсичности со временем растворов вещества в трех концентрациях (по две повторности). Наименьшая концентрация должна быть на порядок выше чувствительности тест-организма.
Перед каждым отбором проб для анализа воду в емкостях тщательно перемешивают. Отбор проб и анализ их проводят после приготовления раствора (исходная концентрация - 0 сутки), затем на 1, 3, 5, 7, 10, 15, 20 и 30 сутки от начала эксперимента. Усредненные результаты анализа по повторностям за каждые сутки исследования вносят в таблицу, как, например, показано в табл. 3.1.1.
Таблица 3.1.1.
Динамика распада вещества в воде в течение 30 суток, мг/л
| Исходная | Экспозиция раствора вещества, сутки | |||||||
|---|---|---|---|---|---|---|---|---|
| концентрация, | 1 | 3 | 5 | 7 | 10 | 15 | 20 | 30 |
| мг/л | Концентрация вещества в растворе, мг/л | |||||||
| 10 | 10 | 10 | 9 | 8 | 7 | 6 | 5 | 4 |
3.1.2. Расчет стабильности проводят методом регрессии с учетом того, что убывание концентрации вещества в растворах обычно имеет экспоненциальный характер с отрицательной степенью.
На основании расчетов определяют время 95%-го распада вещества в воде. По времени 95%-го распада вещества в водной среде классифицируют его стабильность и определяют коэффициент запаса (таблица 3.1.2).
Этот же показатель может быть определен и графически. С этой целью строят график убывания концентрации вещества. На осях откладывают время и логарифм концентрации. Из точки на прямой, соответствующей логарифму 5% вещества от исходного уровня, опускают перпендикуляр. Точка пересечения его с осью времени и определит срок разрушения 95% вещества.
3.1.3. По степени стабильности в водной среде препарат относят к одной из шести групп, каждой из которых соответствует определенный коэффициент запаса (К), приведенный в таблице 3.1.2.
Таблица 3.1.2.
Классификация* веществ по их стабильности в водной среде (= 95%)
| Группы | Стабильность | Время 95%-го распада, сутки | Коэффициент запаса (Кс) |
|---|---|---|---|
| 1 | Малая | до 10 | 1,0 |
| 2 | Умеренная | 11 - 60 | 2,5 |
| 3 | Средняя | 61 - 90 | 7,5 |
| 4 | Высокая | 91 - 180 | 13,5 |
| 5 | Очень высокая | 181 - 365 | 27,0 |
| 6 | Сверхвысокая | более года | - |
3.1.4. Стабильность вещества учитывают: при определении класса опасности вещества (пункт 1 приложения N 1 к настоящим Методическим указаниям).
3.2. Токсикологическое исследование
3.2.1. Необходимость исследования стабильности токсичности обусловлена тем, что химико-аналитические определения не позволяют оценить остаточную суммарную токсичность вещества и продуктов его превращения. Оценку остаточной токсичности проводят методами биотестирования. В качестве тест-организма рекомендуется использовать организмы зоопланктона (например, одновозрастные дафнии - для пресноводных водных объектов). Возможно использование в качестве тест-организма других представителей трофической цепи, например, рыб (личинки, мальки, сеголетки).
3.2.2. Исследованию подвергается одна концентрация вещества - ЛК50 за 24 ч, которая устанавливается для организма в соответствии с общими требованиями для опытов на острую токсичность вещества (пункт 2.1.4 приложения N 2 к настоящим Методическим указаниям).
3.2.3. Раствор вещества данной концентрации (ЛК50 за 24 ч) вносят в восемь емкостей. Каждая емкость соответствует постановке эксперимента в определенный день исследований.
3.2.4. На исходные (0) сутки, далее на 3, на 5, на 7, на 10, на 15, на 20 и на 30 сутки от начала эксперимента в соответствующие емкости вносят по одинаковому количеству тест-организмов (не менее 10 экземпляров). Опыты проводят в 3-кратной повторности. Каждому опыту соответствует контроль.
Перед каждым внесением тест-организмов в емкость, раствор тщательно перемешивают. Через 24 часа после внесения организмов в емкость учитывают число погибших.
3.2.5. Полученные экспериментальные данные по соответствующим суткам исследования усредняют по "повторностям" и рассчитанные проценты погибших экземпляров тест-организма вносят в таблицу 3.2.1, где в качестве примера представлены данные по динамике гибели тест-организмов за 30 суток в растворе вещества с ЛК50 за 24 ч, равной 10 мг/л.
Таблица 3.2.1.
Гибель тест-организмов (%) при убывании исходной концентрации вещества (ЛК50) по суткам экспозиции (среднее из 3 повторностей)
| Концентрация, ЛК50 за 24 часа 10 мг/л | Сутки исследований | |||||||
|---|---|---|---|---|---|---|---|---|
| 0 | 3 | 5 | 7 | 10 | 15 | 20 | 30 | |
| Гибель тест-организма, % | ||||||||
| 50 | 46,6 | 40 | 30 | 16,6 | 3,3 | 0 | 0 | |
| Концентрация вещества в соответствии с ее убыванием по суткам, мг/л | ||||||||
| 10 | 9,3 | 8,0 | 6,0 | 3,3 | 0,66 | 0 | 0 | |
3.2.6. На основании полученных данных по гибели тест-организмов в соответствующей емкости, методом пропорции определяется концентрация вещества для каждой величины процента погибших тест-организмов в эксперименте:
так, 50,0% погибших организмов соответствуют 10,0 мг/л;
46,6% - 9,3 мг/л;
40,0% - 8,0 мг/л;
30,0% - 6,0 мг/л;
16,6% - 3,3 мг/л;
3,3% - 0,66 мг/л.
Полученные значения убывающих концентраций вещества (мг/л) по суткам экспозиции также заносят в таблицу 3.2.1.
В случае распада вещества на 20 и на 30 сутки количество определений во времени (n) увеличивается с 6 до 7-8.
3.2.7. Далее расчет периода 95% распада вещества в воде определяют в соответствии с пунктом 3.1.2.
В рассматриваемом примере время распада вещества на 95% составляет 18,8 суток.
3.2.8. При наличии данных по химической стабильности вещества в растворе и данных по стабильности токсичности вещества может быть проведено сравнение полученных величин и сделан вывод о токсичности продуктов распада вещества.
4. Оценка влияния вещества на показатели водной среды
Влияние вещества на показатели водной среды характеризуется по органолептическим (запах, цвет, прозрачность, мутность взвесь, осадок), гидрохимическим (кислород, рН, нитриты, нитраты, аммоний) показателям, а также по показателям, характеризующим самоочищение воды (БПК5, численность сапрофитных микроорганизмов).
4.1. Оценка влияния вещества на органолептические показатели воды
Органолептические показатели воды при различных концентрациях вещества характеризуют по изменению запаха и цвета, вязкости, опалесценции, а также по изменению прозрачности, мутности, наличию взвеси, образованию осадка в воде - указанные показатели определяют с помощью цилиндра высотой 40 см, емкостью 1 л, на белом основании с темными полосами, нанесенными крестообразно. Определение производят в хорошо освещенных помещениях, но не на прямом солнечном свету.
Запах воды при различных концентрациях вещества определяют при комнатной температуре непосредственно из колбы с притертой пробкой. Для этого открывают пробку и слегка втягивают воздух, направляемый к носу помахиванием руки от горлышка емкости, и оценивают наличие запаха.
При этом отмечают интенсивность запаха по пятибалльной шкале (таблица 4.1.1).
Характер запаха определяют описательно: хлорный, землистый, болотный, хлорфенольный, запах нефти и нефтепродуктов, навозный, гнилостный и т.д.
Таблица 4.1.1.
Шкала определения запаха по его интенсивности
| Балл | Интенсивность | Оценка |
|---|---|---|
| 0 | Нет | Запах не ощущается |
| 1 | Очень слабый | Запах, обнаруживаемый большинством наблюдателей |
| 2 | Слабый | Запах, обнаруживаемый всеми наблюдателями |
| 3 | Заметный | Запах легко ощущаемый |
| 4 | Отчетливый | Запах четко ощущаемый |
| 5 | Очень сильный | Запах сильный и резкий |
Цвет среды с разными концентрациями вещества сравнивают с цветом контрольной среды, отмечая его интенсивность в каждой концентрации и отмечая концентрацию, при которой цвет среды не отличается от контроля.
Прозрачность. Границей изменения прозрачности считают глубину в сантиметрах, при которой исчезает четкая видимость линий на диске основания цилиндра.
Мутность воды характеризуют описательно: слабая опалесценция, опалесценция, сильная опалесценция, слабая мутность, заметная мутность, сильная мутность.
Осадок характеризуется по его величине - ничтожный, незначительный, заметный, большой. В случае большого осадка указывается толщина слоя осадка в отношении общего объема воды. При качественной характеристике указывают свойства осадка: кристаллический, аморфный, хлопьевидный, илистый, песчаный и т.п., отмечается также цвет осадка - бесцветный, серый, бурый и т.п.
В качестве примера приводится табличная запись отмечаемых изменений органолептических показателей воды при различных концентрациях вещества (карбоксиметилированный крахмал, таблица 4.1.2).
Таблица 4.1.2
Влияние карбоксиметилированного крахмала на органолептические показатели водной среды
| Концен-трация, мг/л | Органолептические показатели | ||||
|---|---|---|---|---|---|
| Запах | Цвет | Прозрачность | Мутность | Осадок | |
| В о д а | |||||
| контроль | Естественный | Естественный | 40 см | отсутствует | отсутствует |
| Карбоксиметилированный крахмал (Floplex C 115) | |||||
| 2,0 | отсутствие | без изменения | 40 см | отсутствует | отсутствует |
| 10,0 | отсутствие | - " - | 40 см | отсутствует | отсутствует |
| 25,0 | отсутствие | - " - | 39 см | малая суспензия | отсутствует |
| 50,0 | отсутствие | - " - | 39 см | малая суспензия | отсутствует |
| 250,0 | отсутствие | - " - | 35 см | средняя суспензия | видимый |
| 1250,0 | отсутствие | - " - | 30 см | густая суспензия | Выраженный |
4.2. Оценка влияния вещества на процессы самоочищения
4.2.1. Вводная часть
Нарушение жизнедеятельности бактериального населения микробиоценоза водной среды под действием химических веществ может привести к изменению качества водной среды и, в конечном итоге, к деградации экосистемы водного объекта. В связи с этим, при установлении ПДК вещества следует определять его влияние на разные группы бактерий-минерализаторов. Для экспериментального исследования предлагается определять общее микробное число (ОМЧ) - число аэробных и факультативно-анаэробных микроорганизмов, использующих для своего питания органические вещества, образующие на питательном агаре или петрифильмах колонии при температуре 36°С (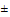 2) в течение 24-х часов или при температуре 20°С (
2) в течение 24-х часов или при температуре 20°С (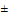 2) в течение 48-ми часов.
2) в течение 48-ми часов.
4.2.2. Характеристика тест-организма
Первыми начинают процесс минерализации микроорганизмы, разлагая азотсодержащую органику с постадийным образованием аммонийного азота до нитритов и затем до нитратов.
Для изучения процессов минерализации и окисления органических веществ необходимо исследовать образцы воды по следующим показателям:
а) ОМЧ. Если исследуемое вещество легко усваивается бактериями, их численность значительно возрастает, превышая численность в контроле, а если токсично - количество микроорганизмов снижается.
б) Дыхание бактерий. Определяется по БПК5. Этот показатель характеризует физиологическую активность бактерий и не всегда коррелирует с численностью бактерий (в связи с тем, что токсическое действие некоторых ксенобиотиков выражается в увеличении численности бактерий на фоне снижения их физиологической активности).
в) Концентрация растворенного кислорода. Показатель аэробного состояния среды.
г) Аммонийный азот. Продукт метаболизма сапрофитов-аммонификаторов.
д) Азот нитритов. Продукт метаболизма нитрификаторов 1-й фазы.
е) Азот нитратов. Продукт метаболизма нитрификаторов 2-й фазы.
ж) рН среды. Показатель активной реакции среды.
Длительность наблюдения обусловлена сроком полной минерализации азотсодержащей органики в нормальных условиях до стабильной формы азота в виде нитратов. Момент окончания опыта определяют выходом концентрации нитратов в контрольном экспериментальном сосуде на стационарный уровень (плато), что происходит на 25-30-е сутки.
4.2.3. Проведение исследований
4.2.3.1. Необходимое оборудование используется согласно ГОСТ 24849-2014 "ВОДА. Методы санитарно-бактериологического анализа для полевых условий".
4.2.3.2. Предварительный опыт проводят с пятью или шестью концентрациями исследуемого вещества, различающимися на порядок. Исследование проводят в стеклянных кристаллизаторах, наполовину заполненных природной водой из чистого водного объекта, профильтрованной через мельничное сито N 76. Во все сосуды вносят пептон из расчета 3 мг/дм3, который обеспечивает БПК5, не превышающее 5 мгО2/дм3, и соответствующее количество исследуемого вещества. В контрольный сосуд исследуемое вещество не вносят.
В предварительном опыте контролируется только один показатель - ОМЧ. Показатель ОМЧ определяют чашечным методом, (либо методом посева на петрифильмы) путем высева определенного объема воды или ее разведения в стерильную чашку Петри с последующей заливкой охлажденного до температуры 36-38°с питательным агаром, инкубировании посевов и подсчетом выросших колоний микроорганизмов. Засеивают одновременно не менее 2-х чашек Петри.
Отбор проб для посевов проводят ежедневно в течение 4-5 суток. На основании полученных результатов планируют основной опыт.
При работе с искусственной морской водой - в подготовленную искусственную морскую воду (пункт 2.10 N приложения 1) вносят предварительно выращенную на МПА морскую естественную микрофлору из природной морской воды или морского аквариума (из расчета 1 тыс.кл/мл). Выдерживают при комнатной температуре в течение недели (время адаптации) - для размножения бактерий и стабилизации гидрохимических параметров. После этого проводят токсикологический эксперимент.
4.2.3.3. Основной опыт ставят при тех же условиях, что и предварительный опыт. Оценивают действие вещества в пяти концентрациях, из которых максимальной служит та наименьшая концентрация, которая в предварительном опыте снижала общую численность микроорганизмов по сравнению с контролем более чем на 25%. Другие концентрации различаются не более чем в 5 раз. Опыт проводят в трех повторностях.
4.2.4. Учет и анализ результатов
В ходе длительного опыта учитывают следующие показатели:
рН - в исходные, на 10, 20 и 30 сутки;
растворенный кислород - в исходные, на 2, 5, 7, 10 и 15 сутки;
численность сапрофитов, растущих на МПА:10, - в исходные, на 1, 3, 5 и 7 сутки;
БПК5 - в исходные, на 2, 5 и 7 сутки;
азот аммонийный - в исходные, на 5, 7, 10 и 15 сутки;
азот нитритов - на 5, 7, 10, 12 и 15 сутки;
азот нитратов - на 7, 12, 20, 25 и 30 сутки.
Химические определения проводят по общепринятым методикам либо на поверенных и внесенных в гос. реестр СИ приборах (для О2, рН и ионометрах для азота).
Результаты перечисленных определений обрабатывают статистически и оценивают статистическую значимость отклонения опытных величин от контрольных (Приложение 4). Допустимыми концентрациями считаются такие, которые не вызывают статистически значимого отклонения исследуемых показателей от контрольных.
Приложение 2
к Методическим указаниям по разработке нормативов
качества воды водных объектов рыбохозяйственного значения,
в том числе нормативов предельно допустимых
концентраций вредных веществ
водах водных объектов рыбохозяйственного значения
Требования
к разработке максимальных допустимых концентраций вещества для пресноводных биологических тест-организмов
1. Установление максимальной допустимой концентрации вещества для одноклеточных водорослей
1.1. Введение
Планктонные одноклеточные водоросли (фитопланктон), как и высшие водные растения, представляют в водных экосистемах группу организмов-продуцентов.
Из двух видов рекомендуемых одноклеточных водорослей для исследований может быть выбран один, в зависимости от возможностей и традиций лаборатории. Другие виды водорослей могут быть использованы только в дополнение к обязательным видам.
Для экспериментов используют культуру водорослей в экспоненциальной фазе роста. Большое значение имеет физиологическое состояние культуры, проверяемое по эталонному (стандартному) веществу.
Оценка влияния вещества на одноклеточные водоросли оценивается по показателям изменения численности клеток водорослей (снижение или увеличение) в опытной среде по сравнению с контролем.
Статистически значимое снижение численности клеток водорослей в растворе вещества является показателем токсического действия раствора вещества.
Критерием эвтрофирующего эффекта вещества является статистически значимое увеличение численности клеток водорослей в различных концентрациях вещества. Лимитирующий показатель вредности в данном случае - санитарный.
Наряду с изучением динамики численности водорослей к регистрируемым показателям в опыте следует относить изменение рН; визуальные наблюдения за состоянием культуры водорослей: изменения в окраске, форме клеток и состоянии суспензии (взвешенное, опускание на дно, всплывание к поверхности, гомогенность или агрегация) по сравнению с контролем.
В качестве экспресс-метода оценки токсичности (эвтрофирования) химического вещества можно использовать приборный метод быстрой или замедленной флуоресценции водорослей. Показания изменения флуоресценции водорослей в растворах вещества по отношению к контролю следует относить к основным показателям, характеризующим процессы жизнедеятельности одноклеточных водорослей. Показания быстрой и замедленной флуоресценции относятся только к живым клеткам, отражают интенсивность процесса фотосинтеза водорослей, по калибровочной кривой позволяют определить количество живых клеток в эксперименте.
Кратковременная оценка токсичности раствора вещества - до 24-96 ч - позволяет определить наличие острого токсического действия вещества на одноклеточные водоросли, а длительное исследование - до 14 суток - его хроническое токсическое действие.
К дополнительным показателям при исследовании следует относить: оценку биомассы водорослей (полученную расчетным методом), оценку скорости и темпа деления клеток (расчет генераций), содержание фотосинтезирующих пигментов (хлорофилла и каротиноидов), соотношение живых и мертвых клеток водорослей (используя люминесцентный микроскоп или различные витальные красители -цитохимический метод).
1.2. Характеристика тест-организма
В качестве основных стандартных тест-организмов используются лабораторные альгологически чистые монокультуры одноклеточных зеленых водорослей сценедесмус или хлорелла, относящиеся к родам сценедесмус (Scenedesmus quadricauda (Turp.) Breb., S.acuminatus (Lagerh.) Chod) и хлорелла (Chlorella vulgaris Beyer, Chl. pyrenoidosa Chick). Чаще других в лабораторной практике используют виды S. quadricauda и Chl. vulgaris
Сценедесмус широко распространен в водных объектах России и имеет относительно крупные удлиненно-овальные клетки с закругленными концами. Размер клеток 7-432,5-16 мкм. Клетки неподвижные, собранные в виде плоских пластинок (ценобии) по 2-, 4-, реже 8, 16 клеток. Размножение автоспорами. Автоспоры в материнской оболочке располагаются пучком, после освобождения разворачиваются в виде пластинки.
Хлорелла распространена в водных объектах южных широт. Клетки одиночные, шаровидные, с тонкой оболочкой, без слизи. Хроматофор чашевидный, с пиреноидом. Размножение автоспорами, образующимися по 4-8, реже 16 и освобождающимися через разрыв материнской оболочки. Диаметр клеток 4,2-10,5 мкм.
После пересева культур на новую среду экспоненциальная фаза роста наступает на 3 сутки.
Численность клеток за 3 суток увеличивается не менее чем в 3 раза.
1.3. Условия лабораторного содержания одноклеточных водорослей
Используется обычное лабораторное оборудование, приборы, посуда и реактивы, в том числе:
фильтровальная установка любого типа;
фильтры мембранные (размер пор 3,5 мкм, 0,45 мкм);
пипетки автоматические-дозаторы объемом 0,1, 0,2 см3;
камера счетная Горяева или Фукс-Розенталя;
предметные и покровные стекла;
климатостат (люминостат) любого типа, оснащенный лампами дневного света 3000-6000 лк, обеспечивающий поддержание температуры (20  2)°С;
2)°С;
спиртовка;
рН-метр;
оксиметр любого типа с погрешностью измерения не более 0,5 мг/дм3;
микроскоп биологический, обеспечивающий увеличение в 100-200 раз;
стаканы стеклянные лабораторные объемом 100, 500, 1000 см3;
колбы конические емкостью 50, 100, 250, 1000 см3;
эталонное (стандартное) химическое вещество: калий двухромовокислый (бихромат калия) или стандарт-титр калия двухромовокислого для проверки физиологической чувствительности культуры водорослей;
культуры зеленых одноклеточных водорослей Scenedesmus quadricauda (Turp.) Breb. и Chlorella vulgaris Beyer.
Культивируют водоросли (таблица 1.3) на среде Прата или на среде Успенского N1.
Таблица 1.3.
| Компоненты среды | Концентрация в среде для культивирования, г/дм3 | Концентрация исходных растворов для приготовления среды, г/100см3 | ||
|---|---|---|---|---|
| Прата | Успенского N1 | Прата | Успенского N1 | |
| KNO3 | 0,1 | 0,025 | 10,0 | 2,5 |
| MgSO4·7Н2О | 0,01 | 0,025 | 1,0 | 2,5 |
| Ca(NO3)2·4Н2О | - | 0,144 | - | 14,4 |
| К2НРО4·3Н2О | 0,01 | - | 1,0 | - |
| КН2РО4 ·3Н2О | - | 0,025 | - | 2,5 |
| К2СО3 | - | 0,0345 | - | 3,45 |
| FeCl3·6Н2О | 0,001 | - | 0,1 | |
Питательные среды Прата и Успенского для культивирования водорослей готовят на дистиллированной воде. Чтобы избежать образования осадка в питательной среде, каждый ее компонент предварительно готовят отдельно в 100 см3 дистиллированной воды (исходный раствор). Исходные растворы хранят в холодильнике при температуре от +2°С до +4°С в течение месяца, в случае помутнения производят их замену.
Из исходных растворов каждого вещества (кроме солей железа) по 1 см3 добавляют в колбу объемом 1 дм3, наполовину наполненную дистиллированной водой (добавление в последовательности расположения веществ в таблице 1.3.). Доливают колбу дистиллированной водой до объема 1 дм3, перемешивают, после чего питательную среду стерилизуют в автоклаве (30 мин. при 1 атм.) или кипячением на водяной бане в течение 30 мин. После охлаждения стерилизованной среды в нее добавляют соль железа в количестве 1 см3 на 1 дм3 среды (для среды Прата 1%-й раствор FeCl3·6H2O; для среды Успенского 1% - растворы одного из солей железа FeCl3, Fe2(SO4)3, Fe(NH3)(SO4)2 или цитрат железа).
Приготовленную среду хранят до использования в темном месте при комнатной температуре.
Культивируют водоросли в люминостате в конических колбах объемом 250-300 см3, закрытых фольгой или ватно-марлевым тампоном. Освещенность 3000-6000 люкс. Соблюдается световой суточный ритм. Культуру водорослей периодически перемешивают, встряхивая 1-2 раза в сутки. Температура при культивировании водорослей 20 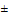 2°С.
2°С.
Повышение температуры до 25°С и выше усиливает токсическое действие, а понижение ее до 12-15°С задерживает проявление эффекта и снижает действие вещества.
Водоросли рекомендуется один раз в десять дней пересевать. Для этого в чистую простерилизованную колбу объемом 250 см3 со свежей средой (100-150 мл) над пламенем спиртовки приливают примерно 15-20 см3 верхнего росткового слоя из колбы ранее культивируемых водорослей. Колбу закрывают ватно-марлевым тампоном или фольгой, перемешивают, записывают на колбе название культуры, дату посева и ставят в люминостат. В течение дня содержимое колбы перемешивают 1-2 раза.
1.4. Проведение испытаний
Опыты проводят при оптимальной температуре и освещении (пункт 1.3 приложения N 2). Используют водоросли в экспоненциальной фазе роста, что соответствует трехсуточной культуре водорослей после пересева.
В опыте используют начальную плотность клеток 20-25 тыс.кл/см3. Для этого нужная плотность клеток в опыте достигается расчетом, исходя из объема тестируемой (контрольной, опытной) воды (например, 100 мл) и численности клеток в культуре в экспоненциальной фазе роста (примерно 5 млн.кл/см3). В указанном случае в опытную и контрольную воду добавляется по 0,5 см3 трехсуточной культуры водорослей.
Периодически (не реже 1 раза в месяц) необходимо проводить контроль физиологической чувствительности водорослей. Для этого используют стандартное (эталонное) вещество - двухромовокислый калий К2Cr2O7 марки химически чистый ("хч") или стандарт-титр калия двухромовокислого.
Готовят маточный раствор двухромокислого калия концентрацией 1г/дм3. Далее методом разбавления - серию растворов с концентрациями 0,12; 0,25; 0,5; 1,0; 2,0; 3,0 мг/л. Исследование проводят в течение 48 ч в трех повторностях. По результатам опыта рассчитывают среднюю концентрацию К2Cr2O7, вызывающую уменьшение численности клеток на 50% за 48 ч (ЛК50 за 48 ч). Если полученное значение ЛК50 находится в интервале 1,3-2,5 мг/л, то культура водорослей может быть использована для экспериментов.
Если полученные значения ЛК50 не попадают в указанный интервал, то эксперименты с водорослями не проводят, выясняют причину (условия культивирования, состав культуральной среды и проч.). Иногда культуру водорослей заменяют и проводят эксперименты заново.
При постановке острых и хронических экспериментов в контрольные и опытные колбы емкостью 250 мл наливают по 100 мл (в колбы емкостью 100 мл - по 50 мл) контрольной среды или исследуемой концентрации вещества. Контролем служит культуральная среда, на которой культивируются водоросли (среда Прата или среда Успенского N1). Концентрации веществ также готовят на соответствующей среде.
Колбы закрывают ватно-марлевыми пробками или фольгой, их содержимое тщательно перемешивают и в каждой колбе определяют исходную численность клеток, которая должна составлять 20-25 тыс.кл/см3. Колбы помещают в люминостат.
В эксперименте должно быть исследовано не менее 5 концентраций вещества. Повторность трехкратная.
Эксперименты на водорослях проводятся в 2 этапа: предварительный и основной (окончательный).
В предварительном остром эксперименте находят интервал токсичных концентраций. Опыты проводят в широком диапазоне концентраций вещества, которые отличаются в геометрической прогрессии (коэффициент 10). Например, 0,01; 0,1; 1,0; 10,0 мг/л и т.д. По результатам эксперимента определяется диапазон концентраций для основного острого и хронического экспериментов.
В основном остром и хроническом экспериментах шаг между концентрациями изменяется в 2-5 раз. Подсчет клеток водорослей проводят в остром опыте ежедневно, в хроническом - на 1, 2, 3, 4, 7, 10, 14 сутки.
На 14 сутки от начала эксперимента опыт прекращают и устанавливают, оказывают ли исследуемые концентрации вещества хроническое токсическое или эвтрофирующее действие на водоросли.
1.5. Учет и анализ результатов
Основным критерием токсичности действия веществ на тест-организм следует считать изменение численности клеток водорослей, последовательность прохождения ими всех стадий развития и их способности к размножению.
Для подсчета численности клеток используют счетную камеру Горяева или счетную камеру Фукса-Розенталя.
При работе с камерой Горяева - камеру и покровное стекло обезжиривают (промывают спиртом). Затем из колбы наносят пипеткой по капле суспензии водорослей на верхнюю и нижнюю сетки счетной камеры, накрывают камеру покровным стеклом, которое притирают по бокам до появления колец интерференции. Через 1-2 мин. начинают подсчет водорослей в 5 больших квадратах камеры, расположенных по диагонали сетки счетной камеры, или в 25 больших квадратах всей камеры при малой плотности водорослей. Под микроскопом просчет из каждой контрольной и опытной колбы проводят не менее трех раз.
По окончании эксперимента рассчитывают численность клеток водорослей в остром и хроническом опытах по сравнению с контролем.
Рассчитывают численности клеток на 1 см3 среды следующим образом: количество клеток в 25 больших квадратах камеры Горяева умножают на 10, получая количество клеток в 1 см3 суспензии.
Учет численности клеток можно также проводить в камере Фукса-Розенталя объемом 3,2 мл. При высокой численности клеток просчитывают по диагонали 16 квадратов, при малой - считают по всему полю камеры. Количество клеток также выражают в 1 см3. Расчет клеток производят по формуле:
,
где М - количество клеток в 1 см3;
m - количество просчитанных клеток (сумма);
n - количество просчитанных маленьких квадратов камеры;
V - объем части камеры, имеющей площадь маленького квадрата.
Результаты исследования учитывают, если численность клеток водорослей в контроле увеличивается за 96 ч не менее чем в 3 раза. При изменении численности клеток в контроле менее чем в 3 раза результаты опыта считаются недействительными.
Используя приемы статистической обработки, устанавливают статистическую значимость различия (снижение или увеличение) численности клеток между и опытом и контролем (приложение N 4 к настоящим Методическим указаниям).
Численность живых и мертвых клеток определяют с помощью люминесцентной микроскопии. Ранжируя клетки по интенсивности свечения, можно установить время воздействия вещества на водоросли, степень и скорость отмирания.
На практике в основном различают три цвета - жизнеспособные клетки светятся ярким пурпурно-красным светом, отмирающие - различными оттенками тускло-красного или оранжево-красного тона, мертвые - желтовато-салатным. При подсчете клеток водорослей учитываются все три группы - живые, мертвые и отмирающие клетки. В стадии интенсивного роста клеток водорослей в культуре наблюдается минимальное присутствие мертвых клеток.
Помимо люминесцентной микроскопии разделение живых и мертвых клеток может проводиться путем микроскопии в видимой области с использованием специальных красителей.
Активная реакция среды - изменение рН среды служит интегральным косвенным показателем состояния культуры. Чем выше жизнеспособность водорослей, тем значительнее изменяется на свету реакция среды (подщелачивание) в результате фотосинтетической ассимиляции углекислоты. Измерение рН среды осуществляется с помощью рН-метра, что является обязательным в начале и конце опыта, при хроническом эксперименте - в дни учета биологических показателей.
2. Установление максимальной допустимой концентрации вещества для планктонных ракообразных
Ракообразные включены в схему по определению ПДК вещества в качестве типичного представителя звена зоопланктона и важнейшего кормового объекта.
Метод с использованием ветвистоусых ракообразных в качестве тест-организмов является одним из наиболее широко применяемых в практике водной токсикологии у нас в стране и за рубежом. Наиболее часто используются виды дафний, цериодафний, моин (Daphnia magna, D.longispina, D.carinata, Ceriodaphnia affinis, Moina macrocopa).
В настоящее время рекомендуется использовать D. magna - стандартный биотест для токсикологических исследований в ряде стран, а также С. affinis, цикл развития которой в два раза короче, чем у дафний. Метод с использованием цериодафний при строгом соблюдении условий опыта вдвое короче, чем с использованием дафний. Эксперименты с более мелкой цериодафнией компактны - требуются меньшие объемы растворов и посуды. Однако на более крупных дафниях удобнее производить измерения, вести наблюдения за показателями размножения (четче выявляются патологические отклонения - абортирование яиц, эмбрионов, уродства).
В связи с большей требовательностью цериодафний к кислородному режиму среды, они более чувствительны к органическому загрязнению и веществам, снижающим концентрацию растворенного кислорода в воде. С. affinis типичный олиго-?-сапробный организм, а D. magna - ?-?-сапробный. По отношению к действию тяжелых металлов видовая чувствительность дафний выше, чем цериодафний.
Оценку токсичности на ветвистоусых ракообразных разных видов можно проводить по единой методике, изменяя процедуру постановки опытов с учетом индивидуальных биологических характеристик вида - разной продолжительности цикла развития, размеров, оптимальных условий содержания.
Методика определения хронической токсичности вещества на ракообразных - длительный опыт на серии трех поколений D. magna или С. affinis.
Проведение исследований на серии генераций предпочтительно тогда, когда есть основания полагать, что отрицательное действие веществ может накапливаться в поколениях.
Для работы с ракообразными необходимо иметь следующее оборудование и материалы:
В помещении должен быть установлен вытяжной шкаф, климатостат или термолюминостат, холодильник, компьютер, центрифуга;
микроскоп биологический, обеспечивающий увеличение в 100-200 раз;
бинокуляр;
рН-метр;
оксиметр;
аквариумные компрессоры;
аквариумы для хранения чистой воды (от 10 до 50 л);
камера Горяева;
стаканы химические (на 0,05-3,0 л);
пробирки;
колбы мерные (на 0,1-2 л);
цилиндры мерные (на 0,5-2 л);
колбы конические (на 0,2-0,5 л);
кристаллизаторы (на 0,5-1,0 л);
пипетки мерные (на 0,1-10 мл);
плоские стеклянные емкости для выращивания водорослей (на 1-1,5 л);
шелковые мельничные сита, аквариумные сачки, реактивы, входящие в состав сред для выращивания водорослей.
2.1. Дафния магна
2.1.1. Введение
Предлагаемая методика с использованием дафний вошла в состав ряда методических указаний и рекомендаций по установлению токсичности сточных и природных вод.
2.1.2. Характеристика тест-организма
Рачки вида Daphnia magna Straus (класс Branchiopoda, Cladocera, отряд Diplostraca, семейство Daphniidae) обитают в стоячих и слабопроточных водных объектах, особенно часто - во временных лужах, и распространены повсеместно на территории России.
Этот вид способен переносить осолонение до 6_. Оптимальное содержание кислорода для дафнии составляет 7-8 мг/л, однако рачок способен переносить снижение концентрации растворенного в воде кислорода до 2 мг/л. Оптимальные значения активной реакции среды рН составляют 7,0-8,0, однако временные изменения рН в пределах 5,8-9,0 не подавляют существенным образом жизнедеятельность дафнии.
При культивировании и проведении токсикологических опытов необходимо поддерживать непрерывное партеногенетическое размножение рачков, учитывая особенности биологического цикла развития рачков.
В оптимальных условиях содержания выживаемость дафний не зависит от времени года, оставаясь на уровне 80-100% к концу опытов. Средние значения плодовитости за 30 суток опытов (за это время получают 7-8 пометов) составляют от 60 до 170 экземпляров молоди на одну самку. Могут наблюдаться повторяющиеся снижения плодовитости рачков в зимний (ноябрь-январь) и летний (июнь-июль) периоды. Длительность культивирования рачков в лаборатории в оптимальных условиях даже в течение 10 лет не влияет на результаты опытов.
2.1.3. Условия лабораторного содержания
Работу с дафниями необходимо проводить в помещении, где не используются химические летучие вещества. Недопустима также обработка помещения хлор- и фосфорорганическими пестицидами для борьбы с насекомыми и грызунами.
Культуру дафний получают в специализированных лабораториях или отлавливают в природном водном объекте. Для постепенной адаптации дафний рекомендуется смешивать 1 часть воды, в которой рачки предварительно культивировались, с тремя частями лабораторной воды. Культуральная среда обновляется полностью или частично 1 раз в неделю. В новых лабораторных условиях необходимо получить как минимум 3 поколения рачков до начала использования культуры в опытах.
Стабильные условия культивирования обеспечиваются в климатостате (термолюминостате).
Для культивирования дафний используют отстоянную водопроводную биологизированную воду или воду из незагрязняемых водных объектов. Отбор воды из природных водных объектов лучше производить в ясную погоду, желательно после ряда дней без дождя. Неблагоприятное действие на рачков может оказать вода, взятая в паводковый период. Природную воду необходимо процеживать через сито (N 68-72) во избежание попадания простейших и коловраток, которые могут паразитировать на рачках. Водопроводной водой можно пользоваться после предварительного удаления из нее остаточного хлора путем длительного продувания воздуха с помощью аквариумного компрессора (около 14 дней). На дно аквариума насыпают хорошо промытый песок, сажают 5-10 растений.
Водопроводной водой можно пользоваться после предварительной подготовки. Рекомендуется трехступенчатая очистка и биологизация лабораторной воды. Для получения биологизированной воды водопроводная вода проходит очистку бытовым проточным фильтром, отстаивается и дехлорируется в аквариуме в течение двух недель с использованием микрокомпрессоров для ее принудительной аэрации атмосферным воздухом. Затем вода поступает в аквариум с песчаным грунтом и высшей водной растительностью для биологизации - насыщения воды метаболитами макрофитов. Спустя две недели вода переливается в третий аквариум с микрокомпрессором и используется для лабораторных нужд. Перед применением воду необходимо процеживать через сито (N 68-72) во избежание попадания простейших и коловраток, которые могут паразитировать на рачках.
Основные гидрохимические показатели воды, используемой для культивирования дафний, должны находиться в следующих пределах:
а) содержание кислорода 7-8 мг О/л;
б) рН - 7,0-8,2;
в) окисляемость по Кубелю 4,2-5,8 мг О/л;
г) общая жесткость 3,0-6,5 мгэкв/л (20 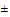 5 мг СаСО);
5 мг СаСО);
д) соотношение Ca/Mg 4:1;
е) NH, NO отсутствие, следы.
В качестве основного корма для дафний могут быть использованы зеленые протококковые водоросли и в качестве дополнительного - пекарские дрожжи только для маточных культур. Дрожжами дафний можно подкармливать 1-2 раза в неделю из расчета 3 мл 1%-й суспензии на 1 дм3 среды. Взвесь дрожжей хранится в холодильнике не более трех дней.
Состав сред для культивирования кормовых водорослей представлен в таблице 2.1.3.
Быстрый рост накопительной культуры водорослей хлореллы (Chlorella sp.) создается при соблюдении следующих условий: питательная среда с добавлением микроэлементов (Тамия), круглосуточное освещение лампами дневного света (2-4 тыс.лк) и интенсивное продувание атмосферным воздухом (аэрация) с помощью аквариумных компрессоров. При выращивании водорослей на средах Успенского и Прата (с меньшим количеством солей) аэрация не требуется, но рост водорослей идет значительно медленнее.
Питательные среды для водорослей готовят на дистиллированной воде (пункт 2.2 приложения N 1 настоящих Методических указаний). Растворы солей железа и микроэлементов можно добавлять во все среды независимо от того, указано это в прописи среды или нет.
Исходная концентрация водорослей должна быть около 2 млн.кл/дм3. Через 7-10 дней роста в оптимальных условиях культура достигает максимальной плотности.
Для кормления водоросли отделяют от питательной среды путем центрифугирования или отстаивания в холодильнике в течение 3-5 дней. Осадок разбавляется дистиллированной водой и хранится в холодильнике не более трех недель.
Таблица 2.1.3.
Состав сред для культивирования кормовых водорослей
| Соли | Содержание солей в средах, г/дм3 | ||
|---|---|---|---|
| Тамия | Успенского | Прата | |
| KNO3 | 5,00 | 0,025 | 0,1 |
| MgSO4 *7H2O | 2,50 | 0,025 | 0,01 |
| К2НРO4 *3Н2О | - | - | 0,01 |
| КН2РO4 *3Н2О | 1,25 | 0,025 | - |
| КСО3 или (К2СО3) | - | 0,0345 | - |
| FeSO4* 7H2O | 0,003 | - | - |
| FeCl3 *6H2O | - | - | 0,001 |
| Ca(NO3)2 *4H2O | - | 0,144 | - |
| Микроэлементы* | по 1см3 растворов N1и N2 | ||
Примечание: раствор микроэлементов N 1: Н3ВО3 - 2,86 г/дм3; MnCl2*4Н2О -1,81 г/дм3; ZnSO4*7H2O - 0,222 г/дм3; раствор микроэлементов N 2: МоО3 - 17,64 мг/дм3; NH4VO3 - 22,96 мг/дм3.
Число клеток в суспензии хлореллы просчитывают в камере Горяева (или любым другим способом - флюораты, приборы определения оптической плотности). Кормление дафний проводится 1 раз в день. Для посева кормовой культуры водорослей используют часть культуры, которую не подвергали центрифугированию. Посевной материал хранят в холодильнике (6-8°С) не более месяца.
Для культивирования рачков удобны небольшие стеклянные емкости объемом 1-3 дм3, плотность посадки 20-25 особей на 1 дм3. Появившуюся молодь в необходимом количестве отсаживают в следующие сосуды от поколения к поколению. Когда вновь народившиеся рачки начинают размножаться, материнские особи удаляют, а народившуюся молодь из культуры используют в эксперимент или удаляют после рождения. Каждое поколение маркируют и ставят дату рождения. Одновременно в лаборатории содержат культуры двух поколений дафний.
2.1.4. Проведение исследований на сериях генераций
Требования к тест-организму. Для токсикологических исследований используют дафний, начиная с третьего поколения, полученного в лаборатории. Перед проведением эксперимента оценивают устойчивость рачков к бихромату калия. По величинам ЛК50 за 24 ч определяют соответствие культуры стандарту. Эта концентрация для дафний в возрасте 18  6 ч должна находиться в пределах 0,9-2,0 мг/л.
6 ч должна находиться в пределах 0,9-2,0 мг/л.
2.1.4.1. Оценка острой токсичности. Основная цель острых (краткосрочных) опытов на дафниях - установить концентрации исследуемого вещества, которые в водных объектах могут вызвать массовую гибель наиболее продуктивной части зоопланктона - фильтраторов. Кроме того, устанавливается концентрация, начиная с которой следует проводить хронические (длительные) эксперименты.
Острые опыты по оценке токсичности состоят из двух экспериментов - предварительного и основного.
Предварительный эксперимент проводят с набором 3-5 концентраций вещества, различающихся в 10 раз. Длительность такого опыта 48 ч, он позволяет установить порядок остролетальных концентраций веществ.
Основной острый опыт проводится на основании результатов предварительного варианта с набором около 5 концентраций. Выбирают такой диапазон концентраций вещества, которые вызывают иммобилизацию или гибель 10-90% рачков. Продолжительность основного острого опыта 48 ч.
В экспериментальные стеклянные стаканы заливают возрастающие концентрации исследуемых растворов в количестве по 100 см3 и помещают по 10 односуточных дафний. Повторность опытов в предварительном эксперименте составляет 2-3, а в окончательном - не менее трех.
Условия проведения опытов: температура 20  2°С, световой день - 12 ч, вода по своим свойствам должна соответствовать требованиям, перечисленным выше (п.2.1.3 приложения 2). В ходе острых опытов рачков не кормят. При работе со стабильными веществами замену растворов не проводят. В случае, когда исследуется быстро распадающееся вещество, исследования проводят с ежедневной заменой растворов.
2°С, световой день - 12 ч, вода по своим свойствам должна соответствовать требованиям, перечисленным выше (п.2.1.3 приложения 2). В ходе острых опытов рачков не кормят. При работе со стабильными веществами замену растворов не проводят. В случае, когда исследуется быстро распадающееся вещество, исследования проводят с ежедневной заменой растворов.
2.1.4.2. Учет и анализ результатов в острых опытах.
В острых опытах основным показателем токсичности среды является выживаемость дафний. Наблюдения за выживаемостью дафний проводят непрерывно в течение первого часа воздействия, затем ежечасно в первый день наблюдений и 2-3 раза в день - в последующие сроки.
Время гибели рачков отмечают по наступлению неподвижности (иммобилизации), при которой дафнии лежат на дне стакана, плавательные движения отсутствуют и не возобновляются при покачивании стакана. Данные по выживаемости рачков записывают в таблицу по форме 1.
Форма 1
Учет выживаемости дафний в растворах токсиканта
| Дата/Время | Срок | Т°С | Контроль | Концентрации токсиканта | |||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| Концентрация 1 | Концентрация 2 и т.д. | ||||||||||
| Повторность 1 | Повторность 2 | Повторность 3 | Повторность 1 | Повторность 2 | Повторность 3 | Повторность 1 | Повторность 2 | Повторность 3 | |||
В качестве дополнительных показателей в остром опыте можно учитывать: изменение окраски тела, кишечника, жирового тела, гонад, изменение наполнения кишечника, а также поведенческие реакции. Изменения перечисленных показателей нередко предшествуют гибели организмов, что позволяет использовать их для ранней диагностики.
По результатам острых опытов определяют концентрацию вещества, вызывающую гибель 50% подопытных организмов за 48 ч экспозиции (ЛК5048) (Приложение 4 к настоящим Методическим указаниям).
Может быть определено также для каждой концентрации вещества медианное время выживания (ЛВ50), то есть время выживания 50% организмов при данной концентрации.
Результаты опытов дают возможность оценить также наличие острой токсичности по концентрациям, вызывающим статистически значимое снижение выживаемости рачков по сравнению с контрольными и определить максимальную концентрацию, при которой острая токсичность не проявляется.
Полученные результаты считают приемлемыми, если удовлетворены следующие условия:
а) гибель контрольных дафний не превышает 10%;
б) ЛК50 бихромата калия за 24 ч для дафний в возрасте 18  6 ч находятся в диапазоне 0,9-2,0 мг/л;
6 ч находятся в диапазоне 0,9-2,0 мг/л;
в) содержание растворенного кислорода, определенное в конце опыта, составляет не ниже 4,0 мг О2/л.
2.1.4.3. Оценка токсичности в хроническом эксперименте.
Хронические (длительные) опыты с дафниями служат для глубокого, более детального исследования токсичности химических соединений.
Для хронических опытов подбирают 3-4 концентрации вещества, составляющие ряд концентраций, начиная от ? значения ЛК50 за 48 ч с шагом 2,0-2,5.
В каждой серии эксперимента (контрольной или опытной) используют не менее 20 рачков, а опыты ставят не менее чем в трех повторностях (приемлемы 4 повторности по 5 дафний или 3 повторности по 7 дафний). В опытные стаканы заливают растворы, исходя из соотношения 50 см3 на 1 дафнию. Возраст рачков 18  6 ч.
6 ч.
Общие условия (температура, освещенность) проведения хронических опытов те же, что и в острых опытах. Рачков ежедневно кормят хлореллой в концентрации 350-700 тыс.кл/см3. Частота замены растворов определяется свойством веществ, но не реже двух раз в неделю. При смене растворов сохраняют соотношение 50 см3 на 1 дафнию, если рачки погибают, количество исследуемого раствора пропорционально уменьшают.
Продолжительность опытов с каждой генерацией дафний составляет 20 суток, а общая продолжительность опытов - 40-45 суток.
При проведении опытов на поколениях придерживаются следующей схемы: молодь из первого помета, появившуюся от исходных особей, отсаживают в таком же количестве в растворы вещества с концентрациями, при которых проводились исследования с исходными особями. Так же получают следующее поколение. Таким образом, наблюдения ведут на протяжении трех поколений (исходное, первое и второе) (таблица 2.1.4.3).
Таблица 2.1.4.3.
Схема опытов на серии генераций дафний
| Оцениваемое поколение | Учитываемые пометы | Сумма молоди |
|---|---|---|
| Исходное Fисх | Fисх1,Fисх 2,Fисх3,Fисх4 | ?Fисх1-4 |
| Первое F1 | F11,F12,F13,F14 | ?F11-4 |
| Второе F2 | F21,F22,F23,F24 | ?F21-4 |
Примечание: F - поколения; верхний индекс - пометы каждого поколения; нижний индекс - оцениваемое поколение.
2.1.4.4. Учет и анализ результатов в хроническом опыте.
Основными показателями токсического действия являются выживаемость, рост, плодовитость и качество потомства. При наблюдении за размножением рачков учитывают время наступления половозрелости в днях, регистрируемое по моменту откладки яиц в выводковую камеру, время рождения первого помета, количество народившейся молоди в каждом помете. Необходимо учитывать также патологические отклонения: количественный учет абортивных яиц и эмбрионов, мертворожденной и уродливой молоди. В случае появления уродливой молоди ее отсаживают в небольшие сосуды с соответствующими концентрациями исследуемого соединения и наблюдают за ее выживаемостью минимум трое суток.
Наблюдения за выживаемостью и показателями размножения дафний ведут ежедневно, подсчет, анализ и удаление молоди удобно проводить во время смены растворов. Получаемые в ходе опытов результаты регистрируют в форме таблиц для каждой концентрации исследуемого вещества и контроля для всех поколений.
Общее количество народившейся жизнеспособной молоди от одной самки отражает величину реальной (фактической) плодовитости дафний. Эта величина, в конечном итоге, определяет сохранность вида и имеет решающую роль при оценке токсичности.
Суммарное количество образованных яйцеклеток в организме дафний (патология и фактическая плодовитость) составляет потенциальную плодовитость дафний.
В редких случаях химические вещества могут влиять на темп роста рачков, снижая или увеличивая скорость роста на разных этапах жизни. Из каждой концентрации следует проводить измерение по 10-15 рачков после рождения (односуточных), после наступления половозрелости в течение суток и перед окончанием опыта. Измеряют длину рачков от переднего края головы до основания шипа.
По окончании опытов для каждого поколения подсчитывают средние значения выживаемости, плодовитости в пересчете на одну самку, количества патологических отклонений в процентах от реальной плодовитости, размеров в разные сроки. Результаты опытов в растворах вещества сравнивают с контролем, статистическую значимость отклонений результатов опыта от контроля определяют в соответствии с приложением N 4 настоящих Методических указаний.
Полученные результаты считают приемлемыми, если соблюдены следующие условия:
а) гибель контрольных дафний на конец хронического опыта не превышает 20%;
б) количество молоди на 1 самку за 20 суток в контроле - не менее 40 особей;
в) время наступления половозрелости рачков в контроле - не позднее 9 суток;
г) чувствительность культуры дафний (ЛК50 бихромата калия за 24 ч) должна соответствовать диапазону 0,9-2,0 мг/л.
На основании результатов исследований с дафниями в остром и хроническом опыте делают вывод об уровне токсичности исследуемых веществ.
Определение концентраций, не обладающих хроническим токсическим действием, базируется на оценке одного из трех показателей: выживаемости, плодовитости и размеров дафний. Критерием токсичности в опытах на поколениях рачков служит наличие статистически значимого различия хотя бы одного из трех показателей в опыте и в контроле.
При оценке влияния вещества на размножение особое внимание следует уделить эффекту стимуляции, когда количество молоди в опыте превышает количество в контроле. Опыты на серии трех поколений позволяют установить, насколько устойчив этот эффект в поколениях. Если численность молоди в опыте превышает численность в контроле не более чем на 50-70% и не сопровождается патологическими отклонениями в размножении, то стимуляция, как правило, в поколениях не закреплена. Стимулирующий эффект, превышающий 100%, всегда связан с патологическими отклонениями и в ряду поколений приводит к снижению плодовитости.
Число патологических отклонений при развитии у рачков из контрольных серий (чаще всего - абортивные яйца), не должно превышать 10% от величины реальной плодовитости на данный период времени. Появление абортивных яиц может быть связано с ухудшением некоторых условий культивирования: недостатком корма, освещенности, колебанием температуры и качеством воды.
Патологические отклонения, проявляющиеся при исследованиях токсичности вещества, могут указывать на характер действия испытываемого соединения:
а) если у рачков замедлены процессы созревания, снижена численность пометов и количество образованных яйцеклеток, то вещество обладает гонадотропным действием;
б) если у дафний опытной серии величина потенциальной плодовитости равна или превышает контроль, а реальная плодовитость значительно снижена за счет абортивных яиц, эмбрионов и мертворожденной уродливой молоди, то вещество обладает эмбриотропным действием;
в) если у дафний отмечено появление уродливой молоди, которая выживает в исследуемых растворах 3 и более суток, то предполагается наличие мутагенности и необходимо проведение специальных уточняющих экспериментов.
При установлении недействующих концентраций вещества на дафниях лимитирующими показателями, как правило, являются выживаемость и плодовитость. Направленное действие вещества только на размеры дафний наблюдается реже. Химические соединения могут тормозить рост на разных жизненных этапах:
а) если молодь рождается такая же, как в контрольных растворах, но к периоду наступления половозрелости размеры рачков уменьшены, то вещество тормозит рост дафний в ювенильный период;
б) если размеры дафний статистически значимо уменьшены к концу опытов, то вещество подавляло рост дафний в период размножения;
в) если новорожденная молодь в 2 раза мельче, чем молодь контрольных рачков, то результаты указывают на наличие мутагенного эффекта.
Форма 2
Выживаемость дафний в растворах вещества
| Дата | Час | Срок опыта | Контроль | Концентрация С, мг/л | ||||
|---|---|---|---|---|---|---|---|---|
| Повторности 1-я, 2-я, 3-я | Повторности 1-я, 2-я, 3-я | |||||||
| Номера стаканов | Номера стаканов | |||||||
| 1 | 2 | 3 | 1 | 2 | 3 | |||
Форма 3
Изменение биологических показателей у дафний под влиянием вещества
| Дата | Срок опыта в сутках | Контроль | Концентрация С, мг/л | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Поколение | Поколение | ||||||||||||
| Повторность, номера стаканов | Повторность, номера стаканов | ||||||||||||
| Число | абортивные яйца | Число | абортивные яйца | ||||||||||
| дафний | карапаксов | молоди | мертвых | эфиппиумов | дафний | карапаксов | молоди | мертвых | эфиппиумов | ||||
Форма 4
Изменения биологических показателей у дафний в поколениях
| Показатели | Исходные особи | 1-е поколение и т.д. | ||||
|---|---|---|---|---|---|---|
| Контроль | Концентрация, мг/л | Контроль | Концентрация, мг/л | |||
| Выживаемость, % | ||||||
| Срок наступления половозрелости, сут. | ||||||
| Первый помет, сут | ||||||
| Реальная плодовитость | ||||||
| Число абортивных яиц | ||||||
| Число мертворожденных | ||||||
| Число уродливой молоди | ||||||
| Число эфиппиумов | ||||||
| Длина, мм | ||||||
| Ширина, мм | ||||||
2.2. Цериодафния
2.2.1. Характеристика тест-организма
Цериодафнии - рачки вида Ceriodaphnia affinis Lilljeborg (класс Branchiopoda, Cladocera, отряд Diplostraca, семейство Daphnidae) обитают в пресноводных водных объектах Европы, Северной Африки, Азии, Северной Америки. Этот вид населяет водные объекты с замедленным течением - неглубокие озера, реки, водохранилища.
Цериодафния имеет более мелкие размеры, чем дафнии, половозрелые самки 1,5 мм, самцы - 0,8 мм, что позволяет в опытах манипулировать с меньшими объемами воды и более компактными емкостями. Биологический цикл развития от рождения до половозрелости у цериодафний вдвое короче, чем у дафний, при оптимальных условиях развития. Так, при температуре 23 1,0°С созревание наступает на 2-4 сутки от рождения, время первого помета - на 3-5 сутки, а за срок 8-10 суток у рачков получают 3 помета.
1,0°С созревание наступает на 2-4 сутки от рождения, время первого помета - на 3-5 сутки, а за срок 8-10 суток у рачков получают 3 помета.
При температуре 18°С сроки получения трех пометов у рачков могут растянуться до 28 суток. Численность молоди у рачков в первом помете невелика - по 2-6 особей, а начиная со второго помета 6 и более особей на самку. Этот вид цериодафний моно- или дицикличен. Максимум полового периода размножения приходится на август-сентябрь, самки образуют эфиппиум с одним яйцом. В лабораторных условиях самцы появляются при недостаточном освещении, снижении температуры, концентрации растворенного кислорода, голодании.
Цериодафния более чувствительна к кислородному фактору, чем дафния. Нормальное развитие цериодафний протекает при концентрации растворенного в воде кислорода не ниже 5 мгО/л. Вследствие этого цериодафнии более чувствительны к органическому загрязнению и веществам, снижающим концентрацию растворенного кислорода в среде.
2.2.2. Условия лабораторного содержания
Требования к помещению, где содержат цериодафний, такие же, как и с дафниями. Не допустима обработка помещения химическими веществами с целью уничтожения насекомых и грызунов.
Для культивирования цериодафний используют дехлорированную, отстоянную воду, которая должна удовлетворять следующим требованиям:
а) рН 7,0-8,2;
б) общая жесткость - 1,3-2,0 мг·экв/л;
в) содержание растворенного кислорода - 7,0-8,0 мгО/л.
В качестве корма для цериодафнии используют хлореллу - зеленые протококковые водоросли (Chlorella sp.) и пекарские дрожжи. Процедура выращивания водорослей приведена в разделе с дафниями (пункт 2.1. приложения N 2 к настоящим Методическим указаниям).
Для культивирования цериодафний удобны стаканы емкостью 0,5-1 дм3, плотность посадки рачков - из расчета не менее 20 см3 объема среды на одну особь. С целью адаптации рачков к условиям новой лаборатории, их помещают в смешанную воду: 1 часть среды, в которой рачки жили ранее, и 3 части лабораторной воды. Кормление проводят ежедневно, водоросли вносят в концентрации 250-500 тыс.кл/см3; дрожжи дают не чаще одного раза в неделю, желательно перед сменой раствора в концентрации 1-2 см3 1% раствора на 1 дм3. Культуральная среда обновляется полностью один раз в неделю.
Культуру цериодафний выращивают в климатостате, люминостате или боксе при оптимальных условиях содержания: температура 23  1,0°С, освещенность - 400-600 лк, продолжительность светового дня - 12 ч.
1,0°С, освещенность - 400-600 лк, продолжительность светового дня - 12 ч.
При культивировании цериодафний удобно одновременно содержать рачков двух поколений - материнские размножающиеся особи и подрастающую молодь. Продолжительность использования маточных культур ограничивают 20-25 сутками. Отмечается каждое родившееся в лаборатории поколение и ставится дата рождения.
Для токсикологических исследований используют цериодафний, начиная с третьего поколения. Рачков в возрасте 24 2 ч исследуют на устойчивость к стандартному токсиканту - бихромату калия в остром опыте, величина ЛК50 бихромата калия за 24 ч должна находиться в интервале 0,9-3,3 мг/дм3.
2 ч исследуют на устойчивость к стандартному токсиканту - бихромату калия в остром опыте, величина ЛК50 бихромата калия за 24 ч должна находиться в интервале 0,9-3,3 мг/дм3.
2.2.3. Проведение испытаний
2.2.3.1. Острый опыт.
Предварительный острый опыт проводят с набором 3-5 концентраций веществ, различающихся в 10 раз: 100,0-0,001 мг/дм3. Длительность этого опыта 24 ч, он устанавливает порядок остро летальных концентраций веществ.
Основной острый опыт проводится исходя из результатов предварительного варианта с набором около 5 концентраций вещества. Выбирают диапазон концентраций вещества, которые вызывают иммобилизацию или гибель рачков в интервале 10-90%. Обычно эти концентрации отличаются от минимальной летальной в 2 раза. Продолжительность основного острого опыта - 48 ч.
2.2.3.2. Проведение эксперимента.
В экспериментальные стеклянные стаканы емкостью 50 см3 или пробирки наливают по 20 см3 испытуемых растворов и сажают по 4 рачка в возрасте 6  2 часа. При постановке острых опытов используют на каждую концентрацию не менее 20 рачков, распределяя их не менее чем на 4 повторности.
2 часа. При постановке острых опытов используют на каждую концентрацию не менее 20 рачков, распределяя их не менее чем на 4 повторности.
Условия проведения опытов: температура 24 1,0°С, световой день 12 ч, разбавляющая контрольная вода должна отвечать всем требованиям, перечисленным выше. В ходе острых опытов рачков не кормят. Смену растворов проводят ежедневно.
1,0°С, световой день 12 ч, разбавляющая контрольная вода должна отвечать всем требованиям, перечисленным выше. В ходе острых опытов рачков не кормят. Смену растворов проводят ежедневно.
В остром опыте показателем токсичности среды является выживаемость цериодафний. Наблюдения за выживаемостью ведут в том же режиме, что и в опытах с дафниями и полученные данные записывают в таблицу (пункт 2.1.4 приложения N 2 к настоящим Методическим указаниям). По результатам острых опытов рассчитывают величины ЛК50 за 48 ч, определяют действующие концентрации вещества по наличию статистически значимого снижения величины выживаемости цериодафний в опыте по сравнению с контролем.
Полученные результаты считают приемлемыми, если удовлетворены следующие условия:
а) гибель контрольных цериодафний не превышает 10%;
б) ЛК50 бихромата калия за 24 ч для цериодафний в возрасте 24 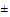 2 ч находится в интервале 0,9 - 3,3 мг/дм3;
2 ч находится в интервале 0,9 - 3,3 мг/дм3;
в) содержание растворенного О2 в исследуемых растворах, определенное в конце опыта, не ниже 5,0 мгО2/дм3.
2.2.3.3 Хронический опыт.
Хронические опыты на серии трех поколений с цериодафниями, так же как и с дафниями, служат для оценки действия малых концентраций токсиканта на выживаемость, плодовитость и качество потомства в поколениях.
Для хронических опытов подбирают 3-4 концентрации вещества, составляющие ряд концентраций, начиная от ? значения от ЛК50 за 48 ч с шагом 2,0-2,5.
2.2.3.4. Проведение эксперимента. В каждой серии эксперимента (контрольной или опытной) используют не менее 20 рачков, а опыты ставят не менее чем в четырех повторностях (приемлемы 4 повторности по 5 цериодафний или 5 повторности по 4 особи). В опытные стаканы заливают растворы, исходя из соотношения 10 см3 на 1 рачка. Возраст рачков 6  2 часа. Рачков ежедневно кормят зелеными водорослями в концентрации 250-500 тыс.кл/см3. Смену растворов проводят через сутки до начала размножения рачков и ежедневно в последующем. При смене растворов сохраняют соотношение 10 см3 на 1 исходную цериодафнию, если рачки погибают, количество раствора пропорционально уменьшают.
2 часа. Рачков ежедневно кормят зелеными водорослями в концентрации 250-500 тыс.кл/см3. Смену растворов проводят через сутки до начала размножения рачков и ежедневно в последующем. При смене растворов сохраняют соотношение 10 см3 на 1 исходную цериодафнию, если рачки погибают, количество раствора пропорционально уменьшают.
Продолжительность опытов с каждым поколением цериодафний составляет 10 суток, а общая продолжительность опытов на трех генерациях - до 30 суток
Схема постановки опытов на поколениях цериодафний аналогична постановке опытов с дафниями.
В хроническом опыте ведут учет выживаемости и размножения цериодафний. При наблюдении за размножением учитывают время наступления половозрелости и первого помета, количество молоди в пометах и количество патологических отклонений.
Наблюдения в опытах ведут ежедневно, регистрируемые результаты заносят в таблицу по форме 1 (пункт 2.1.4 приложения N 2 к настоящим Методическим указаниям).
По окончании опытов с каждым поколением цериодафний подсчитывают среднее значение по суткам выживаемости, плодовитости в пересчете на одну самку. Результаты опытов сравнивают с контролем, статистическая значимость отклонений определяется в соответствии с приложением N 4 настоящих Методических указаний.
Полученные результаты считают приемлемыми, если соблюдены следующие условия:
а) гибель в контроле на конец опыта не превышает 10%;
б) количество молоди на 1 самку за 10 суток в контроле не менее 20 штук;
в) время наступления половозрелости у цериодафний в контроле не превышает 5 суток;
г) ЛК50 бихромата калия за 24 ч для цериодафний находятся в интервале 0,9-3,3 мг/л.
3. Установление максимальной допустимой концентрации вещества для бентосных организмов
3.1. Прудовик обыкновенный
3.1.1 Характеристика тест-организма
Брюхоногие моллюски играют важную роль в круговороте органического вещества в водных экосистемах. Прудовик обыкновенный (большой, болотный) Limnaea stagnalis (Gastropoda, Pulmonata, Lymnaeidae) является типичным представителем эпибентоса умеренных широт. Широко распространен в прибрежной зоне стоячих или медленно текущих водных объектов, предпочитает постоянные водоемы с pH 6,0-7,0. В естественных условиях питается бактериями, водорослями, детритом, высшими растениями, погибшими животными.
Для проведения экспериментов взрослых особей прудовика обыкновенного отлавливают в летние месяцы на мелководьях водных объектов в зарослях высшей водной растительности. В природе прудовики часто служат промежуточными хозяевами различных сосальщиков (например, Fasciola hepatica), личиночными стадиями которых бывают поражены внутренние органы (в основном печень) иногда 40% моллюсков в водоемах. Поскольку заражение сосальщиками сказывается на плодовитости, собранных в природе животных необходимо, прежде всего, проверить на зараженность.
Для этого собранных моллюсков рассаживают поодиночке в стеклянные стаканы со 150-200 мл чистой отстоянной воды, животных не кормят. В случае заражения через 1 - 3 дня появляются церкарии паразитов в виде мелких подвижных точек. Таких моллюсков бракуют. Здоровых особей помещают в емкости согласно рекомендациям по культивации, в которых проводят адаптацию к условиям лабораторного содержания в течение двух недель. В дальнейшем, отобранные здоровые моллюски могут использоваться в исследованиях и для культивации в лаборатории.
3.1.2 Необходимое оборудование
Для содержания моллюсков и для проведения исследований необходимо следующее оборудование:
микроскоп биологический, обеспечивающий увеличение в 100-200 раз;
бинокулярная лупа;
весы аналитические с разновесами;
весы технические;
термостат на 150°С;
стаканы химические на 100, 500, 5000 мл;
колбы мерные на 0,2 - 1 л;
цилиндры мерные на 50 - 1000 мл;
пипетки химические на 1 - 10 мл;
чашки Петри;
респирометры (банки по 0,5 л со стеклянными крышками);
склянки с притертыми пробками на 0,5 - 1 л для растворов;
сифоны с зажимами Мора;
пикнометры;
тигли;
ножницы, пинцеты, часовые стекла;
реактивы для определения кислорода методом Винклера или оксиметр.
3.1.3.Культивирование
Для содержания в лаборатории желательно использовать проточные аквариумы с постоянной аэрацией. Каждой особи должно быть представлено не менее 0,5 литра воды. Использование водной растительности не обязательно, но желательно, поскольку растительность часто используется моллюсками как дополнительный источник питания. Диапазон температур для культивирования моллюска достаточно широк и составляет от 16 до 26°С, оптимальным температурным режимом является 17-22°С. При обильном кормлении прудовики становятся половозрелыми через 1,5 месяца после вылупления из кладки. При использовании проточного аквариума и постоянной аэрации достаточно проводить замену части воды раз в две недели.
Кормить моллюсков можно морковью, ботвой редиса, огурцами, капустой, листьями салата, различной водной растительностью. Корм моллюскам дают в изобилии, что положительно сказывается на их росте и продуктивности.
3.1.4 Проведение испытаний
Для исследований отбирают одновозрастных моллюсков (схожего размера, веса и цвета раковины), активно передвигающихся и потребляющих корм.
Острый опыт предназначен для определения диапазона концентраций хронического опыта. Проводится при 4-6 концентрациях в трех повторностях каждая. Концентрации различаются между собой на порядок. Продолжительность исследования - 3-5 суток. Моллюсков в опыте не кормят. В каждую емкость на 5 дм3 раствора помещают 3-5 моллюсков. Учитывают влияние исследуемого вещества на выживаемость и поведение моллюсков.
Для хронического опыта используются молодые половозрелые (возрастом от 1,5-2 месяцев) особи схожего размера, веса и цвета раковины и/или свежие кладки моллюсков.
При использовании половозрелых особей хронический опыт продолжается 30-60 суток. Исходной концентрацией для длительных исследований служит наибольшая безвредная концентрация, определенная в остром опыте. Число повторностей и плотность посадки такие же, как и в остром опыте. В течение опыта моллюсков подкармливают. Для оценки влияния вещества на процессы размножения в емкости объемом от 5 дм3 помещают по 3-5 взрослых прудовика. Ежедневно учитывают появление кладок, начало выклева и время появления молоди, которая содержится в аквариуме. Через 60 суток всю молодь изымают из аквариумов и промеряют под микроскопом с помощью окуляр - микрометра по высоте и ширине раковины. Мелкие особи держатся у уреза воды, быстро обсыхают и могут быть утеряны при подсчете численности. Необходимо регистрировать и погибших моллюсков, учитывая пустые раковины.
Для оценки влияния вещества на эмбриогенез свежие кладки помещаются в чашки Петри с заранее приготовленными концентрациями в повторностях по аналогии с острым опытом. Опыт можно проводить как с кладками, так и с яйцевыми капсулами отдельно. При этом необходимо учитывать, что кладки имеют слизистые коконы, которые обладают защитными свойствами и могут препятствовать проникновению вещества в эмбрион. При проведении опыта в каждую чашку Петри помещают минимум по 10 яйцевых капсул в составе кладок или без слизевой оболочки. На протяжении опыта ежедневно регистрируют выживаемость эмбрионов, ход эмбриогенеза, выклев особей.
3.1.5 Учет и анализ результатов
Ежечасно в первые 8 ч, а в последующие 3-е суток 2-3 раза в день, учитывают состояние моллюсков в опытных и контрольных сосудах. Регистрируют количество живых особей и их поведение (степень и характер передвижения, выдвижение ноги и ее реакцию на раздражение), интенсивность потребления корма, выделение слизи, определяемое по помутнению опытного раствора. В дальнейшем учет проводят один раз в сутки.
Особи, которые не реагируют на механическое раздражение и тело которых легко высвобождается из раковины, считаются погибшими.
Размножение и плодовитость оценивают по времени появления первых кладок, их числу и количеству яиц в каждой кладке. Потенциальную плодовитость определяют по числу яиц в кладках, полученных от каждого моллюска за период опыта, а реальную - по количеству выклюнувшейся молоди в абсолютных величинах и процентах к исходному числу яиц в кладках. Особенности роста оценивают, определяя высоту и ширину раковины, отношение высоты к ширине. Водно-солевой обмен моллюсков оценивают, определяя сырую массу тела и раковины, массу полостной жидкости и воды в теле, сухой остаток и количество золы в мягких тканях.
По разнице сухого остатка и сырой массы тела судят об изменении степени обводненности.
При оценке влияния вещества на процесс эмбриогенеза учитывается выживаемость эмбрионов, время начала и конца прохождения наиболее значимых стадий эмбриогенеза, состояние эмбрионов, доля и время выклева.
Высоту и ширину раковины измеряют штангенциркулем. За ее высоту принимают расстояние от вершины раковины до наиболее выступающего края устья, а за ширину - диаметр раковины в наиболее широкой части.
Для определения общей массы прудовика обыкновенного его обсушивают фильтровальной бумагой и, не надавливая на ногу (для сохранения в раковине полостной жидкости), переносят на аналитические весы и взвешивают. При определении массы тела и раковины ножницами разрезают раковину по швам витков, освобождают тело, обсушивают на фильтровальной бумаге и взвешивают на аналитических весах. Тела особей каждой размерной группы фиксируют в бюксах в 96% этаноле. Осколки раковины взвешивают. Вычитая из общей массы массу тела и раковины, определяют количество полостной жидкости.
Для определения сухого остатка тела вес зафиксированных в спирте моллюсков доводят до постоянной величины при температуре 100-105°С. Количество сухого остатка рассчитывают на единицу сырой массы. По разности сырой и сухой массы определяют количество воды в теле прудовика и судят о степени обводненности или обезвоживания тела под воздействием химического вещества.
Для определения суточного рациона моллюсков находят разность между начальным количеством корма и его остатком. Задаваемую порцию корма взвешивают, а остаток изымают, обсушивают и вновь взвешивают. Для каждой размерной группы вычисляют кормовой коэффициент по формуле:
К = Р/Р,
где, Р - масса съеденного корма (г),
Р - прирост массы моллюска (г).
Этот показатель позволяет судить об эффективности потребленного корма моллюсками при токсическом воздействии в опыте по сравнению с контролем.
Изучение энергетического обмена у прудовиков заключается в определении интенсивности потребления кислорода с применением метода Винклера (или с использованием чувствительного оксиметра).
Для этого в респирометры (банки на 0,5 дм3 с плотными крышками) заливают воду, помещают прудовиков, у которых предварительно определены масса и объем тела (по 3 особи), и закрывают крышками так, чтобы в банках не оставалось воздушных пузырьков. Банки с водой, но без моллюсков являются контрольными. Банки при стабильной температуре выдерживают 2 ч, после чего из них отбирают пробы воды в калиброванные пикнометры, в которых измеряют количество растворенного кислорода. Количество кислорода, потребленное прудовиками (в мг кислорода на 1 дм3 за 1 ч), определяют по формуле:
М мг/дм·ч = (m·m)·(V - V)/ Р·t,
где m0- содержание кислорода, растворенного в воде респирометра без прудовиков, мгО2 на 1 см3;
m1- содержание кислорода в воде респирометра с прудовиками;
V1 - объем респирометра в см3;
V2 - общий объем тел моллюсков в мл;
Р - общая масса тел прудовиков в мг;
t - продолжительность экспозиции в часах.
При наличии оксиметра контроль содержания кислорода в воде можно производить непосредственно в респирометрах, не отбирая проб.
По окончании экспериментов с прудовиком и обобщении полученных данных допустимыми следует считать такие концентрации вещества, которые:
а) не вызывают статистически значимого отклонения выживаемости взрослых моллюсков и молоди от выживаемости в контроле в срок до 60 суток;
б) не вызывают статистически значимого угнетения размножения моллюсков за срок наблюдения;
в) не снижают интенсивность потребления кислорода более чем на 15% по сравнению с контролем;
г) не вызывают статистически значимого снижения выживаемости эмбрионов и доли выклева по сравнению с контролем.
4. Установление максимальной допустимой концентрации вещества для рыб
Рыбы (наряду с водными млекопитающими) находятся в области конечного звена трофической цепи водных экосистем.
Определение ПДК веществ для рыб важно с двух точек зрения - установления опасности вещества для существования популяции рыб в водном объекте и угрозы здоровью человека при употреблении их в пищу. Эти особенности учитываются при установлении параметров и критериев токсичности патологических изменений и отдаленных последствий действия исследуемых веществ для рыб.
Исследования токсичности необходимо проводить на аквариумных видах тест-организмов, взятых из стабильной маточной культуры рыб с известными показателями чувствительности к стандартным токсикантам.
4.1. Рыбы на ранних стадиях развития
4.1.1. Вводные замечания
Известно, что чувствительность тест-организма к токсическому воздействию во многом зависит от стадии онтогенеза. Рыбы в период эмбриогенеза - этапа раннего индивидуального развития организма более чувствительны к токсическому воздействию по сравнению со взрослыми особями, поэтому необходимо оценить эффект воздействия исследуемого вещества на эмбриональное развитие рыб, выклев свободных эмбрионов (предличинок) и выживаемость предличинок после выклева.
В настоящих Методических указаниях описан порядок работы с аквариумной рыбкой данио рерио (Brachydanio rerio (Hamilton-Buchanan, 1822), совр. Danio rerio), в качестве тест-организма для определения ПДК вещества по эмбриональному развитию, поскольку материал для исследования можно получать в течение всего года, независимо от периодичности работы рыбоводных заводов. При необходимости, наряду с этим могут быть использованы и другие виды тест-организмов, с обязательным обоснованием выбора.
Для работы с рыбами необходимо иметь следующее оборудование и материалы:
емкости из химически инертного материала для содержания рыб и проведения исследований соответствующей вместимости с учетом рекомендуемой нагрузки;
стеллажи для размещения аквариумов;
биологический инверсионный микроскоп и/или бинокуляр с достаточным увеличением (не менее 80);
испытательные камеры, например, чашки Петри или стандартные 24-луночные планшеты с глубиной примерно 20 мм;
термостат/климатостат или помещение с кондиционируемым воздухом с регулируемой температурой для поддержания температуры на необходимом уровне;
магнитная мешалка;
холодильник;
весы аналитические;
рН-метр;
оксиметр;
оборудование для определения жесткости воды;
термометры;
сачки;
фильтры;
фотоаппаратура;
аквариумные компрессоры;
аквариумные водонагреватели с датчиками;
резиновые шланги разного диаметра и длины, резиновые груши;
лабораторные халаты, перчатки, респиратор;
маркер/карандаш по стеклу;
"нерестовая ловушка" - сетка из инертного материала с размером
отверстий 2,5_0,5 мм;
пипетки с широкими отверстиями для сбора икринок;
стеклянные сосуды и посуда для приготовления различных испытуемых концентраций и воды для разведения (стаканы, мерные колбы, мерные цилиндры и мерные пипетки и другое);
если для проведения испытания используют альтернативные системы воздействия, такие как проточные или с пассивным дозированием, то требуются соответствующие условия и оборудование;
рабочие журналы, компьютер и прочие материалы и инструменты.
4.1.2. Характеристика тест-организма
Данио рерио (Danio rerio) - широко распространенный аквариумный вид пресноводных лучеперых рыб семейства карповых (лат. Cyprinidae). В природе обитает в верхних слоях медленно текущих водоемов Юго-Восточной Азии, Индии, Бангладеш. Длина взрослых особей в среднем около 5-6 сантиметров. Тело удлиненное, веретеновидное, у природной формы основной тон серебристый с ярко-синими горизонтальными полосами. В настоящее время известно множество выведенных декоративных форм, однако, для исследований необходимо использовать "дикую форму", предпочтительно без вуалевости плавников. Самца от самки у данио рерио можно отличить по вытянутому, прогонистому и изящному телу. Самки крупнее, живот у них более округлой формы, особенно заметный перед нерестом.
4.1.3. Условия лабораторного содержания
Для содержания рыб-производителей ("маточной культуры") используют аквариумы предпочтительно удлинненной формы с покровными стеклами, обеспечивающие плотность посадки 1 литр на одну взрослую особь (не менее 1 г/литр), заполненные отстоянной водопроводной или биологизированной (см. п.2.1.3 настоящего приложения, рис 1.) водой. Освещение рекомендуется по 10-12 часов в день люминесцентными лампами. Допускается освещение солнечными лучами несколько часов в день. Аэрация должна быть постоянной, фильтрация - за счет внутреннего либо внешнего фильтра со слабым потоком воды. Допустимая температура воды: 23 2,0оС. Повышение температуры служит стимуляцией к нересту, а также способствует быстрому развитию икринок и мальков. Для кормления может быть использован сухой корм, но при подготовке к нересту необходимы живые корма (дафния, циклоп, мотыль, трубочник).
2,0оС. Повышение температуры служит стимуляцией к нересту, а также способствует быстрому развитию икринок и мальков. Для кормления может быть использован сухой корм, но при подготовке к нересту необходимы живые корма (дафния, циклоп, мотыль, трубочник).
Для хорошего самочувствия рыбок желательно каждую неделю подменивать до 25 % воды на свежую и следить за ее жесткостью и кислотностью. Оптимальными считаются жесткость 15dH (50-250 мг CaCO3/л - общая жесткость) и активная реакция среды 6,5-8,5 pH.
Для получения икры самок и самцов отделяют друг от друга и усиленно кормят. Плотность посадки рыб в этот период не отличается от обычного содержания. В конце второй недели самцы приобретают густой золотистый блеск, а брюшко самок значительно увеличивается в объеме за счет икры. Наиболее подготовленных к нересту рыб по 2-3 самца на каждую самку отлавливают и помещают в нерестовый аквариум, кормят всех рыб, а затем выключают свет. Стимулом к нересту служит утреннее включение света.
Нерестовый аквариум наполняют свежей отстоянной водой с температурой около 26°С, рН 6,5-7,0 и периодом освещенности 12-14 часов. В аквариум помещают "нерестовую ловушку" - сетку из инертного материала с ячеями 2,5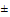 0,5 мм, которая служит для предохранения от поедания икры и личинок рыб взрослыми особями. Отложенная оплодотворенная икра опускается на дно, проходит сквозь сетку и становится недоступной для рыб. При размещении сетки следят, чтобы над сеткой осталось достаточно воды для комфортного плавания производителей. После нереста родителей отсаживают, а икру тщательно осматривают и используют в исследованиях.
0,5 мм, которая служит для предохранения от поедания икры и личинок рыб взрослыми особями. Отложенная оплодотворенная икра опускается на дно, проходит сквозь сетку и становится недоступной для рыб. При размещении сетки следят, чтобы над сеткой осталось достаточно воды для комфортного плавания производителей. После нереста родителей отсаживают, а икру тщательно осматривают и используют в исследованиях.
Обычно выклев у данио завершается через 48 ч после нереста, а еще через 48 ч предличинки начинают переходить на активное питание и становятся личинками. Переход предличинок на активное питание завершает данный этап исследований.
4.1.4. Проведение испытаний
До начала испытаний должна быть определена концентрация референтного токсиканта (бихромата калия), вызывающая гибель 50% взрослых рыб из собственной культуры испытателя за 48 часов. Первоначально (в первые 6 месяцев) такие определения проводятся ежемесячно для того, чтобы установить пределы колебаний устойчивости культуры к токсическому воздействию. В дальнейшем состояние культуры периодически оценивают (не реже 2 раз в год) по эффекту референтного токсиканта. Опыты с новым веществом проводят только в том случае, если токсикорезистентность культуры не выходит за установленные пределы. Если отклонение от среднего значения свидетельствует о существенном изменении состояния культуры, то возобновлять испытания следует только после ее стабилизации.
Для определения ПДК вещества на эмбрионах и личинках рыб ведут наблюдение за эмбриональным развитием данио рерио (Danio rerio) и выклевом предличинок в контроле и исследуемых концентрациях веществ.
Полученные после нереста оплодотворенные икринки по 10 штук помещают в чашки Петри с отстоянной водой без добавления токсиканта (контроль) и в приготовленные концентрации исследуемых растворов. Для повышения достоверности результатов икру берут от разных родительских групп, смешивают и произвольно отбирают в опыт. Концентрации исследуемого вещества готовят в трехкратной повторности, ориентируясь на полученные ранее данные для рыб и на максимально допустимые концентрации для других организмов.
Выклюнувшихся предличинок для продолжения исследования помещают по 10 штук в контрольную и тестируемую воду для дальнейших наблюдений. Опыт проводится, как и в первом случае, в чашках Петри, которые должны находиться в термостатируемых условиях. Длительность эксперимента определяется переходом личинок на активное питание.
4.1.5. Учет и анализ результатов
Основными показателями токсичности вещества являются выживаемость эмбрионов и личинок, морфометрические параметры, тератологический анализ. В качестве дополнительных показателей эмбриотоксикологической оценки влияния исследуемых веществ могут служить биохимические исследования (например, липидный и белковый обмен у эмбрионов и предличинок рыб).
В опытах через каждые 5-10 часов оценивают состояние тест-организма и ход выклева. Учитывается оплодотворение икры, а также гибель и морфологические изменения у эмбрионов в процентах по отношению к контролю. Гибель эмбрионов бывает наибольшей в начале и в конце эмбрионального периода.
Выклев - наиболее чувствительный и важный этап, завершающий эмбриональное развитие у рыб. Эмбрионы, достигшие стадии выклева, в результате действия токсичного агента часто оказываются неспособными выйти из оболочек и погибают. Важным показателем токсического эффекта является распределение выклева на весь период эмбрионального развития. Если под влиянием токсиканта нарушается эмбриональное развитие, то максимум выклева смещается по сравнению с контролем или растягивается во времени.
Морфометрические исследования лучше всего проводить на выклюнувшихся предличинках. У эмбрионов вредные воздействия веществ могут вызывать морфологические изменения, которые служат в качестве интегрального показателя эффекта действия вещества. Появление уродств свидетельствует о тератогенном действии. Уродливые эмбрионы, погибшие во время эмбрионального развития, включаются в число погибшей икры, а средний процент уродств подсчитывается после выклева и прохождения стадий предличинки.
Личинки, которые способны нормально плавать и переходят на активное питание, считаются выжившими. Нормальными считаются особи, не имеющие морфологических отклонений и не отличающиеся размерами от контрольных.
В качестве максимальной допустимой концентрации вещества для ранних стадий онтогенеза рыб принимается максимальная концентрация, не вызывающая статистически значимого повышения смертности эмбрионов и личинок, увеличения числа особей с дефектами развития или отставания личинок в размерах и темпах развития.
Полученные результаты считают приемлемыми, если соблюдены следующие условия:
общий уровень оплодотворения всех полученных яиц должен составлять не менее 70 %;
температура воды в испытательных камерах должна оставаться стабильной на протяжении всего периода испытании;
общая выживаемость эмбрионов в контроле должна составлять около 90 %, а вылупления 80% за 96 часов;
по окончании 96-часового воздействия концентрации растворенного кислорода в контроле и самой высокой исследуемой концентрации должны составлять около 80 % от насыщения.
4.2. Мальки и взрослые рыбы
4.2.1. Характеристика тест-организма
Необходимо использовать один или несколько видов рыб на усмотрение лаборатории, в которой проводится испытание, отдавая предпочтение видам, рекомендованным для определения острой токсичности. Выбранные виды рыб должны соответствовать важным практическим критериям, как, например, их доступность в течение года, неприхотливость в содержании, удобство проведения испытания и всем относящимся к тесту экономическим, биологическим или экологическим факторам. Особи рыб должны быть здоровы и без патологий.
Рыбы, рекомендованные в данном Методическом руководстве, просты в разведении и повсеместно доступны в течение года. Они могут быть выведены и выращены в рыбоводческих хозяйствах или в лаборатории, при условиях, исключающих распространение заболеваний, в том числе паразитарных, и иметь известное происхождение. Выбор других рыб в качестве тест-организмов должен быть обоснован литературными и экспериментальными данными.
4.2.2. Условия лабораторного содержания
При исследованиях на аквариумных видах подбирают некрупных одноразмерных особей в хорошем физиологическом состоянии, взятых из маточной культуры аккредитованной лаборатории. Рыб перевозят на специально оборудованном термостатируемом транспорте с регулируемой подачей кислорода. При длительных перемещениях необходим постоянный контроль за кислородным режимом и температурой воды, так как при резких перепадах гидрохимических показателей возможна значительная гибель перевозимой рыбы. При кратковременных перевозках можно использовать полиэтиленовые мешки, не допуская травмирования рыбы и резкого снижения содержания кислорода в воде.
В условиях аквариальной лаборатории привезенную рыбу рассаживают в специально оборудованные емкости (проточные лотки, аквариумы, ванны или бассейны) для акклимации (адаптации к лабораторным условиям). Продолжительность минимального необходимого периода адаптации 12-15 суток. Пригодность партии рыб оценивают исходя из критериев состояния культуры. Если за первые 48 часов адаптации смертность рыб составила более 10%, то необходима замена животных, от 5 до 10% - адаптацию продолжают дополнительные 7 дней, при смертности менее 5% популяции партию принимают в работу. При содержании рыб необходимо поддерживать оптимальные условия и показатели, необходимые для данного вида рыб, температурный режим, содержание кислорода, а также отслеживать любые изменения в поведении рыб. Для обогащения воды кислородом рекомендуется применять принудительную аэрацию, а для повышения до необходимого уровня температуры - аквариумные водонагреватели с датчиками.
Для кормления рыб используют пастообразные, сухие гранулированные и хлопьевидные или живые корма из расчета от 0,8 до 5% к весу тела рыб или количество, которое рыбы съедают за 2-3 минуты. Емкости, используемые для содержания рыб, необходимо регулярно очищать от скапливающихся остатков корма и фекальных масс, при необходимости с частичной заменой воды (до 25% в неделю).
4.2.3. Проведение испытаний
Перед началом экспериментов ранее адаптированных рыб помещают в аквариумы или другие экспериментальные емкости в соотношении 1 грамм ихтиомассы на 1 л воды. Хронические опыты начинают с концентрации, равной 1/2 ЛК50 за 96 ч, и создают ряд из 3-5 (при необходимости и более) убывающих концентраций вещества с шагом 2,0-2,5. Все исследуемые концентрации готовят в трехкратной повторности, используя не менее 5-7 особей рыб для каждой, или в двукратной повторности с использованием 6-10 особей в каждой повторности концентрации вещества. Два аквариума служат контролем. Длительность хронических опытов составляет до 1 месяца (при необходимости до 3 месяцев), в зависимости от стабильности исследуемого вещества в воде. Кормление рыб в хроническом исследовании проводят 1 раз в сутки, в количестве корма, которое съедается ими полностью за 2-3 минуты.
Взвешивание рыб производят перед началом опытов, затем через каждые 10-15 суток до их окончания. Для этого на весы ставят сосуд (например, химический стакан) в который наливают достаточное для посадки рыб количество воды и уравновешивают его. Отловленных сачком рыб быстро помещают в подготовленный сосуд на весах, предварительно осушив низ сачка от избытка влаги, и фиксируют показания. В ходе опыта ежедневно измеряют температуру воды, регулярно (как минимум один раз в 10 суток) проводят гидрохимические исследования содержания растворенного в воде кислорода и рН.
В зависимости от стабильности исследуемого вещества смену воды в опытных емкостях проводят один раз в 3-суток, спустя 1,5-2 ч после кормления рыб. При этом недопустимо травмирование рыб. Аэрация воды возможна лишь в тех случаях, когда состав и концентрация исследуемого вещества не изменяются.
Схема и динамика проведения опытов, учет регистрируемых показателей фиксируется в лабораторном рабочем журнале.
4.2.4. Учет и анализ результатов
4.2.4.1. Выживаемость рыб определяется путем систематического учета живых и погибших рыб на протяжении всего опыта (в острых опытах через 24, 48 и 96 ч, в хронических - через 5, 10 и далее через каждые 10 суток опыта). Полученные данные обобщают и выражают в абсолютных и процентных величинах. Устанавливают границы выживания рыб в зависимости от концентрации вещества и времени его воздействия на организм. Находят недействующую концентрацию вещества, которая не вызывает гибели рыб (Приложение 4 к настоящим Методическим указаниям).
4.2.4.2. Прирост или снижение ихтиомассы устанавливают на основе данных периодического взвешивания рыб в хроническом опыте (каждые 10-15 суток). Этот показатель выражают в процентах от начальной массы индивидуально или в целом на концентрацию.
4.2.4.3. Клиническую картину (симптомы отравления) оценивают по изменению поведения рыб в водной среде и реакции на внешние раздражители путем периодического осмотра их в опыте. Изменение поведения и местонахождения рыб в воде может свидетельствовать о поражении многих систем организма.
С повышением токсичности вещества чаще наблюдается тенденция к подъему рыб в поверхностные слои при наличии возбуждения или общего угнетения, потеря координации движений, расстройств дыхания и других патологических признаков. Незадолго до гибели большая часть рыб опускается на дно.
При отравлениях реакции рыб на внешние раздражители могут усиливаться, ослабевать или полностью исчезать. В качестве раздражителей при проведении токсикологических исследований можно использовать стук по стенкам аквариума, включение и выключение света, всплеск воды в аквариуме, прикосновение сачком или стеклянной палочкой к телу рыб, искусственно создаваемый ток жидкости путем слива или слабого вращения воды при помощи лопаточки и другие приспособления.
Несмотря на некоторые различия в развитии процесса отравления рыб ядами, как правило, наблюдают следующие стадии интоксикации - начало беспокойства (учащение дыхательного ритма, беспокойное дыхание, "отставление" плавников), первые признаки расстройства чувствительности (судорожное дыхание, поднятие лучей плавников, неполное закрытие рта), усиление раздражимости (стремительное плавание или неподвижность, сильная реакция на внешние раздражители или полное ее отсутствие), первое расстройство координации движений (кратковременное опрокидывание на бок или на спину, кружение вокруг продольной оси тела, толчкообразные движения), полная потеря равновесия (стабильное изменение положения тела, плавание на боку, вверх брюшком по кругу и штопорообразно, дрожание мышц и плавников, судороги тела), агония (опускание на дно аквариума, удушье, паралич). Все эти признаки регистрируют через 24, 48 и 96 ч в острых опытах и через 5, 10 и далее через каждые 10-15 суток в хронических опытах. Выявляют концентрацию вещества, при которой не проявляются внешние признаки интоксикации.
4.2.4.4. Характер питания зависит от вида рыб и от особенности поедания корма. Хищные рыбы активно набрасываются на корм, стараясь поймать его на лету у поверхности воды. Мирные рыбы корм берут спокойно, заглатывая его в толще воды или собирая на дне аквариума. При отравлениях реакции рыб на корм угнетаются или полностью подавляются. При явных признаках интоксикации рыбы полностью отказываются от корма. В конце экспериментов устанавливается концентрация раствора, при которой не происходит нарушения рефлекса питания.
4.2.4.5. Характер и частота дыхания. Наблюдения ведутся через 24, 48 и 96 ч в острых опытах и через 5, 10 и далее через каждые 10-15 суток в хронических опытах путем оценки силы, частоты и ритма дыхательных движений жаберных крышек с помощью секундомера по отношению к контролю в течение 1-10 минут. Нормальное дыхание у рыб характеризуется спокойными, ритмичными, умеренной силы (амплитуда) и частоты колебательными движениями жаберных крышек. Норма устанавливается в каждом конкретном случае на здоровых рыбах. При отравлениях можно наблюдать различные расстройства дыхания, в том числе резкое учащение колебательных движений жаберных крышек, беспорядочное дрожание жабр с последующей остановкой дыхания, периодическое прекращение и возобновление учащенных или замедленных дыхательных движений с увеличенной или уменьшенной амплитудой колебательных движений жаберных крышек.
4.2.4.6. Внешний вид (состояние кожных покровов, плавников, органов зрения). Хорошее состояние рыб характеризуется энергичностью, округлостью спины, упругостью мышц, полным упругим животом с наличием полостного жира во внутренних органах при нормальном состоянии печени. Истощенные рыбы характеризуются как вялые, пассивные, с опавшей и заостренной спиной, запавшими глазами, подтянутым животом, мягкой мускулатурой, истонченной брюшной стенкой и отсутствием полостного жира на внутренних органах.
На коже часто обнаруживают изменения слизистого покрова, покраснения (гиперемия), кровоизлияния, новообразования (опухоли), рубцы, эрозии, язвы, ерошение и выпадение чешуи, появление налетов и выделение слизи. Аналогичные изменения возникают на плавниках, которые иногда деформируются и разрушаются вплоть до оголения лучей. Мускулатура рыб при отравлениях может стать дряблой, водянистой, тургор ослабляется, при надавливании пальцем обнаруживается медленно выправляющаяся вмятина. Нередко наблюдаются парезы, параличи, уплотнение или расслабление отдельных групп мышц головы, туловища и хвостового стебля с соответствующими искривлениями тела. Глаза больных рыб застланы пеленой, тусклые, помутневшие, с бледным рисунком. Иногда обнаруживаются пучеглазие, кровенаполнение сосудов, кровоизлияние в переднюю, заднюю камеры и ткани глаз.
4.2.4.7. Состояние жаберного аппарата. Осмотр производится при жизни и после гибели рыб под водой и в воздушной среде. Рыб отлавливают, заворачивают в марлевую салфетку, отводят жаберную крышку в сторону и осматривают жабры визуально или с помощью лупы. Осмотр жабр под водой производится путем погружения рыбы на глубину 3-5 см, при этом многие патологические изменения гораздо лучше заметны, чем при осмотре в воздушной среде. В норме жабры полнокровные, ярко-красного цвета, чистые, жаберные лепестки ровные, лежат параллельно, соприкасаясь друг с другом, свободный край их образует ровный полукруг относительно жаберной дужки. При отравлениях рыб жабры приобретают различные оттенки - темно-вишневый, красный, бледно-красный, бледный желтовато-розовый, темно-бурый, сероватый и др. Жаберные лепестки набухают и лежат беспорядочно.
4.2.4.8. Патологоанатомическое исследование анализ.
Проводят сравнительную визуальную оценку жабр, сердца, мышц, головного мозга, печени, почек, селезенки и кишечника у контрольных особей и подвергавшихся воздействию вещества.
4.2.4.9. Токсикологическая оценка исследованного вещества. При токсикологической оценке вещества в качестве обязательных используются наиболее общие показатели и признаки отравления рыб. По ним устанавливают максимальные допустимые концентрации испытуемого вещества, то есть концентрации, которые в хроническом опыте не вызывают статистически значимых отклонений исследуемых показателей от контроля. Максимальные допустимые концентрации, установленные по каждому обязательному показателю, вносят в сводную таблицу по форме 5.
Форма 5
Сводная таблица допустимых концентраций для рыб
| Организмы (вид, возраст) | Показатели и длительность опыта | Максимальные допустимые концентрации (мг/л) |
|---|---|---|
| Выживаемость | ||
| Прирост ихтиомассы | ||
| Клиническая картина | ||
| Характер питания | ||
| Влияние на органы дыхания (характер и частота дыхания) | ||
| Внешний вид | ||
| Состояние наружных покровов | ||
| Состояние жаберного аппарата |
В качестве максимальной допустимой концентрации вещества для взрослых рыб принимается наименьшая концентрация из допустимых, установленных по каждому обязательному показателю.
5. Оценка генотоксичности вещества
5.1. Вводные замечания
В данной методике предлагается проводить исследование генотоксичности вещества на генном и хромосомном уровне на эритроцитах рыб.
Проводится одновременный тест для выявления генотоксичности на генном и хромосомном уровне по изменению структуры ДНК в ядрах эритроцитов рыб и образованию микроядер.
5.2. Проведение испытаний
5.2.1. Оборудование и материалы для проведения теста по выявлению генотоксичности веществ на эритроцитах рыб для генного и хромосомного уровня.
Люминесцентный микроскоп биологический, обеспечивающий увеличение в 100-1000 раз;
Окулярная сеточка для подсчета ядер эритроцитов в поле зрения микроскопа;
мерная посуда для приготовления растворов;
предметные стекла;
пипетки для раскапывания красителя на предметное стекло
покровные стекла;
пинцет, ножницы;
вегетационные сосуды для рыб;
Реактивы:
0,1 % раствор акридинового оранжевого в дистиллированной воде;
Забуференный раствор Кребса-Рингера:
NaCl (130 mM), KC1 (5,2 mM), CaCl2 (1,9 mM), MgSO4 (1,29 mM), Na2HPO4 (10 mM). 1M HCl
5.2.2. Подготовка рыбы для двух тестов:
Двухмесячных мальков (Brachydanio rerio) длиной около 2 см помещают в стеклянные аквариумы по 10 штук в отстоянную водопроводную воду (контроль) и в исследуемые концентрации растворов веществ (диапазон из 4-х концентраций). Продолжительность экспериментов составляет 7 суток, в течение которых отбираются сохранившиеся мутации в ДНК и в эритроцитах в процессе эритропоэза в кроветворных органах рыб набираются микроядра. Через 7 суток готовят препараты живой крови рыб и проводят учет микроядер (МЯ) в эритроцитах с применением люминесцентной микроскопии.
5.2.3. Подготовка мазков крови
Для приготовления мазков кровь берут из хвостовой вены. Кровь берется путем отрезания хвостового стебля, что дает получить маленькую каплю крови при соприкосновении среза стебля с покровным стеклом. На каплю крови рыб помещается капля люминесцентного красителя (1 часть 0,1 % раствора акридинового оранжевого в дистиллированной воде на 9 частей забуференного раствора Кребса-Рингера). Краситель с каплей крови покрывается покровным стеклом, таким образом, получается препарат "давленая капля". Через 5 минут (время действия красителя) препарат считается готовым к исследованию. Метод позволяет также исследовать кровь мальков морских рыб, которые являются тест-организмами при установлении рыбохозяйственных ПДК в морской воде.
5.3. Оценка генотоксичности веществ по флуоресценции комплекса ДНК-акридиновый оранжевый в ядрах эритроцитов рыб (выявление генотоксичности на генном уровне по изменению структуры ДНК)
Метод позволяет учитывать изменение структуры ДНК в ядрах эритроцитов рыб под влиянием различных концентраций токсикантов. Приготовленный препарат крови рыб при использовании красителя акридиновый оранжевый в поле зрения люминесцентного микроскопа дает люминесценцию ядер эритроцитов в зависимости от изменения структуры ДНК под влиянием токсикантов. Двуцепочные ДНК (в эритроцитах, не подвергнутых действию мутагена) в комплексе с акридиновым оранжевым флуоресцируют зеленым цветом; при расхождении цепей одноцепочные ДНК дают оранжевое или золотистое свечение, зоны ядра с разрывами нитей ДНК производят гашение флуоресценции, и ядро дает либо слабую зеленоватую флуоресценцию, либо появляется ребристое гашение по всему ядру.
5.3.1. Учет и анализ результатов
В контроле на 3-х препаратах крови рыб "давленая капля" обсчитывается 2000 эритроцитов и рассчитывается соотношение эритроцитов с измененной флуоресценцией по отношению к эритроцитам с зеленой флуоресценцией. Результаты заносятся в таблицу 5.3.1. Измененное свечение ядер эритроцитов - оранжевый, золотистый цвет, гашение флуоресценции. Для каждой исследованной концентрации вещества также учитывается соотношение количества ядер эритроцитов с измененной флуоресценцией к ядрам с зеленым свечением (при сохраненной структуре ДНК). Статистически достоверная разница между контролем и опытом в соотношении количестве ядер с измененной флуоресценцией указывает на перестройку структуры ДНК под влиянием токсиканта.
По результатам подсчета соотношения ядер эритроцитов с измененной и зеленой флуоресценцией можно судить о степени мутагенной активности исследуемого вещества. Пример представления результатов представлен в виде таблицы 5.3.1.
Таблица 5.3.1
Соотношение ядер в эритроцитах Brachydanio rerio с измененной и зеленой флуоресценцией указывающей на наличие генных мутаций ДНК после 7 суточной экспозиции в токсиканте (средняя в 2000 клеток), %.
| Концентрация, мг/л | Контроль | 1 | 2 | 3 | 4 |
|---|---|---|---|---|---|
| Соотношение ядер с золотистым или красным свечением к ядрам с зеленым свечением | |||||
| Соотношение ядер с гашением флуоресценции с к ядрам с зеленым свечением |
5.4. Учет частоты образования микроядер (далее - МЯТ) в эритроцитах рыб (выявление генотоксичности веществ на хромосомном уровне по МЯТ)
Метод позволяет учитывать в цитоплазме эритроцитов рыб частоту образования микроядер, которые представляют собой фрагменты ядерного материал, которые элиминируются из ядра клетки при аберрациях митотических хромосом.
5.4.1. Учет и анализ результатов
В контроле на препарате крови рыб "давленая капля" для каждого варианта опыта обсчитывают не менее 2000 эритроцитов, в которых учитывают количество микроядер и аномалий в эритроцитах (полиморфизм, смещение ядер к периферии, пикноз, хроматолиз, деформация ядер и другие) в процентах.
5.4.2. Представление данных
Проводят статистическую обработку полученных данных в соответствии с Приложением 4 настоящих Методических указаний.
Изменения в сравнении с контролем по каждому исследованному показателю описывают по каждой исследованной концентрации вещества, и делается заключение о возможной генотоксичности и максимально недействующей концентрации исследуемого препарата.
Результаты подсчета микроядер в эритроцитах крови молоди данио и данные о состоянии ядер при действии различных концентраций препарата представляют в форме таблицы.
Таблица 5.4.2
Частота встречаемости микроядер в эритроцитах Brachydanio rerio и цитологические показатели ядер эритроцитов после пребывания рыб в исследуемых растворах препарата (средняя в 2000 клеток), %.
| Концентрация, мг/л | Контроль | 1 | 2 | 3 | 4 |
|---|---|---|---|---|---|
| Частота встречаемости микроядер | |||||
| Частота встречаемости аномальных ядер |
6. Требования к оценке временных нормативов ПДК вещества для пресноводных водных объектов
6.1. Испытания на водорослях
Целесообразно проведение 7-суточных исследований действия вещества на рост культуры водорослей (пункт 1.4 приложения N 2 к настоящим Методическим указаниям). В качестве альтернативы возможно полное проведение хронического эксперимента с одноклеточными водорослями в течение 14 суток.
Условия культивирования водорослей и постановки токсикологических исследований с ними приведены в подпункты 1.3 и 1.4 приложения N 2 к настоящим Методическим указаниям.
6.2. Испытания на зоопланктонных организмах
Исследования проводятся на односуточных дафниях около 20 суток, что определяется временем появления трех пометов у контрольных дафний, или на односуточных цериодафниях в течение 7-8 суток, когда у рачков появляется 3-й помет.
Постановка токсикологических исследований изложена в подпунктах 2.1.4 и 2.2.3 приложения N 2 к настоящим Методическим указаниям.
6.3 Испытания на рыбах на ранних стадиях развития
Условия содержания рыб, получения икринок и проведения исследований на них приведены в пункте 4 приложения N 2 к настоящим Методическим указаниям.
В качестве максимальной допустимой концентрации вещества для рыб принимается максимальная концентрация, не вызывающая статистически значимого повышения смертности эмбрионов и личинок.
6.4 Испытания изменений санитарных показателей водной среды
Исследуемое вещество оценивают по изменению показателя БПК5, характеризующего процессы самоочищения водной среды.
Исследования проводятся при 20°С в стеклянных сосудах объемом 5 дм3, заполняемых природной водой, профильтрованной через мельничный газ N 76 и насыщенной кислородом.
В сосуды вносится исследуемое вещество в 5-7 концентрациях, различающихся на порядок. Один из сосудов остается чистым и используется в качестве контроля. В исходные сутки, а также через 5 суток в пикнометры отбираются пробы воды (по 2 пикнометра на каждую пробу), которые выдерживаются в термостате при 20°С в течение 5 суток.
Через 5 суток после экспозиции в каждом из пикнометров в воде определяют содержание кислорода по Винклеру или с применением специально приспособленных оксиметров.
Расчет величины БПК5 производится следующим образом:
,
где: - исходная концентрация кислорода в воде,
- концентрация кислорода в пробах на 5 сутки наблюдения.
Результаты используются для составления таблицы или графиков зависимости БПК5 от времени и концентрации исследуемого вещества.
6.5. Определение величины временного норматива
Из концентраций, выведенных в процессе исследований в качестве максимальных допустимых для каждого из объектов исследования, выбирается наименьшая, которая и рассматривается в качестве временного норматива ПДК вещества.
Приложение 3
к Методическим указаниям по разработке нормативов
качества воды водных объектов рыбохозяйственного значения,
в том числе нормативов предельно допустимых
концентраций вредных веществ в водах водных объектов рыбохозяйственного значения
Требования к разработке максимальных допустимых концентраций вещества для морских биологических тест-организмов
1. Установление максимальной допустимой концентрации вещества для одноклеточных водорослей
1.1. Введение
Оценка влияния веществ на одноклеточные водоросли осуществляется по нижеследующим показателям:
а) изменение численности клеток водорослей при воздействии веществ, содержащихся в тестируемой воде, по сравнению с контролем;
б) характер изменения численности клеток: их увеличение или снижение, отражающее интенсивность деления клеток водорослей по отношению к контролю.
Критерием токсичности раствора вещества является статистически значимое снижение численности клеток водорослей ("выживаемость") в растворе по сравнению с контролем.
Критерием эвтрофирующего эффекта вещества является статистически значимое увеличение численности клеток водорослей в различных концентрациях вещества. Лимитирующий показатель вредности вещества в данном случае - экологический. Наряду с изучением динамики численности водорослей к регистрируемым показателям в опыте следует относить изменение рН; визуальные наблюдения за состоянием культуры водорослей: изменения в окраске, форме клеток и состоянии суспензии (взвешенное, опускание на дно, всплывание к поверхности, гомогенность или агрегация) по сравнению с контролем.
В качестве экспресс-метода оценки токсичности вещества можно использовать приборный метод быстрой или замедленной флуоресценции водорослей. Показания изменения флуоресценции водорослей в растворах вещества по отношению к контролю следует относить к основным показателям, характеризующим процессы жизнедеятельности одноклеточных водорослей. Показания быстрой и замедленной флуоресценции относятся только к живым клеткам, отражают интенсивность процесса фотосинтеза водорослей, по калибровочной кривой позволяют определить количество живых клеток в эксперименте.
Кратковременная оценка токсичности раствора вещества - до 24-96 ч - позволяет определить наличие острого токсического действия вещества на одноклеточные водоросли, а длительное исследование - до 14-21 суток - его хроническое токсическое действие.
К дополнительным показателям при исследовании следует относить: оценку биомассы водорослей (полученную расчетным методом), оценку скорости и темпа деления клеток (расчет генераций), содержание фотосинтезирующих пигментов (хлорофилла и каротиноидов), соотношение живых и мертвых клеток водорослей (используя люминесцентный микроскоп или различные витальные красители -цитохимический метод).
1.2. Характеристика тест-организмов
В качестве тест-организма рекомендуется использовать лабораторную монокультуру одноклеточных диатомовых водорослей Phaeodactylum tricornutum. Вид представлен клетками овально-треугольной формы с шипиками на концах. Клетки неподвижны, длина 13-16 мкм. Размножение вегетативное, путем простого деления клеток надвое. Численность клеток увеличивается за трое суток не менее чем в 3 раза. После пересева культуры на новую среду, экспоненциальная фаза роста наступает на 3 сутки. Данный вид водорослей используется в международном стандарте оценки качества воды.
1.3. Условия лабораторного содержания одноклеточных водорослей
Используется обычное лабораторное оборудование, приборы, посуда и реактивы, в том числе:
климатостат (люминостат) любого типа, оснащенный лампами дневного света 3000-6000 лк, обеспечивающий поддержание температуры (20  2)°С;
2)°С;
прибор для определения солености воды;
рН-метр;
оксиметр любого типа с погрешностью измерения не более 0,5 мг/дм3;
спиртовка;
микроскоп биологический, обеспечивающий увеличение в 100-200 раз;
камера счетная Горяева (или камера Нажотта);
предметные и покровные стекла;
фильтровальная установка любого типа;
фильтры мембранные (размер пор 3,5 мкм; 0,45 мкм);
пипетки автоматические - дозаторы на 0,1-0,2 см3;
готовая искусственная морская соль;
двухромовокислый калий К2Cr2O7 марки "хч" или стандарт-титр калия двухромовокислого;
стаканы стеклянные лабораторные вместимостью 100, 500, 1000 см3;
колбы конические на 100, 150, 250, 500, 1000 см3;
культура морских одноклеточных водорослей Phaeodactylum tricornutum Bohlin.
Выращивают водоросли (таблица 1.3.) на среде Гольдберга.
Таблица 1.3.
Состав питательной среды Гольдберга
| N исходного раствора | Реактив | Навеска реактива г/100см3 дистиллированной воды | Количество (см3) каждого исходного раствора на 1дм3 морской природной воды |
|---|---|---|---|
| 1 | KNO3 | 10,1 | 2 |
| 2 | NaH2PO4 | 1,421 | 0,5 |
| 3 | MnCl2 4H2O | 0,01979 | 1 |
| CoCl2 6H2O | 0,02379 | ||
| 4 | FeCl3 6H2O | 0,02703 | 1 |
Питательную среду для культивирования готовят на искусственной морской воде или на морской природной воде (черноморской, беломорской, балтийской, каспийской и т.д.), которую предварительно отбирают в незагрязненном районе. Морскую воду фильтруют через мембранный фильтр (размер пор 3,5 мкм). Дважды стерилизуют, нагревая до температуры 75-80°С и охлаждая до комнатной температуры. В подготовленную таким образом морскую воду добавляют растворы N 1, N 2 и N 3. Затем среду стерилизуют третий раз, охлаждают и добавляют раствор N 4.
Приготовленную вышеописанным способом среду хранят в темном месте при комнатной температуре. Исходные растворы для приготовления среды хранят в холодильнике, в случае помутнения производят их замену.
Культивируют водоросли в конических колбах объемом 250-500 мл, закрытых фольгой или ватно-марлевой пробкой, в люминостате или климатостате, избегая попадания прямых солнечных лучей. Освещенность 3000-6000 люкс. Лампы дневного света размещают на расстоянии 30-40 см от поверхности культуры. Соблюдается световой суточный ритм. Температура при культивировании водорослей 20 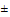 2°С. Культуру водорослей периодически перемешивают, встряхивая 1-2 раза в сутки.
2°С. Культуру водорослей периодически перемешивают, встряхивая 1-2 раза в сутки.
Водоросли рекомендуется один раз в десять дней пересевать. Для этого в чистую простерилизованную колбу объемом 250 см3 со свежей средой (100-150 мл) над пламенем спиртовки приливают примерно 15-20 см3 верхнего слоя из колбы ранее культивируемых водорослей. При этом получают начальную плотность клеток в колбе для культивирования, примерно 300 тыс.кл/см3. Колбу закрывают ватно-марлевыми пробками или фольгой, перемешивают, записывают на колбе название культуры, дату посева и ставят в люминостат.
В течение дня содержимое колбы следует перемешивать 1-2 раза.
1.4. Проведение исследований
Опыты проводят при оптимальной температуре и освещении, как и культивирование водорослей (пункт 1.3 приложения N 3). Используют водоросли в экспоненциальной фазе роста, что соответствует трехсуточной культуре водорослей после пересева. Плотность культуры в колбе в это время достигает примерно 5 млн.кл/мл.
В опыте используют начальную плотность клеток 20-25 тыс. кл/см3. Периодически (не реже 1 раза в месяц) необходимо проводить контроль физиологической чувствительности водорослей. Для этого используют эталонное химическое вещество - двухромовокислый калий К2Cr2O7 марки "хч" или стандарт-титр калия двухромокислого. Готовят маточный раствор двухромовокислого калия концентрацией 1 г/дм3. Далее методом разбавления готовят серию растворов с концентрациями 1,0; 2,5; 5,0; 7,5 и 10,0 мг/дм3. Исследование проводят в течение 96 ч. На основании полученных результатов рассчитывают среднюю концентрацию К2Cr2O7, вызывающую уменьшение численности клеток на 50% за 96 ч (ЛК50 за 96 ч). Если полученное значение ЛК50 находится в интервале 5,8-10,0 мг/дм3, то культура водорослей может быть использована для экспериментов.
Если полученные значения ЛК50 не попадают в интервал 5,8-10,0 мг/дм3, то эксперименты с водорослями не проводят, выясняют причину (условия культивирования, состав культуральной среды и прочее). Иногда культуру водорослей заменяют и проводят эксперименты заново.
При постановке острых и хронических экспериментов в контрольные и опытные колбы емкостью 250 см3 наливают по 100 см3 (в колбы емкостью 100 см3 наливают по 50 см3) контрольной среды и исследуемые концентрации вещества. Контролем служит среда Гольдберга. Исследуемые концентрации веществ также готовят на среде Гольдберга.
Затем в опытные и контрольные колбы пипеткой добавляют по 0,5 см3 (0,25 см3) культуры водорослей в экспоненциальной фазе роста.
Колбы закрывают ватно-марлевыми пробками или фольгой, их содержимое тщательно перемешивают и в каждой колбе определяют исходную численность клеток, которая должна составлять 25 тыс.кл/мл. Колбы помещают в люминостат (или в климатостат) и экспонируют в течение трех суток (острый) или четырнадцати суток (хронический) эксперимент.
В эксперименте должно быть исследовано не менее 5 концентраций вещества. Повторность трехкратная.
Эксперименты на водорослях проводятся в 2 этапа: предварительный и основной (окончательный).
В предварительном остром эксперименте находят интервал токсичных концентраций. Опыты проводят в широком диапазоне концентраций вещества, которые отличаются в геометрической прогрессии (коэффициент 10). Например, 0,01; 0,1; 1,0; 10,0 мг/л и т.д. Исследуют не менее пяти концентраций в двух повторностях. По результатам эксперимента определяется диапазон концентраций для основного острого и хронического эксперимента.
В основном остром и хроническом эксперименте шаг между концентрациями различается в 2-5 раз. Исследуют не менее пяти концентраций в трех повторностях.
Подсчет клеток водорослей проводят в остром опыте ежедневно, в хроническом - на 1, 2, 3, 4, 7, 10, 14 сутки.
На 14 сутки от начала эксперимента опыт прекращают и устанавливают, оказывают ли исследуемые концентрации вещества хроническое токсическое (или эвтрофирующее) действие на водоросли.
1.5. Учет и анализ результатов
Для подсчета численности клеток под микроскопом используют счетную камеру Нажотта объемом 0,01 см3 (или камеру Горяева). Подсчет клеток в камере Нажотта осуществляют следующим образом. Камеру Нажотта и покровное стекло толщиной 0,2-0,4 мм промывают дистиллированной водой и вытирают насухо. Из каждой контрольной или опытной колбы каплю суспензии водорослей наносят на середину камеры, покровное стекло плотно прижимают к поверхности камеры (в камере не должно быть пузырьков воздуха), дают отстояться 1-2 минуты, после чего начинают подсчет в пяти правых верхних и пяти правых нижних вертикальных счетных полосах. Затем выводят среднее количество клеток в одной полосе. При большом разбросе клеток в полосах просчитывают 10 верхних и 10 нижних полос. Полученное среднее число клеток в одной полосе умножают на коэффициент 1600 и величину разведения (например, при разведении культуры в 10 раз среднее число клеток в одной полосе умножают на 10), определяя численность клеток в 1 см3.
При работе с камерой Горяева притирают покровное стекло до образования радужных колец (интерференция), затем по бокам заполняют камеру и через 1-2 минуты проводят подсчет численности клеток водорослей. Рассчитывают численность клеток на 1 см3 среды следующим образом: количество клеток в 25 больших квадратах камеры Горяева умножают на 104 и получают количество клеток в 1 см3 суспензии.
Из каждой опытной и контрольной колбы просчитывают не менее двух камер. По окончании эксперимента на водорослях проводят обработку полученных результатов острого и хронического опыта. Рассчитывают среднюю численность клеток водорослей в опыте и контроле (в млн. кл/см3 и в процентах).
Результаты исследования учитываются, если численность клеток водорослей в контроле увеличивается за 96 часов не менее чем в 3 раза.
При изменении численности клеток в контроле менее чем в 3 раза результаты опыта считаются недействительными.
Статистическую значимость различия между численностью клеток в контроле и опыте устанавливают в соответствии с приложением N 4 настоящих Методических указаний.
Статистическая значимость снижения (или увеличения) численности клеток в опыте по сравнению с контролем свидетельствует о наличии острого или хронического токсического (эвтрофирующего) действия исследованных концентраций вещества на водоросли.
2. Установление максимальной допустимой концентрации вещества для планктонных ракообразных
Из представителей зоопланктонных ракообразных в морских токсикологических исследованиях используют жаброногого рачка артемию салину (Artemia salina).
2.1. Характеристика тест-организма
Жаброногий рачок - артемия салина (Artemia salina L.) удобен в качестве тест-организма, что определяется его эвригалинностью, доступностью в любое время года исходного материала (яиц), возможностью длительного хранения яиц (в течение нескольких лет), легкостью содержания и культивирования в воде разной солености. Адаптация при этом не требуется.
При благоприятных условиях выклев науплиев артемий из яиц происходит за 1-2 суток (при 25°С - в течение 24 часов; при 20°С в течение 48 ч). В течение первых дней жизни науплии не потребляют оформленной пищи, находятся на эндогенном питании. На 4-е сутки науплии переходят на активное питание оформленной пищей. В зависимости от температурных условий артемий достигают половозрелого состояния в течение 3-4 недель после вылупления из яиц.
В связи с различной устойчивостью артемий к токсикантам на разных стадиях развития, в токсикологических экспериментах ставят опыты с развивающимися яйцами, науплиальными стадиями артемий и взрослыми особями, используя каждую стадию как отдельный тест-организм.
Из всех стадий развития артемий, наиболее чувствительным тест-организмом являются науплии в возрасте 1 суток (переход ортонауплиуса в метанауплис). Данная стадия используется как тест-организм в экспериментах при разработке ПДК вещества.
2.2. Условия лабораторного содержания
Используется обычное лабораторное оборудование, приборы, посуда и реактивы, в том числе:
аквариумные компрессоры;
микроскоп биологический, обеспечивающий увеличение в 100-200 раз;
оксиметр;
рН-метр;
прибор для определения солености воды;
мембранные фильтры (размер пор 0,45 мкм и 3-5 мкм);
дистиллированная вода;
стеклянные бутыли на 20 л - 2 штуки;
стаканы лабораторные на 50, 100, 300, 500, 1000 см3;
чашки Петри;
градуированные пипетки на 10, 5, 1, 0,1 мл;
пипетки Пастера стеклянные, вместимостью 2 см3 с укороченным и оплавленным концом для пересадки рачков;
реактивы марки "хч", а также морская соль;
двухромовокислый калий К2Cr2O7 марки "хч" или стандарт-титр калия двухромокислого;
сухие яйца Artemia salina L. (хранятся в холодильной камере).
Исследование с артемиями (Artemia salina L.) проводят при искусственном или естественном освещении, температуре 20 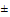 2°С, от выклева из яйца (односуточные науплии) до половозрелого состояния (21 сутки) на природной морской воде или на искусственной морской воде определенной солености.
2°С, от выклева из яйца (односуточные науплии) до половозрелого состояния (21 сутки) на природной морской воде или на искусственной морской воде определенной солености.
При проведении экспериментов с артемиями на искусственной морской воде, последняя служит контролем в экспериментах.
В связи с эндогенным питанием науплиусы артемий не нуждаются в подкормке в течение трех - четырех суток после выклева. В дальнейшем в качестве корма для них используют культуры одноклеточных диатомовых водорослей Phaeodactylum или желто-зеленых жгутиковых водорослей Nephrochloris salina, выращиваемых на среде Гольдберга.
Плотность клеток водорослей в среде с рачками при их кормлении - 100 тыс.кл/см3 (слегка зеленоватый или бежевый цвет среды). Подкармливают рачков через 2 суток.
При достаточном внесении корма рачки распределяются равномерно по всей толще воды и активно движутся. При недостатке корма артемии задерживаются у стенок и дна аквариума, взмучивая осадок, при излишке корма собираются у поверхности воды, при этом движение становится замедленным. В опыт необходимо брать яйца артемий с высоким процентом выклева (60-100%).
Чтобы получить исходный материал для исследования, 1-3 г сухих яиц помещают в химический стакан объемом 500 мл и заливают водопроводной водой, заранее отстоянной и аэрируемой в течение суток. Через 30 мин., не взбалтывая содержимого стакана, сливают слой воды над осевшими яйцами, удаляя таким образом пустые оболочки яиц и погибшие яйца. Процедуру очистки повторяют несколько раз.
Отмытые яйца вновь заливают пресной водой, подводят аэрацию и выдерживают в таком состоянии в течение суток. Через сутки пресную воду сливают и яйца несколько раз промывают фильтрованной и проаэрированной морской водой нужной солености с рН 7,8-8,2. Промытые яйца для выклева помещают в плоский кристаллизатор, наполненный морской водой нужной солености. Содержимое кристаллизатора взбалтывают, при этом яйца располагаются по дну монослоем. Через 18-24 часа в кристаллизаторе вылупляются первые личинки. Для синхронного выклева необходима аэрация и освещенность не менее 1500-2500 лк/м2.
Для получения синхронизированного материала первых выклюнувшихся науплиусов Artemia salina L. тщательно отбирают пипеткой Пастера и переносят в стакан (объемом 150 см3) с морской водой. Через час в кристаллизаторе накапливаются новые науплиусы. Отбирают и переносят науплиусов в тот же стакан с морской водой по мере их выклева - 2-3 раза в течение трех часов, концентрируя организмы возле одной из стенок направленным источником света (новорожденные науплиусы имеют положительный фототаксис). Далее односуточные науплиусы Artemia salina L. используют в эксперименте.
Один раз в месяц (или при использовании новой партии яиц) проводят проверку выклюнувшихся науплиусов на пригодность к токсикологическому анализу, то есть проверяют их физиологическую чувствительность. Для этого определяют значение LC50 (72 ч) эталонного химического вещества бихромата калия для науплиусов.
Если значение LC50 для организмов находится в диапазоне 6,5-8,0 мг/дм3 эталонного вещества, науплиусы пригодны для проведения эксперимента. В случае непопадания LC50 в указанный диапазон концентраций проверяют соблюдение процедуры выполнения определений, условия подготовки организмов к токсикологическому анализу и, при необходимости, используют новую партию яиц.
2.3. Проведение испытаний
Исследования на артемиях проводят в 2 этапа (предварительный и основной).
В предварительном кратковременном исследовании (оценка острого токсического действия вещества в течение 72 часов) по 20 экземпляров науплиусов рассаживают по чашкам Петри в контрольную и опытную среды (40 мл). Число повторностей равно трем. Показания снимают ежедневно (в 1, 2, 3 и 4 сутки), удаляя погибших рачков.
Исследуют, как правило, 5 концентраций вещества. При этом следует стремиться к тому, чтобы по крайней мере две из концентраций вызывали бы эффект менее и более 50%.
При длительном исследовании (оценка хронического токсического действия вещества в течение 21 суток) эксперименты проводят в стаканах емкостью 300-500 см3, число повторностей равно трем. Плотность посадки из расчета 1 экземпляр на 25 см3 среды (количество рачков в контрольных и опытных емкостях каждой концентрации - по 10 экземпляров).
После 4 суток эксперимента, науплиусов кормят водорослями каждые двое суток. Показания снимают по возможности ежедневно (удаляя погибших рачков). Через 21 сутки исследование заканчивается.
2.4. Учет и анализ результатов
Для определения наличия токсического действия растворов вещества на артемий рассчитывают снижение выживаемости тест-организмов в опыте по сравнению с контролем. Проводят статистическую обработку полученных данных в соответствии с Приложением 4 настоящих Методических указаний.
3. Установление максимальной допустимой концентрации вещества для бентосных организмов
При оценке токсического действия вещества на бентосные организмы наиболее часто используют: двустворчатых моллюсков: Мидий (Mytilus sp.), Мускулус (Musculus sp.) (северные, дальневосточные моря, Черное море), Абра (Abra sp.), Кардиум (Cardium sp.), Дидакна (Didacna sp.) (Каспийское море); ракообразных - бокоплавы (Amphipoda) (практически повсеместно).
3.1. Мидии
3.1.1. Характеристика тест-организма
Мидия - широко распространенный вид двустворчатых моллюсков, образует две экологические морфы: скаловую и иловую. Скаловая мидия обитает в прибрежной зоне на каменистых субстратах в горизонте от сублиторали до глубин 20-25 м, образуя в верхнем 10-метровом слое сплошные поселения. Иловая морфа образует банки в открытом море на глубинах до 35-75 м.
По показателю выживаемости мидия обладает высокой токсикорезистентностью ко многим типам загрязнения. Наряду с этим, пороговая чувствительность по некоторым показателям физиологической активности этого моллюска находится на уровне ПДК вещества для водных объектов рыбохозяйственного значения. Широкая распространенность и низкая смертность при изменении абиотических факторов позволяют легко добывать экспериментальный материал и содержать мидий в лабораторных условиях. В то же время повышенная чувствительность физиологических функций к действию токсикантов позволяет с большой точностью определять пригодность водной среды для жизнедеятельности моллюсков.
Для регистрации показателей токсичности используют следующие тест-функции: интенсивность потребления кислорода, биссусный тест, трофическая активность, степень агрегированности и скорость собирания в друзы.
Для проведения исследований наиболее пригодны молодые неполовозрелые мидии размером не более 30 мм, находящиеся в фазе активного роста. На этой стадии онтогенеза мидии обладают наибольшей двигательной, дыхательной и трофической активностью и меньше подвержены индивидуальным различиям, связанным с развитием гаметогенетического цикла.
На Черном море мидия размножается практически круглый год с ярко выраженными пиками в феврале-марте, апреле-мае и августе-сентябре. В планктоне личинки находятся от 8 до 14 суток в зависимости от температуры воды, затем оседают на различные субстраты. Молодь мидий размером 20-30 мм можно найти в водоеме практически круглый год.
3.1.2. Условия лабораторного содержания
При исследовании на мидиях используют следующее оборудование:
респирометры;
термооксиметры модели UT-800, либо анализаторы параметров водной среды марки HORIBA, модель U-7;
счетная камера Нажотта;
микроскоп биологический, обеспечивающий увеличение в 100-200 раз;
прибор для определения оптической плотности воды.
3.1.3. Отбор мидий для опыта
Друзы моллюсков, доставленные из моря, разбирают на отдельные особи, отделяют от обрастаний и детрита и тщательно промывают чистой морской водой. Отделять мидии друг от друга следует осторожно, во избежание повреждения биссусных желез и травмирования моллюсков. Срезают мидий с друзы маленькими ножницами, обрезая биссусные нити у основания раковины. Для отбора мидий в эксперимент и первичной оценки физиологического состояния анализируемой популяции очищенных мидий помещают в аквариум с проточной водой на 15-25 минут и наблюдают за их двигательной активностью. Здоровые мидии размером 15-25 мм начинают шевелиться и пытаются перемещаться по дну аквариума с помощью ноги уже через 2-3 минуты после помещения в воду. По количеству двигающихся особей можно предварительно судить о состоянии популяции. В норме примерно 95% всех отобранных мидий проявляют двигательную активность в первые 5 минут.
3.1.4. Проведение испытаний
При постановке опыта у каждой группы испытуемых моллюсков одновременно регистрируется несколько параметров физиологической активности. Для этого в качестве рабочей камеры рекомендуется использовать герметичные респирометры объемом 2-3 дм3 с большой площадью дна, на который размещаются датчики постоянной регистрации содержания кислорода, магнитная мешалка, пробоотборник проб воды для определения концентрации корма при выяснении трофической активности тест-организмов. В полевых условиях магнитная мешалка может быть заменена на электромотор (питаемый от аккумулятора или батареи и снабженный крыльчаткой), помещенный в воду. Если по схеме эксперимента дыхательная активность не измеряется, то перемешивание воды может осуществляться с помощью принудительной аэрации. Число организмов в эксперименте - 50-100 экземпляров. Количество параллельных серий - 3.
Для определения влияния того или иного токсиканта на физиологическую активность мидий в респирометры наливают морскую воду, содержащую определенное количество испытуемого вещества. Выбор рабочих концентраций осуществляется по стандартной схеме токсикологического биотестирования, включая предварительный и окончательный этапы эксперимента. Если необходимо провести оценку физиологического состояния мидий, взятых из определенного района побережья, то респирометры заливают природной морской водой, взятой из того же места, что и испытуемые мидии. Как в первом, так и во втором случае воду перед заливкой в респирометры аэрируют не менее 30 мин. для полного насыщения кислородом. После заливки респирометров водой и их герметизации включают магнитную мешалку. Измерения производят через 15 минут. Регистрируются следующие параметры:
а) концентрация кислорода в воде;
б) температура воды;
в) количество мидий, собравшихся в друзы (друзой считается группа соприкасающихся мидий, состоящая из трех или более экземпляров);
г) прикрепленность ко дну аквариума (определяют длинным проволочным щупом, пропускаемым через отверстие в крышке респирометра, которое после определения закрывают пробкой).
Длительность эксперимента определяется скоростью потребления кислорода. Опыт прекращается, когда концентрация кислорода в воде снижается по сравнению с исходной на 30%. Если дыхание происходит очень слабо, то длительность эксперимента следует ограничить до 4-5 часов, так как дальнейшая экспозиция может быть сильно замаскирована разложением детрита, выделяемого мидиями.
Для проведения экспериментов, в схему которых включено измерение трофической активности мидий, предварительно готовят кормовую смесь. Обычно это суспензия микроводорослей различных видов, либо гомогенат талломов макрофитов. Опыты по определению трофической активности мидий ведутся без измерения потребления кислорода. Аэратор, работающий на малом режиме, остается в аквариуме на все время эксперимента, так как снижение концентрации кислорода в воде блокирует трофику мидий.
Определенное количество микроводорослей либо определенную навеску гомогената помещают в рабочий аквариум с равномерно размещенными мидиями и тщательно перемешивают с помощью аэратора.
Аликвоты для измерения концентрации пищи в среде отбирают через каждые 5 мин. Все остальные параметры снимают через каждые 15 мин. Аликвоты либо фиксируют для дальнейшего просчета клеток под микроскопом (в случае кормления водорослями), либо помещают в счетную камеру прибора для измерения оптической плотности (в случае кормления гомогенатом). Исходная концентрация корма зависит от разрешающей способности применяемой аппаратуры.
3.1.5. Учет и анализ результатов
На основании экспериментальных данных по стандартным статистическим и биометрическим методикам обрабатывают полученные показатели физиологического состояния мидий. Определяют:
а) интенсивность дыхания - потребление кислорода в единицу времени на единицу биомассы и на одну особь; 2) степень агрегированности - отношение числа особей в друзах к общему числу особей в опыте выражают в процентах;
б) скорость прикрепления к субстрату - время, за которое 50% особей прикрепились ко дну рабочего аквариума;
в) трофическую активность - количество корма, потребленного одной особью за единицу времени.
Сравнивая показатели, полученные у мидий, взятых в качестве контроля, с показателями, полученными у мидий, подвергшихся действию химического вещества, можно оценить степень нарушения физиологического состояния мидий и сделать заключение о токсичности растворов вещества. Методы статистической обработки полученных результатов приведены в Приложении 4 настоящих Методических указаний.
3.2. Бентосные ракообразные - амфиподы (Gammarus finmarchicus, Niphargoides maeoticus и др.).
Амфипод (бокоплавов) собирают в прибрежной зоне на литорали и адаптируют к лабораторным условиям не менее 14 суток при температуре, близкой к среде их обитания. Собранные бокоплавы после акклимации могут использоваться в исследованиях и для культивации в лаборатории
Культивацию в лаборатории осуществляют в аквариумах с большой площадью дна и большим количеством укрытий. В зависимости от размеров особей, на каждую особь должно приходиться до 1 дм2 укрытий. Температурно-соленосный режим и режим питания для каждого вида подбирается согласно условиям обитания в естественных условиях. Чаще всего в качестве корма при культивировании используют бурые водоросли, кусочки овощей и рыбы.
Влияние различных концентраций химических веществ на амфипод исследуют в условиях острого и хронического экспериментов при оптимальных температурных условиях (соответствующих температурному режиму морей северных и южных регионов страны). Опыты проводят в чашках Петри или кристаллизаторах объемом до 2,0 дм3.
Острый опыт предназначен для определения диапазона концентраций хронического опыта. Проводится при 4-6 концентрациях в трех повторностях каждая. Длительность острого опыта составляет 96 часов. В остром опыте учитывают влияние исследуемого вещества на выживаемость и поведение бокоплавов.
Длительность хронического опыта составляет 30 суток. Исходной концентрацией для длительных исследований служит наибольшая безвредная концентрация, определенная в остром опыте. При проведении хронического опыта следует соблюдать режим кормления, рекомендованный для культивирования данного вида. О токсичности различных концентраций вещества в хроническом опыте судят по следующим показателям:
выживаемости взрослых особей и молоди;
поведенческим реакциям, образование пар, появление молоди;
нарушению рефлекса питания;
Для регистрации нарушения рефлекса питания применяют сообщающиеся двухкамерные аквариумы, заполненные раствором исследуемого вещества. В эксперименте используют голодных амфипод, взятых из чистой морской воды (контроль), а также после предварительного 5-суточного экспонирования их в различных концентрациях вещества. Амфипод сажают в один отсек, в другой отсек помещают пищевой раздражитель. Затем регистрируют двигательную активность рачков в течение часа, определяя предпочтение пребывания в каждой из двух зон, направление движений, время нахождения корма, пищевые предпочтения, поедаемость корма.
Проводят статистическую обработку полученных данных в соответствии с Приложением 4 настоящих Методических указаний.
4. Установление максимальной допустимой концентрации вещества для рыб
4.1. Рыбы на ранних стадиях развития
4.1.1. Вводные замечания
При оценке действия веществ на ихтиофауну эксперименты проводят на икре, личинках, мальках, молоди или взрослых половозрелых рыбах.
В настоящее время отсутствуют культивируемые морские рыбы, удобные для проведения опытов на всех этапах раннего онтогенеза (от эмбрионов до сеголетков). На рыбоводных заводах икра проходных и полупроходных рыб, их личинки, мальки и более старшая молодь до определенного времени развиваются в пресной воде.
Актуальным, наиболее удобным и весьма чувствительным тест-организмом является хорошо изученная в токсикологическом плане, легко культивируемая в искусственных условиях морская культура - гуппи (Poecilia reticulata Peters, 1859). Исследования на гуппи в возрасте 1-2 суток в остром эксперименте (96 ч) условно можно рассматривать как ответную реакцию личинок рыб на токсическое воздействие. Высокая чувствительность гуппи сохраняется на протяжении первых 4 суток, затем их чувствительность к химическим веществам несколько снижается, но остается на достаточно высоком уровне. Кроме того, эксперименты, проведенные на половозрелых особях морской лабораторной культуры гуппи, позволяют не только всесторонне оценить на однородном материале воздействие химических веществ на старшие возрастные группы рыб, но и использовать более широкий, чем при работе с природными (дикими) популяциями. Спектр исследуемых параметров, в частности, показатели реальной плодовитости и жизнестойкости выметанной молоди, характеризуют основополагающий и наиболее чувствительный репродуктивный период.
При кратковременном исследовании (острые опыты до 96 ч) определяется острое токсическое действие тестируемых растворов веществ на рыб по показателю "выживаемость". Показатель токсичности вещества - снижение выживаемости рыб на 50% за период от 24 до 96 ч.
При длительном исследовании (хронические опыты 30 и более суток) - устанавливается статистически значимое по сравнению с контролем снижение выживаемости при более низких (сублетальных) концентрациях, а также оценивается влияние на морфо-функциональные показатели, реальную плодовитость рыб, изменение поведенческих реакций и других показателей жизнедеятельности организмов под постоянным воздействием токсиканта.
Для работы с рыбами необходимо иметь следующее оборудование и материалы:
емкости для содержания рыбы и проведения исследований из химически инертного материала соответствующей вместимости с учетом рекомендуемой нагрузки;
стеллажи для размещения аквариумов;
биологический инверсионный микроскоп и/или бинокуляр с достаточным увеличением (не менее 80);
помещение с кондиционируемым воздухом с регулируемой температурой для поддержания температуры на необходимом уровне;
магнитная мешалка;
холодильник;
весы аналитические;
рН-метр;
оксиметр;
солемер;
оборудование для определения жесткости воды;
термометры;
сачки;
фильтры;
фотоаппаратура;
аквариумные компрессоры, распылители;
аквариумные водонагреватели с датчиками;
резиновые шланги разного диаметра и длины, резиновые груши;
лабораторный халат, перчатки, респиратор;
маркер/карандаш по стеклу;
"нерестовая ловушка" - сетка из инертного материала с размером
отверстий 3,5_0,5 мм;
пипетки с широкими отверстиями для сбора икринок;
стеклянные сосуды и посуда для приготовления различных испытуемых концентраций и воды для разведения (стаканы, мерные колбы, мерные цилиндры и мерные пипетки и другое);
если для проведения испытания используют альтернативные системы воздействия, такие как проточные или с пассивным дозированием, то требуются соответствующие условия и оборудование;
рабочие журналы, компьютер и прочие материалы и инструменты.
4.1.2. Характеристика тест-организма
Гуппи (Poecilia reticulata Peters, 1859) - широко распространенная аквариумная живородящая рыбка. В природе встречается как в соленых, так и в пресных водоемах. Выдерживает значительные колебания солености.
Данный тест-организм широко применяется в международных и национальных стандартах при токсикологических исследованиях морей и внутренних морских вод.
Гуппи - мелкие рыбы с ярко выраженным половым диморфизмом. Самки в среднем достигают 4-6 сантиметров в длину, самцы обычно не превышают 3-4 сантиметров. Самки серенькие, с темным пятном в задней части брюшка, у некоторых пород на плавниках черные, желтые или красноватые пятнышки. Маленькое, узкое тельце хорошего взрослого самца сплошь покрыто разноцветными пятнами. Гуппи выдерживают многократное близкородственное скрещивание, что облегчает получение чистых линий.
Для исследований используют рыб, адаптированных к различной солености. Изменение солености от 0 до 10% гуппи переносят без длительной адаптации, до 20% - с адаптацией в 7-14 суток, к океанической солености до 35% занимает еще около двух недель.
4.1.3. Условия лабораторного содержания
Для содержания (культивирования) гуппи используют термостатированные аквариумы, обеспечивающие плотность посадки тест-организмов из расчета для молоди 1 экземпляр на 1-2 литра, и для половозрелых рыб - 1 экземпляр на 5 литров воды. Аквариум размещают в помещении, не содержащем токсических паров или газов, заполняют отстоянной и проаэрированной в течение 7 суток морской водой необходимой солености. Искусственная морская вода для содержания гуппи должна отвечать следующим требованиям: рН 7,8-8,2, температура 23-26°С. Воду в аквариуме аэрируют с помощью аквариумных компрессоров. Каждые три дня часть воды (1/4-1/5 часть) заменяют свежей. Первоначальный объем воды в аквариумах поддерживают постоянным, доливая дистиллированную воду вместо испарившейся и контролируя соленость с помощью солемера. Чистку аквариума проводят регулярно при помощи сифона.
Кроме рыб в аквариум можно помещать зеленую водоросль энтероморфу, которая при достаточном освещении хорошо развивается и служит для гуппи укрытием и кормом.
Кормят гуппи 1-2 раза в сутки (производителей чаще), сухим (дафнии, циклопы) или живым кормом (мотыль, трубочник, дафнии, циклопы). Корм вносят в таком количестве, чтобы рыбы съедали его без остатка за 3-5 минут, так как излишки приводят к ухудшению качества воды в аквариуме. Особенно осторожно следует кормить рыб живыми дафниями и циклопами, которые в морской воде быстро погибают и могут служить источником сильного загрязнения.
Для получения молоди отбирают производителей в возрасте от 1-2 лет (продолжительность жизни гуппи в аквариумных условиях 3-3,5 года). Самку готовят к вымету, помещая в отдельную термостатированную нерестовую емкость объемом не менее 3-5 дм3, заполненную подготовленной дехлорированной водой с температурой 25 2,0°С и большим количеством мелколистных искусственных растений или используют нерестовые ловушки. Готовность самки к вымету мальков определяют по наличию хорошо заметного темного пятна перед анальным плавником. При этом форма брюшка приближается к прямоугольной, и оно становится намного шире спины. Вымет живых, полностью сформированных мальков может происходить в искусственную или природную морскую воду. Для этого самок перед выметом переводят в аквариумы с морской водой. После окончания вымета самок изолируют, так как они поедают потомство. Лучшим кормом для новорожденной молоди является "пыль", состоящая из инфузорий, коловраток, молоди ветвистоусых рачков и науплий веслоногих рачков. При отсутствии "пыли" молодь гуппи кормят перетертыми сухими дафниями или любым другим измельченным сухим кормом. На 100 мальков вносят не более 1 г корма. По мере роста в рацион рыб вводят измельченный трубочник, мотыль, коретру и другой живой корм. Первые две недели жизни мальков кормят до 5 раз в сутки, далее до половозрелости 2-3 раза, взрослых 1-2 раза в сутки. Вносимые порции корма должны быть небольшими и поедаться рыбами в течение 3-5 минут.
2,0°С и большим количеством мелколистных искусственных растений или используют нерестовые ловушки. Готовность самки к вымету мальков определяют по наличию хорошо заметного темного пятна перед анальным плавником. При этом форма брюшка приближается к прямоугольной, и оно становится намного шире спины. Вымет живых, полностью сформированных мальков может происходить в искусственную или природную морскую воду. Для этого самок перед выметом переводят в аквариумы с морской водой. После окончания вымета самок изолируют, так как они поедают потомство. Лучшим кормом для новорожденной молоди является "пыль", состоящая из инфузорий, коловраток, молоди ветвистоусых рачков и науплий веслоногих рачков. При отсутствии "пыли" молодь гуппи кормят перетертыми сухими дафниями или любым другим измельченным сухим кормом. На 100 мальков вносят не более 1 г корма. По мере роста в рацион рыб вводят измельченный трубочник, мотыль, коретру и другой живой корм. Первые две недели жизни мальков кормят до 5 раз в сутки, далее до половозрелости 2-3 раза, взрослых 1-2 раза в сутки. Вносимые порции корма должны быть небольшими и поедаться рыбами в течение 3-5 минут.
Мальков сортируют по размерам и постепенно переводят из нерестовых аквариумов в выростные (вначале объемом 50 литров, а затем - около 200 литров воды). Мальки становятся половозрелыми в 4-6 месяцев.
Гуппи размножаются и растут при солености воды от 0 до 10% без длительной адаптации при их пересаживании. Для тестирования химических веществ в среде с соленостью выше 20% получают исходный материал (мальков) в пресной воде (или в воде с соленостью до 20%) с последующей адаптацией к более высокой солености.
4.1.4. Проведение испытаний
4.1.4.1. Проведение исследований с гуппи возрастом 1 сутки
В опыте используют гуппи возрастом 24-48 часов. Исследования проводят при освещении рассеянным светом, с естественной сменой дня и ночи, концентрацией кислорода в воде не менее 4 мг/дм3 и температурой воды 25 1,0°С. Гибель рыбы в контроле не должна превышать 10%. Диапазон ответной реакции гуппи возрастом 1-2 суток (ЛК50 за 96 часов) на эталонное вещество К2Cr2O7 находится в интервале 45-60 мг/л (для солености до 20 %).
1,0°С. Гибель рыбы в контроле не должна превышать 10%. Диапазон ответной реакции гуппи возрастом 1-2 суток (ЛК50 за 96 часов) на эталонное вещество К2Cr2O7 находится в интервале 45-60 мг/л (для солености до 20 %).
В емкости для проведения опыта помещают по 5-10 особей для каждой из трех повторностей исследуемых концентраций и контроля, обеспечивая плотность посадки не более 1г ихтиомассы/литр воды.
Воду в контрольных и опытных аквариумах не аэрируют. Ежесуточно в каждом аквариуме подсчитывают количество выживших рыб и удаляют погибших. Погибшими считают рыб, не подающих признаков движения или дыхания в течение 3-5 минут после прикосновения к ним стеклянной палочкой.
Для определения наличия острого токсического действия раствора вещества опыт проводят в течение 96 ч. Для определения наличия хронического токсического действия раствора вещества опыт проводят в течение 30 суток. При кратковременном исследовании рыб не кормят. При длительном исследовании смену воды в контрольных и опытных аквариумах проводят каждые 3-7 суток или чаще, в соответствии со стабильностью тестируемого вещества в воде. Один-два раза в сутки рыб кормят.
4.1.4.2. Определение влияния веществ на эмбриональное развитие, ранние стадии и реальную плодовитость гуппи
Поскольку для гуппи характерно внутриутробное развитие, то эксперименты, проведенные на молодых, но половозрелых особях, имеющих первое потомство, сформированное под воздействием токсиканта, позволяют не только всесторонне оценить на однородном материале воздействие химических веществ на ранние стадии внутриутробного развития, но и оценить жизнестойкость выметанной молоди, характеризующую влияние токсиканта на основополагающий и наиболее чувствительный репродуктивный период.
Для изучения влияния тестируемого вещества на реальную плодовитость гуппи, предварительно проводится подготовка тест-организма.
Полученных от производителей мальков в течение 1 месяца выращивают в просторном аквариуме (на 1 малька - 1 литр воды). С появлением первых признаков половых различий самцов отделяют от самок и продолжают выращивать в отдельных аквариумах при температуре 25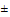 2,0°С до наступления полной половозрелости (4-6 месяцев). С этого момента рыб можно использовать в опыте.
2,0°С до наступления полной половозрелости (4-6 месяцев). С этого момента рыб можно использовать в опыте.
За три дня до начала постановки опытов самцов и самок помещают в общий аквариум для спаривания. Соотношение самцов и самок 2:1. Однажды оплодотворенная самка может приносить приплод несколько раз.
Опыт длится до 30 суток и более, когда все самки рожают мальков.
Опыт проводят в двукратной повторности для каждой концентрации. В каждый аквариум помещают по 3-6 самок. В процессе эксперимента рыб кормят живым кормом. В аквариумах устанавливаются садки с крупными ячейками, нерестовые ловушки, либо "мочало" из инертного материала, имитирующего мелколистные растения, чтобы исключить поедание самками новорожденной молоди.
Показателем токсичности исследуемого раствора вещества служат выживаемость самок, реальная плодовитость (количество жизнеспособной молоди), количество мертворожденной молоди по сравнению с контролем. Методы статистической обработки полученных результатов приведены в Приложении 4 настоящих Методических указаний.
Физиологическую чувствительность полученной молоди желательно проверить по показателю ЛК50 для К2Cr2O7.
4.2. Мальки и взрослые рыбы
Для исследований используют рыб Poecilia reticulata, легко адаптирующихся к широкому диапазону солености. Для этого отлавливают молодь или взрослых особей из маточной лабораторной морской культуры и переносят в опытные сосуды. Принцип проведения исследований аналогичен таковым для пресной воды.
4.2.1. Проведение исследований
Для исследований отбирают одноразмерные экземпляры рыб в хорошем физиологическом состоянии и переводят их на воду необходимой солености, после чего все процедуры проводят в соответствии с рекомендациями, указанных в пункте 4.2.3 приложения N 2 к настоящим Методическим указаниям.
4.2.2. Учет и анализ результатов проводят в соответствии с рекомендациями, указанных в пункте 4.2.4 приложения N 2 к настоящим Методическим указаниям.
5. Оценка генотоксичности вещества
5.1. Вводные замечания
В данной методике предлагается проводить исследование генотоксичности вещества на генном и хромосомном уровне на эритроцитах рыб.
Проводится одновременный тест для выявления генотоксичности на генном и хромосомном уровне по изменению структуры ДНК в ядрах эритроцитов рыб и образованию микроядер.
5.2. Проведение испытаний
5.2.1. Оборудование и материалы для проведения теста по выявлению генотоксичности веществ на эритроцитах рыб для генного и хромосомного уровня.
люминисцентный микроскоп биологический, обеспечивающий увеличение в 100-1000 раз;
мерная посуда для приготовления растворов;
предметные стекла;
пипетки для раскапывания красителя на предметное стекло;
покровные стекла;
пинцет, ножницы;
вегетационные сосуды для рыб.
реактивы:
0,1 % раствор акридинового оранжевого в дистиллированной воде;
забуференный раствор Кребса-Рингера:
NaCl (130 mM), KC1 (5,2 mM), CaCl2 (1,9 mM), MgSO4 (1,29 mM), Na2HPO4 (10 mM). 1M HC1
5.2.2. Подготовка рыбы для двух тестов:
Двухмесячных мальков (Poecilia reticulata) длиной около 2 см помещают в стеклянные аквариумы по 10 штук в отстоянную водопроводную воду (контроль) и в исследуемые концентрации растворов веществ (диапазон из 4-х концентраций). Продолжительность экспериментов составляет 7 суток, в течение которых отбираются сохранившиеся мутации в ДНК и в эритроцитах в процессе эритропоэза в кроветворных органах рыб набираются микроядра. Через 7 суток готовят препараты живой крови рыб и проводят учет микроядер (МЯ) в эритроцитах с применением люминесцентной микроскопии.
5.2.3. Подготовка мазков крови
Для приготовления мазков кровь берут из хвостовой вены. Кровь берется путем отрезания хвостового стебля, что дает получить маленькую каплю крови при соприкосновении среза стебля с покровным стеклом. На каплю крови рыб помещается капля люминесцентного красителя (1 часть 0.1 % раствора акридинового оранжевого в дистиллированной воде на 9 частей забуференного раствора Кребса-Рингера). Краситель с каплей крови покрывается покровным стеклом, таким образом, получается препарат "давленая капля". Через 5 минут (время действия красителя) препарат считается готовым к исследованию. Метод позволяет также исследовать кровь мальков морских рыб, которые являются тест-организмами при установлении рыбохозяйственных ПДК в морской воде.
5.3. Оценка генотоксичности веществ по флуоресценции комплекса ДНК-акрединовый оранжевый в ядрах эритроцитов рыб (выявление генотоксичности на генном уровне по изменению структуры ДНК)
Метод позволяет учитывать изменение структуры ДНК в ядрах эритроцитов рыб под влиянием различных концентраций токсикантов. Приготовленный препарат крови рыб при использовании красителя акридиновый оранжевый в поле зрения люминесцентного микроскопа дает люминесценцию ядер эритроцитов в зависимости от изменения структуры ДНК под влиянием токсикантов. Двуцепочные ДНК (в эритроцитах, не подвергнутых действию мутагена) в комплексе с акридиновым оранжевым флуоресцируют зеленым цветом; при расхождении цепей одноцепочные ДНК дают оранжевое или золотистое свечение, зоны ядра с разрывами нитей ДНК производят гашение флуоресценции, и ядро дает либо слабую зеленоватую флуоресценцию, либо появляется ребристое гашение по всему ядру.
5.3.1. Учет и анализ результатов
В контроле на 3-х препаратах крови рыб "давленая капля" обсчитывается 2000 эритроцитов и рассчитывается соотношение эритроцитов с измененной флуоресценцией по отношению к эритроцитам с зеленой флуоресценцией. Данные заносятся в таблицу (таблица 5.3.1).
Измененное свечение ядер эритроцитов - оранжевый, золотистый цвет, гашение флуоресценции. Для каждой исследованной концентрации вещества также учитывается соотношение количества ядер эритроцитов с измененной флуоресценцией к ядрам с зеленым свечением (при сохраненной структуре ДНК). Статистически достоверная разница между контролем и опытом в соотношении количестве ядер с измененной флуоресценцией указывает на перестройку структуры ДНК под влиянием генотоксиканта.
По результатам подсчета соотношения ядер эритроцитов с измененной и зеленой флуоресценцией можно судить о степени мутагенной активности исследуемого вещества. Пример представления результатов представлен в виде таблицы 5.3.1.
Таблица 5.3.1
Соотношение ядер в эритроцитах Poecilia reticulata с измененной и зеленой флуоресценцией указывающей на наличие генных мутаций ДНК после 7 суточной экспозиции в токсиканте (средняя в 2000 клеток), %.
| Концентрация, мг/л | Контроль | 1 | 2 | 3 | 4 |
|---|---|---|---|---|---|
| Соотношение ядер с золотистым или красным свечением к ядрам с зеленым свечением | |||||
| Соотношение ядер с гашением флуоресценции с к ядрам с зеленым свечением |
5.4. Учет частоты образования микроядер (МЯТ) в эритроцитах рыб (выявление генотоксичности веществ на хромосомном уровне по МЯТ)
Метод позволяет учитывать в цитоплазме эритроцитов рыб частоту образования микроядер, которые представляют собой фрагменты ядерного материал, которые элиминируются из ядра клетки при аберрациях митотических хромосом.
5.4.1. Учет и анализ результатов
В контроле на препарате крови рыб "давленая капля" для каждого варианта опыта обсчитывают не менее 2000 эритроцитов, в которых учитывают количество микроядер и аномалий в эритроцитах (полиморфизм, смещение ядер к периферии, пикноз, хроматолиз, деформация ядер и другие) в процентах.
5.4.2. Представление данных
Проводят статистическую обработку полученных данных в соответствии с Приложением 4 настоящих Методических указаний.
Изменения в сравнении с контролем по каждому исследованному показателю описывают по каждой исследованной концентрации вещества, и делается заключение о возможной генотоксичности и максимально недействующей концентрации исследуемого препарата.
Результаты подсчета микроядер в эритроцитах крови молоди данио и данные о состоянии ядер при действии различных концентраций препарата представляют в виде таблицы.
Таблица 5.4.2
Частота встречаемости микроядер в эритроцитах Poecilia reticulata и цитологические показатели ядер эритроцитов после пребывания рыб в исследуемых растворах препарата (средняя в 2000 клеток), %.
| Концентрация, мг/л | Контроль | 1 | 2 | 3 | 4 |
|---|---|---|---|---|---|
| Частота встречаемости микроядер | |||||
| Частота встречаемости аномальных ядер |
6. Требования к оценке временных нормативов вещества для объектов рыбохозяйственного значения морей и внутренних морских вод Российской Федерации
6.1. Испытания на водорослях
Рекомендуется проведение семисуточных исследований действия вещества на рост культуры водорослей (пункт 1.4 приложения N 3 настоящих Методических указаний, а также требования проведения хронического эксперимента). В качестве альтернативы возможно полное проведение хронического эксперимента с одноклеточными водорослями в течение 14-21 суток. В конце опытов оценивается статистическая значимость отклонений опытных данных от контрольных. Условия культивирования водорослей и постановки токсикологических исследований с ними приведены в пункте 1 приложения N 3 настоящих Методических указаний.
6.2. Испытания на зоопланктонных организмах
Испытания проводятся на односуточных артемиях в течение 7 суток (не полный хронический эксперимент). После семисуточного опыта, как правило, не наблюдается резкого увеличения гибели артемий в эксперименте длительностью 21 суток. В качестве альтернативы возможно полное проведение хронического эксперимента в течение 21 суток. Постановка токсикологических исследований изложена в пункте 2 приложения N 3 настоящих Методических указаний.
6.3. Испытания на рыбах на ранних стадиях развития
Условия получения, содержания икринок и проведения исследований на них при инкубации до 30-45 суток в настоящее время не дают возможности проводить краткосрочные эксперименты с икрой морских рыб.
В то же время, достаточно большое количество токсикологических исследований показывает чувствительность морской культуры гуппи (односуточные организмы) на уровне или на порядок выше ответной реакции эмбрионального развития морских рыб на загрязняющее вещество. Это позволяет рекомендовать острые опыты (96 ч) с использованием в качестве тест-организма новорожденную молодь гуппи в возрасте 24-48 часов. Условия проведения экспериментов.
В качестве максимально допустимой концентрации для рыб принимается максимальная концентрация, не вызывающая статистически значимого повышения смертности мальков гуппи.
6.4. Испытания изменений санитарных показателей водной среды
Санитарно-экологические последствия присутствия в воде исследуемого вещества оцениваются по его влиянию на БПК5 воды.
Исследования проводятся при 20°С в стеклянных сосудах объемом 5 дм3, заполняемых природной морской водой, профильтрованной через мельничный газ N 76 и насыщенной кислородом.
В сосуды вносится исследуемое вещество в 5-7 концентрациях, различающихся на порядок. Один из сосудов остается чистым и используется в качестве контроля. В исходные сутки, а также через 5 суток в пикнометры отбираются пробы воды (по 2 пикнометра на каждую пробу), которые выдерживаются в термостате при 20°С в течение 5 суток.
Через 5 суток после экспозиции в каждом из пикнометров в воде определяют содержание кислорода по Винклеру или с применением специально приспособленных оксиметров.
Расчет величины БПК5 производится следующим образом:
,
где: - исходная концентрация кислорода в воде;
- концентрация кислорода в пробах на соответствующий срок наблюдения.
Результаты используются для составления таблицы или графиков зависимости БПК5 от времени и концентрации исследуемого вещества.
6.5. Определение величины временного норматива.
Из концентраций, выведенных в процессе исследований в качестве максимальных допустимых для каждого из объектов исследования, выбирается наименьшая, которая рассматривается в качестве временного норматива ПДК вещества.
Приложение 4
к Методическим указаниям
по разработке нормативов
качества воды водных объектов
рыбохозяйственного значения,
в том числе нормативов
предельно допустимых
концентраций вредных веществ
в водах водных объектов рыбохозяйственного значения
Рекомендации
по статистической обработке результатов испытания токсичности вещества для пресноводных и морских тест-организмов
1. Общие положения
1.1. Статистическая обработка результатов токсикологических исследований проводится с целью:
а) Определить максимальную допустимую концентрацию (МДК) для каждого тест-организма по каждой тест-функции. За МДК принимают наибольшую из исследованных концентраций, признанных недействующими.
б) Количественно описать зависимость между концентрацией и эффектом, путем вычисления токсикометрических характеристик действия вещества (ЭКх при определенных за определенный срок наблюдения).
1.2. Величина эффекта, которая может быть выявлена с помощью статистического теста с достаточной степенью надежности, зависит от таких аспектов плана эксперимента, как количество повторностей, количество организмов в повторности, вариабельность измеряемой величины, статистический метод и принятый уровень значимости.
Отношение между этой величиной и планом эксперимента выражается количественно через концепцию статистической мощности.
Эти аспекты должны быть учтены на этапе планирования эксперимента (п.3.3 Методических указаний).
1.3 Уровень значимости во всех тестах принимается равным 0,05.
1.4. Выбор статистических методов для проверки гипотез и для анализа зависимости концентрация-эффект во многом зависит от типа полученных данных.
В результате биотестирования получают данные следующих типов:
а) Непрерывные данные могут принимать (теоретически) любое значение из определенного интервала, например любое положительное число. В основе таких данных лежит непрерывное распределение. Если такие данные измеряются с низкой точностью, то они могут выглядеть как дискретные (например, время измеренное раз в сутки). Обычно имеют единицы измерения. Пример: длина, вес, время.
б) Дискретные данные принимают конечное или исчислимое количество значений. Часто такие данные анализируют как непрерывные. Пример: количество потомства.
в) Бинарные данные представлены только двумя значениями - наличие или отсутствие признака (эффекта). Такие данные выражают в долях или частотах от общего количества организмов. Часто бинарные данные могут быть обработаны как непрерывные (например, после углового преобразования, см. п. 2.4.4 настоящего приложения). Пример: гибель, иммобилизация.
Далее будет рассмотрена обработка данных непрерывного и бинарного типов.
1.5. Повторностью считается экспериментальная емкость, а не отдельный организм.
В ряде случаев возможно рассмотрение отдельных организмов в качестве "повторностей", когда есть основания считать, что вариабельность между емкостями мала по сравнению с вариабельностью между организмами.
1.6. Биологическая эффективность определенных концентраций вещества выражается либо через количественное значение тест-функции при этой концентрации в конце срока наблюдения (по отношению к значению в контроле), тогда рассчитывают эффективные (летальные) концентрации (ЭК(ЛК)50 и др.), либо в виде срока достижения определенной величины тест-функции при действии этой концентрации, тогда рассчитывают эффективное (летальное) время (ЭВ(ЛВ)50 и др).
1.7. Общий ход анализа.
Обычно анализ данных следует общему образцу, включающему следующие шаги:
- данные отображают на графике и проверяют визуально
- затем выбирают подходящий метод анализа, основываясь на конкретных допущениях, которые кажутся обоснованными для имеющихся данных
- после анализа проверяют соответствие данных принятым допущениям
- при необходимости, повторяют анализ более подходящим методом
- результаты анализа включают в отчет в виде графиков и таблиц.
1.8. Вычисления рекомендуется выполнять с помощью специального программного обеспечения (ПО), хотя многие из рассмотренных ниже статистических методов доступны для выполнения вручную и не требуют обязательного наличия компьютера.
Распространенные статистические программы, такие как SPSS, Statistica, R и т.п., как правило, предоставляют все необходимые функции.
Нежелательно применение упрощенных методов вычисления ЭКх, т.к. они являются устаревшими и часто не позволяют адекватно оценить точность полученных величин.
1.9. Дополнительную информацию о методах и приемах статистической обработки данных можно найти в соответствующих руководствах.
Кроме рассмотренных ниже методов, могут быть использованы и другие статистические подходы, обеспеченные достаточным обоснованием.
2. Первичная обработка данных
2.1. Визуализация данных.
На этапе подготовки данных рекомендуется представить полученные данные в виде графиков или диаграмм. Визуализация данных помогает обнаружить проблемы, такие как чрезмерно высокий разброс данных в повторностях или неожиданные виды зависимости концентрация-эффект.
График также помогает при выборе наиболее подходящей статистической модели и при интерпретации результатов.
При построении графиков ось концентраций часто делают логарифмической.
2.2. Выявление выбросов.
Выброс - точка, далеко отстоящая от интуитивных ожиданий или общей тенденции в данных. Необходимо убедиться, что данные не содержат "выбросов".
Выброс может быть как результатом систематической ошибки в эксперименте, так и неправильного предположения о распределении данных (например, нормальное вместо логнормального), поэтому удалить выброс можно только после всестороннего анализа.
Один из способов выявления выбросов, пригодный при малом количестве повторностей - проверка остатков дисперсионного анализа (ANOVA).
2.3. Проверка нормальности распределения данных и гомогенности дисперсии.
Соответствие данных нормальному распределению и выполнение условия гомогенности дисперсии (равенство дисперсий в группах) (гомоскедастичность данных) позволяет анализировать данные с помощью параметрических методов, которые, как правило, являются более мощными, чем непараметрические.
Если эти условия не соблюдаются, следует применять непараметрические методы, или провести преобразование данных с тем чтобы выполнялись условия применения параметрических методов.
Несмотря на то, что некоторые параметрические тесты довольно устойчивы к небольшим отклонениям данных от нормальности и не требуют гомогенности дисперсий, проверка этих условий полезна в случае сомнительных наблюдений или подозрений в пригодности применяемого метода, а также при преобразовании данных.
При малом количестве повторностей проверка нормальности и гомоскедастичности данных в каждой экспериментальной группе (концентрации) с помощью распространенных статистических тестов некорректна, т.к. соответствующие тесты (Шапиро-Уилка, Левена, Бартлетта и др.) обладают достаточной мощностью только при объеме выборки не менее 20 значений.
В этих условиях рекомендуется проводить проверку нормальности и гомоскедастичности с помощью дисперсионного анализа (ANOVA). Способ основан на свойствах нормального распределения: если значения зависимой переменной в каждой экспериментальной группе распределены нормально, то нормально будут распределены и значения остатков соответствующей линейной модели. Поэтому можно вместо проверки нормальности распределения значений зависимой переменной в каждой группе, проверить нормальность распределения остатков модели (число которых равно общему объему наблюдений).
Проверку проводят с помощью соответствующих тестов (например, Шапиро-Уилка), а также графически - с помощью квантильных диаграмм.
Гомоскедастичность также проверяют графически, по диаграмме зависимости остатков модели от предсказанных значений.
Если допущения параметрических методов не выполняются, возможны следующие подходы к анализу таких данных:
- использовать непараметрические методы или методы, основанные на другом известном распределении (отличном от нормального);
- преобразовать данные так, чтобы допущения выполнялись, и использовать параметрические методы.
2.4. Преобразование данных
2.4.1. Преобразование данных проводят с целью устранить гетерогенность дисперсии и сделать данные более соответствующими нормальному распределению. Соответствие данных этим требованиям после преобразования проверяют с помощью остатков ANOVA.
2.4.2. В некоторых случаях преобразование данных нежелательно или бесполезно. Например, гетерогенность дисперсии может иметь биологическую природу, например если отклик организмов зависит от пола. В этом случае данные следует анализировать по подгруппам.
2.4.3. Не рекомендуется выражать эффекты в процентах от контроля в ходе анализа зависимости концентрация-эффект, т.к. при этом выпадает из рассмотрения вариабельность в контроле.
2.4.4. Наиболее обычным способом трансформации количественных переменных является логарифмирование. При работе с частотами и долями иногда используют извлечение квадратного корня из исходных значений. Эти, а также некоторые другие способы, являются частными случаями более общего подхода - степенной трансформации по Боксу-Коксу (англ. Box-Cox transformation).
Для нормализации бинарных данных, выраженных в виде частот (долей), ряд руководств рекомендуют применять угловое преобразование (фи-преобразование): arcsin(sqrt p), где p - частота события, выраженная в долях единицы.
Эта величина представляет собой угол, выраженный в радианах, она имеет распределение, близкое к нормальному, и может использоваться в параметрическом статистическом анализе.
2.4.5. Следует учитывать, что преобразование данных затрудняет интерпретацию результатов. Средние значения и доверительные интервалы, вычисленные для преобразованных данных, должны быть преобразованы в исходные единицы измерения. Обратное преобразование стандартного отклонения - некорректно.
Следует с осторожностью интерпретировать величину эффекта для преобразованных данных. Например, изменение не преобразованных данных на 25% не равно изменению преобразованных данных на 25%.
3. Определение максимальной допустимой и пороговой концентраций.
3.1. За максимальную допустимую и пороговую концентрацию (далее - МДК) принимают наибольшую из исследованных концентраций, признанных недействующими. Пороговая концентрация - следующая за МДК в ряду исследованных концентраций (по возрастанию).
3.2. Для определения недействующих концентраций применяют статистический метод проверки гипотезы о равенстве средних.
3.3. Недействующей концентрацией исследуемого вещества считают такую концентрацию, при которой не выявлено статистически значимое отклонение величины тест-функции от ее величины в контроле за срок исследований.
3.4. Следует иметь в виду, что отсутствие статистической значимости не означает отсутствия эффекта, т.к. достаточно большие и биологически значимые различия могут оказаться статистически незначимыми в результате низкой мощности статистического теста (п.1.2 настоящего приложения).
При высокой мощности теста может оказаться статистически значимым небольшое различие, не имеющее биологической значимости. В таких случаях недействующей может быть признана концентрация, при которой величина тест-функции статистически значимо отличается от контроля, но это различие не превышает величину биологически незначимого эффекта (10%).
3.5. Результаты анализа представляют в виде двух величин, максимальной недействующей и пороговой концентраций, за определенный срок наблюдения.
3.6. Точность определения МДК и пороговой концентрации не может быть выражена обычными статистическими оценками (например, доверительным интервалом), т.к. эти величины ограничены определенным набором концентраций. Ширина интервала между МДК и пороговой концентрацией зависит от интервала между исследованными концентрациями. Кроме того, необходимо учитывать биологические (сублетальные) эффекты, которые могут являться основанием для ужесточения значений максимально допустимой и пороговой концентраций.
3.7. При проведении нескольких сравнений с одним и тем же контролем необходимо вводить поправки для множественных сравнений.
Одно из решений - корректировка полученных р-значений при помощи поправки Бонферрони-Холма.
Некоторые тесты, например, тест Даннета, учитывают множественные сравнения и дополнительная коррекция не требуется.
3.8. Предпочтительно использовать односторонние тесты, если это биологически обосновано (например, для показателя выживаемости), т.к. их мощность выше.
3.9. Обработка данных непрерывного типа.
3.9.1. Для каждой концентрации вычисляют среднее значение и стандартную ошибку среднего (или доверительный интервал). Если данные существенно отклоняются от нормального распределения, они могут быть представлены медианой и какой-либо мерой вариабельности, подходящей для имеющегося количества повторностей (например, интервал между минимумом и максимумом, межквартильный размах).
3.9.2. Если необходимо, выполняют преобразование данных.
3.9.3. Статистические тесты.
Если выполняются допущения параметрических тестов (нормальность, гомоскедастичность), для сравнения средних рекомендованы тест Стьюдента (с поправкой Бонферрони-Холма) или тест Даннета. Тест Даннета в данном случае является более мощным.
При небольших отклонениях от нормальности и гомоскедастичности может применяться тест Стьюдента в модификации для неравных дисперсий (тест Уэлча). При этом нет необходимости предварительно проверять равенство дисперсий, при равных дисперсиях результаты теста Уэлча и теста Стьюдента (для равных дисперсий) близки.
Если допущения не выполняются, могут быть использованы непараметрические тесты, например тест ранговых сумм Уилкоксона, более широко известный как тест Манна-Уитни (Mann-Whitney U-test).
Следует учесть, что при малом числе повторностей непараметрические тесты могут неправильно работать или обладать низкой мощностью. 3.9.4. На основании результатов статистических тестов определяют МДК и пороговую концентрацию, вычисляют величины эффекта при этих концентрациях и их доверительные интервалы. 3.10. Обработка данных бинарного типа. 3.10.1. Для бинарных данных, представленных в виде частот (долей), возможны следующие альтернативные способы обработки:
а). Применить угловое преобразование частот, что позволит анализировать эти данные как непрерывные.
В некоторых случаях такой подход нецелесообразен:
- если хотя бы в одной из групп (концентраций) во всех повторностях равные значения тест-функции (отсутствует вариабельность между повторностями).
- если схема эксперимента предполагает размещение по 1 организму в повторности (емкости).
б). Объединить данные из всех повторностей и построить на их основе таблицу сопряженности, которую затем анализировать с помощью соответствующих тестов (п. 3.10.2 настоящего приложения).
Следует учитывать, что чувствительность (мощность) теста в первом случае зависит от количества повторностей, а во втором - от суммарного количества организмов в концентрации.
3.10.2. Статистические тесты для таблиц сопряженности.
Для анализа таблиц сопряженности рекомендованы следующие тесты:
- тест Хи-квадрат. Следует применять с учетом ограничений на значения ожидаемых частот (не меньше 5). Для результатов биотестирования по схемам, приведенным в данном руководстве, это условие часто не выполняется.
- точный тест Фишера. Широко применяется в биомедицинских исследованиях.
- другие точные тесты. По данным ряда работ, тест Фишера не является наиболее подходящим для того типа таблиц сопряженности, который получается в результате биотестирования. Лучшие результаты дает тест Барнарда, он является более мощным. Но этот тест представлен не во всех статистических пакетах.
Результаты тестов необходимо корректировать с помощью поправки Бонферрони-Холма.
3.10.3. На основании результатов статистических тестов определяют МДК и пороговую концентрацию, вычисляют величины эффекта при этих концентрациях и их доверительные интервалы.
3.11. Особые случаи.
В некоторых случаях данные (например, время выклева и т.п.) нельзя обработать параметрическими методами, т.к. их распределение далеко от нормального, а непараметрические методы неприменимы из-за недостаточного количества повторностей. Такие данные не поддаются статистическому анализу при данной схеме эксперимента.
Представление таких данных в отчете ограничивается описательной статистикой (объем выборки, диапазон значений и т.п.).
4. Анализ зависимости концентрация-эффект и вычисление ЭКх.
4.1. Как правило, зависимость концентрация-эффект имеет S-образную форму. Ее основные характеристики - положение точки перегиба и ширина диапазона концентраций, в пределах которого проявляется эффект (зона эффекта).
Часто выполняют линеаризацию предполагаемой S-образной кривой путем определенной трансформации данных.
Точке перегиба соответствует величина ЭК50 (ЛК50).
Ширину зоны эффекта оценивают с помощью углового коэффициента прямой, который численно равен тангенсу угла между этой прямой и осью абсцисс. Чем больше угловой коэффициент, тем прямая менее пологая, а зона эффекта - более узкая.
Ширину зоны эффекта можно охарактеризовать также с помощью пары значений, например, ЭК10 - ЭК90, или при других х, достаточно близких к 0% и 100% эффекта (п. 4.3 настоящего приложения).
4.2. Выбор метода вычисления ЭКх и углового коэффициента определяется тем, содержат ли данные достаточно информации о форме зависимости концентрация-эффект. Рекомендуется вычислять токсикометрические параметры с помощью статистического моделирования (регрессионные модели). Если имеющиеся данные не позволяют получить адекватную регрессионную модель, возможно определение ЛК50 графическим способом.
4.3. Следует по возможности вычислять доверительные интервалы (или стандартные ошибки) для ЭКх, т.к. эти величины оцениваются по выборочным данным. Точность определения ЭКх максимальна для х=50% и уменьшается при приближении х к 0% или 100%.
Как правило, нецелесообразно вычислять ЭКх при х<10% из-за низкой точности этих оценок. В некоторых случаях с приемлемой точностью можно определить ЭКх только при х=20% и выше. То же относится Экх, близким к 100%.
Поэтому для характеристики зоны эффекта обычно вычисляют ЭК10 и ЭК90. Если точность этих оценок недостаточна, то х увеличивают и вычисляют, например, ЭК20 и ЭК80. Если вычисление ЭКх невозможно, используют ЛК0 и ЛК100. Если ЛК100 определить невозможно, указывают максимальную наблюдавшуюся величину эффекта и соответствующую концентрацию.
В ряде случаев вычисляют ЛК16 и ЛК84 - если вычисления проводят с помощью пробит-анализа, где эти величины могут применяться для оценки стандартной ошибки ЛК50.
4.4. Общий ход анализа.
4.4.1. Оценивают имеющиеся данные визуально. Решают, следует ли исключить из рассмотрения какие-либо данные (например, данные для концентраций далеко за пределами зоны эффекта, т.к. они не содержат информации о моделируемой кривой).
4.4.2. Выбирают модель (или несколько подходящих моделей).
Математическая функция в основе модели теоретически может быть любой, она должна только хорошо описывать экспериментальные данные. На практике чаще всего для анализа зависимости концентрация-эффект применяется линейная регрессия, основанная на методе наименьших квадратов (МНК). Этот метод является параметрическим и требует определенного преобразования данных.
Существует непараметрическая альтернатива - обобщенные линейные модели (GLM). При этом подходе анализ не преобразованных данных основан на другом распределении, например Пуассона (для счетных данных) или биномиальном (для частот). Частным случаем GLM является пробит-модель.
Также могут применяться нелинейные модели, в том числе модели, учитывающие гормезис при наличии соответствующего ПО.
Все эти модели дают довольно близкие значения ЭК50 (при достаточном объеме данных). Методы вычисления доверительных интервалов для разных моделей в разном ПО могут отличаться.
4.4.3. При необходимости выполняют преобразование данных.
Концентрации, как правило, логарифмируют.
Эффекты могут быть выражены в процентах (долях, частотах) для данных бинарного типа или в единицах измерения тест-функции для данных непрерывного типа (например, численность клеток водорослей).
Не рекомендуется выражать эффект в процентах от контроля (применять поправку Аббота), т.к. при этом теряется информация о точности оценки тест-функции в контроле.
По возможности следует включать контроль в модель.
При использовании параметрических методов (МНК-регрессия) может потребоваться нормализация данных. Данные непрерывного типа чаще всего логарифмируют. Для бинарных данных, как правило, применяют пробит-преобразование, основанное на функции нормального распределения.
В некоторых случаях преобразование не требуется - если выявлен линейный характер зависимости в не преобразованных данных, если применяют непараметрические методы и/или необходимые преобразования автоматически выполняются ПО при подгонке модели (например, пробит-преобразование в моделях GLM).
4.4.4. Строят модель на имеющихся данных (с помощью соответствующего ПО).
4.4.5. Выполняют диагностику модели (оценивают соответствие модели данным) следующими способами: визуально, сравнением предсказанного эффекта и наблюдаемого, с помощью коэффициента детерминации (для линейных моделей), с помощью F-теста (или других методов) анализируют дисперсию остатков, оценивают значимость параметров модели.
Если требуется, проверяют нормальность и гомоскедастичность данных по остаткам полученной модели.
4.4.6. Если построены несколько моделей, выбирают одну из них в соответствии со следующими принципами:
- из двух вложенных моделей выбирают модель с меньшим числом параметров;
- из двух моделей, одинаковых по числу параметров, выбирают лучше подогнанную.
4.4.7. Оценивают качество интерполяции (при наличии нескольких моделей): если две модели одинаково хороши по признакам, перечисленным в пункте 4.4.6, но имеют существенно разную форму - значит имеющихся данных недостаточно для правильной оценки формы кривой и вычисления ЭКх. Такой результат может получиться при слишком больших интервалах между концентрациями. Поэтому требуется осторожность в оценке моделей - хорошее соответствие данным не гарантирует правильность модели.
4.4.8. Вычисляют ЭКх, их доверительные интервалы (или стандартные ошибки). Определяют угловой коэффициент (обычно это один из параметров модели) и его доверительный интервал (или стандартную ошибку).
Если предварительно проводили преобразование данных, то результаты (ЭКх и доверительные интервалы) должны быть выражены в исходных единицах измерения (т.е необходимо выполнить обратное преобразование).
4.4.9. Дополнительную информацию по работе с регрессионными моделями можно найти в руководствах по регрессионному анализу и справочной литературе по соответствующему ПО.
4.5. Следует избегать экстраполяции, т.е. предсказания значений за пределами диапазона экспериментальных данных, поскольку модель отражает только информацию, содержащуюся в данных (без предположений о механизмах моделируемого явления) и не гарантирует соответствия данным за пределами исследованного диапазона.
4.6. В ряде случаев имеющихся данных недостаточно для регрессионного моделирования. Например, если зависимость концентрация-эффект имеет крутой наклон (зона эффекта узкая по сравнению с интервалом между концентрациями), поэтому имеются только 1-2 концентрации с частичным эффектом (не 0 и не 100%), либо только данные с 0% и 100% эффектом. В таких случаях могут быть использованы дополнительно величины ЛК0 и ЛК100 для приблизительного вычисления ЛК50 графическим способом.
В системе координат по оси абсцисс откладывают десятичные логарифмы концентраций, а по оси ординат - величину эффекта (гибели) в процентах. Проводят прямую линию максимально близко к полученным точкам, либо вычисляют коэффициенты соответствующего линейного уравнения методом наименьших квадратов. Проводят горизонтальную линию, соответствующую 50% гибели, и в точке ее пересечения с полученной прямой вычисляют концентрацию ЛК50.
При таком подходе оценка точности величины ЛК50 невозможна.
4.7. Существуют упрощенные методы анализа зависимости концентрация-эффект, разработанные для вычислений "вручную". Они могут применяться в исключительных случаях, но следует учесть, что эти методы не обеспечивают достаточную оценку точности и полученные значения ЭКх могут считаться лишь приблизительными, как и полученные графическим способом.
4.8. Вычисление эффективного времени (ЭВх).
ЭВх вычисляют аналогично ЭКх, применяя перечисленные выше подходы к зависимости время-эффект.
5. Представление результатов
5.1. В отчет включают:
- перечисление статистических методов с описанием особенностей их применения (если необходимо) и результаты проверки выполнения допущений этих методов (если необходимо)
- данные по контролю качества (чувствительность тест-организмов к стандартному токсиканту, содержание кислорода в среде, рН и т.п.)
- сырые данные в табличной форме и/или в виде графиков
- результаты анализа полученных данных для каждой тест-функции каждого тест-организма, в том числе МДК и пороговую концентрацию, ЭКх с доверительными интервалами (по возможности), параметры модели и ее график (при наличии модели).
- обобщение и заключение по результатам анализа, включающее величину ПДК, лимитирующее звено и ЛПВ.
5.2. При представлении результатов статистического анализа данных рекомендуется указывать точное значение критерия и точное значение достигнутого уровня статистической значимости (р). Не рекомендуется указывать р-значения как р <0,05. Исключение составляют очень малые значения р, которые можно представлять как р < 0,001.
5.3. Для МДК и пороговой концентрации рекомендуется кроме статистической значимости приводить величину эффекта и точность ее оценки, например доверительный интервал.
5.4. Эффект выражают в процентах. Для данных бинарного типа рекомендуется выражать эффект в виде разности долей (процентов) в контроле и концентрации, а не в процентах от контроля.
5.5. Доверительные интервалы рекомендуется выражать в виде границ диапазона, а не в виде величины, прибавленной к среднему (или вычитаемой), т.к. доверительный интервал может быть асимметричным, особенно если проводили преобразование данных.
5.6. Если в отчет включают регрессионную модель, то для нее указывают параметры модели с доверительными интервалами (или стандартными ошибками), критерии соответствия данным, статистическую значимость модели (критерий и р-значение).
5.7. Не рекомендуется использовать термин "достоверные различия", т.к. наличие статистически значимых различий не означает их достоверности (поскольку в современной статистике достоверность понимается как вероятность, близкая к единице).
Приложение 5
к Методическим указаниям
по разработке нормативов
качества воды водных объектов
рыбохозяйственного значения,
в том числе нормативов
предельно допустимых
концентраций вредных
веществ в водах водных
объектов рыбохозяйственного значения
Аннотационная карта
НОРМИРУЕМОЕ ВЕЩЕСТВО
1. Организация-разработчик (адрес почтовый, тел/факс).
Рецензент.
2. Организация-заказчик.
3. Название отчета.
4. Название нормируемого вещества (товарное; химическое, указать N CAS; синонимы); его состав для смесевых препаратов (указать действующее вещество).
Область применения исследуемого вещества.
5. Эмпирическая и структурная формула.
6. Основные физико-химические показатели: молекулярная масса (М.М.); температура плавления (Tплав°С); агрегатное состояние; растворимость в воде (мг/л); плотность (г/см3), показатель LogKow и т.п.
7. Стабильность в водной среде. Порог влияния на показатели водной среды.
8. Наличие метода химического анализа вещества в воде, включение в государственный реестр.
9. Трофический статус водного объекта, из которого берется вода для опытов (продуктивность, содержание общего хлорофилла в цифровом выражении и проч.).
10. Природное фоновое содержание в водном объекте вещества, на которое разрабатывается предельно допустимая концентрация ПДК вещества или временный норматив ПДК вещества.
11. Качество фоновой среды (воды), используемой при проведении токсикологических исследований: минерализация, жесткость, рН, окисляемость, содержание биогенов и т.п. Гидрохимический класс и группа вод по классификации О.А. Алекина.
12. Характер загрязнения водной среды в опыте: опалесценция, пленка, изменение цвета раствора, истинность или коллоидность раствора, для мелкодисперсных взвесей - скорость оседания частиц и т.д.
13.Результаты исследований в таблице:
| Охраняемое звено | Тест-организм | Определяемый показатель* | Время экспозиции, сут. | Пороговая концентрация, мг/л | Недейству-ющая концентрация, мг/л |
|---|---|---|---|---|---|
| 1 | 2 | 3 | 4 | 5 | 6 |
Примечание. * - в том числе ЛК50 (ЭК50) за 24-96 ч
14. Пороговая концентрация по органолептическому признаку вредности.
15. Специфика действия вещества (например, изменение цвета организмов, оболочки икры некоторыми красителями).
16. Наличие следующих эффектов: тератогенез, мутагенез, эмбриотоксичность, гонадотоксичность, с указанием тест-организма и концентрации.
17. Результаты теста на гено-, цитотоксичность.
18. Класс опасности.
19. Лимитирующий показатель вредности.
20. Рекомендуемая ПДК вещества в мг/л или временного норматива ПДК вещества в мг/л.
Подпись руководителя работ
Дата заполнения
Обзор документа
Подготовлен проект методических указаний по разработке нормативов качества воды водных объектов рыбохозяйственного значения.
Данные нормативы планируется определять в соответствии с физическими, химическими, биологическими и иными показателями для оценки состояния среды обитания водных биоресурсов в целях сохранения последних и обеспечения безопасности продукции из них.
Показатели состава и свойств естественного природного состояния воды поверхностных водных объектов определяются показателями, соответствующими природным условиям, не затронутым антропогенным воздействием.
Нормативы устанавливаются на взвешенные вещества, плавающие примеси (вещества), окраску, запахи и привкусы, температуру, водородный показатель, минерализацию воды, растворенный кислород, биохимическое потребление кислорода, химические вещества, токсичность воды.
Нормативы ПДК являются показателями предельно допустимого содержания химических веществ и микроорганизмов в среде обитания водных биоресурсов, несоблюдение которых может привести к деградации и гибели водных биоресурсов.



(1).jpg)


