Проект Приказа Министерства здравоохранения РФ "Об утверждении Административного регламента Министерства здравоохранения Российской Федерации по предоставлению государственной услуги по аккредитации медицинских организаций на право проведения клинических исследований лекарственных препаратов для медицинского применения" (подготовлен Минздравом России 22.03.2017)
Досье на проект
Пояснительная записка
В соответствии с Федеральным законом от 27 июля 2010 г. N 210-ФЗ "Об организации предоставления государственных и муниципальных услуг" (Собрание законодательства Российской Федерации, 2010, N 31, ст. 4179; 2011, N 15, ст. 2038; N 27, ст. 3880; N 29, ст. 4291; N 30, ст. 4587; N 49, ст. 7061; 2012; N 31, ст. 4322; 2013, N 14, ст. 1651; N 27, ст. 3480; N 30, ст. 4084; N 51, ст. 6679; N 52, ст. 6952, ст. 6961, ст. 7009; 2014; N 26, ст. 3366; N 30, ст. 4264; N 1, ст. 67; N 1, ст. 72; 2015; N 10, ст. 1393; N 29, ст. 4342), ст. 4376; 2016, N 7, N 10, ст. 916; N 27, ст. 4293, ст. 4294; 2017, N 1, ст. 12), Федеральным законом от 12 апреля 2010 г. N 61-ФЗ "Об обращении лекарственных средств" (Собрание законодательства Российской Федерации, 2010, N 16, ст. 1815; N 31, ст. 4161; N 42, ст. 5293; N 49, ст. 6409; 2011, N 50, ст. 7351; 2012, N 26, ст. 3446; N 53, ст. 7587; 2013, N 27, ст. 3477; N 48, ст. 6165; 2014, N 11, ст. 1098; N 43, ст. 5797; N 52, ст. 7540; 2015, N 10, ст. 1404; N 27, ст. 3951; N 29, ст. 4359; N 29, ст. 4367); N 29, ст. 4388; N 51, ст. 7245; 2016, N 1, ст. 9; N 23, ст. 3287; N 27, ст. 4238; N 27, ст. 4283), постановлением Правительства Российской Федерации от 16 мая 2011 г. N 373 "О разработке и утверждении административных регламентов исполнения государственных функций и административных регламентов предоставления государственных услуг" (Собрание законодательства Российской Федерации, 2011, N 22, ст. 3169; N 35, ст. 5092; 2012, N 28, ст. 3908; N 36, ст. 4903; N 50, ст. 7070; N 52, ст. 7507; 2014, N 5, ст. 506) приказываю:
1. Утвердить прилагаемый Административный регламент Министерства здравоохранения Российской Федерации по предоставлению государственной услуги по аккредитации медицинских организаций на право проведения клинических исследований лекарственных препаратов для медицинского применения.
2. Признать утратившим силу:
приказ Министерства здравоохранения и социального развития Российской Федерации от 03.12.2010 N 1073н "Об утверждении формы заявления о предоставлении свидетельства об аккредитации медицинской организации на право проведения клинических исследований лекарственных препаратов для медицинского применения" (зарегистрирован Министерством юстиции Российской Федерации 28 декабря 2012 г., регистрационный N 19412).
| Министр | В.И. Скворцова |
УТВЕРЖДЕН
приказом Министерства здравоохранения Российской Федерации
от "__" _________ 201_ г. N ___
Административный регламент
Министерства здравоохранения Российской Федерации по предоставлению государственной услуги по аккредитации медицинских организаций на право проведения клинических исследований лекарственных препаратов для медицинского применения
I. Общие положения
Предмет регулирования Административного регламента
1. Административный регламент Министерства здравоохранения Российской Федерации по предоставлению государственной услуги по аккредитации медицинских организаций на право проведения клинических исследований лекарственных препаратов для медицинского применения (далее - Административный регламент) разработан в целях повышения качества и доступности предоставления указанной государственной услуги, определяет порядок и стандарт предоставления государственной услуги по аккредитации медицинских организаций на право проведения клинических исследований лекарственных препаратов для медицинского применения Министерством здравоохранения (далее - Министерство).
2. Государственная услуга по аккредитации медицинских организаций на право проведения клинических исследований лекарственных препаратов для медицинского применения (далее - государственная услуга) осуществляется в целях признания компетентности медицинской организации для проведения клинических исследований лекарственных препаратов для медицинского применения по определенному профилю медицинской деятельности, осуществляемому медицинской организацией.
3. Аккредитация медицинских организаций на право проведения клинических исследований лекарственных препаратов для медицинского применения (далее - аккредитация) проводится как в отношении всех, так и в отношении одной из следующих целей:
1) установление безопасности лекарственных препаратов для здоровых добровольцев и (или) переносимости их здоровыми добровольцами;
2) подбор оптимальных дозировок лекарственного препарата и курса лечения для пациентов с определенным заболеванием, оптимальных доз и схем вакцинации иммунобиологическими лекарственными препаратами здоровых добровольцев;
3) установление безопасности лекарственного препарата и его эффективности для пациентов с определенным заболеванием, профилактической эффективности иммунобиологических лекарственных препаратов для здоровых добровольцев;
4) изучение возможности расширения показаний для медицинского применения и выявления ранее неизвестных побочных действий зарегистрированных лекарственных препаратов.
Круг заявителей
4. Заявителями на предоставление государственной услуги являются медицинские организации, претендующие на право проведения клинических исследований лекарственных препаратов для медицинского применения, или аккредитованные на право проведения клинических исследований лекарственных препаратов для медицинского применения (далее соответственно - заявители, медицинские организации);
5. Требованиями по аккредитации на право проведения клинических исследований лекарственных препаратов для медицинского применения (далее - требования по аккредитации), которым должна соответствовать медицинская организация, являются:
1) наличие лицензии на осуществление медицинской деятельности, а также в случае проведения клинических исследований лекарственных препаратов, содержащих наркотические средства, психотропные вещества и их прекурсоры, - лицензии на осуществление деятельности, связанной с оборотом наркотических средств, психотропных веществ и их прекурсоров, культивированием наркосодержащих растений;
2) наличие отделения (палаты) интенсивной терапии и реанимации в случае проведения клинических исследований лекарственных препаратов для установления их безопасности для здоровых добровольцев и (или) переносимости их здоровыми добровольцами;
3) наличие копий нормативных правовых актов, регламентирующих вопросы организации и проведения клинических исследований лекарственных препаратов для медицинского применения;
4) соблюдение правил клинической практики, утверждаемых в установленном порядке;
5) обеспечение защиты конфиденциальной информации.
Требования к порядку информирования о предоставлении государственной услуги
6. Информирование о порядке предоставления государственной услуги осуществляется Министерством:
1) посредством размещения информации, в том числе о графике приема заявителей и номерах телефонов для справок (консультаций), на официальном сайте Министерства в сети Интернет: www.rosminzdrav.ru;
2) на Едином портале государственных и муниципальных услуг (функций): www.gosuslugi.ru;
3) по номерам телефонов для справок;
4) в средствах массовой информации.
7. Информирование о порядке предоставления государственной услуги производится Министерством по адресу:
127994, Москва, Рахмановский пер., д. 3.
Время работы: в будние дни с 9-00 часов до 18-00 часов (пятница с 9-00 часов до 16 часов 45 минут). Обеденный перерыв с 12-00 часов до 12 часов 45 минут.
Телефоны для справок: +7 (495) 627 24 59, +7 (495) 627 28 41.
Телефон отдела клинических исследований лекарственных препаратов Департамента государственного регулирования обращения лекарственных средств: +7 (495) 627 24 00, доб. 2010, 2011, 2012, 2013.
8. Заявление с приложением документов в электронной форме может быть направлено через официальный сайт Министерства в сети Интернет: www.rosminzdrav.ru, через портал по ведению государственного реестра лекарственных средств: http:grls.rosminzdrav.ru или через Единый портал государственных и муниципальных услуг (функций): www.gosuslugi.ru.
Формы заявлений и документов, оформляемых непосредственно заявителями и представляемых в Министерство для получения государственной услуги в электронном виде, должны быть доступны для копирования и заполнения в электронном виде на официальном сайте Министерства в сети Интернет: www.rosminzdrav.ru, Едином портале государственных и муниципальных услуг (функций): www.gosuslugi.ru.
9. Использование электронной цифровой подписи при подаче в Министерство заявления и прилагаемых к нему электронных документов осуществляется с момента создания соответствующей информационной и телекоммуникационной структуры.
10. На информационных стендах Министерства и на официальном сайте Министерства в сети Интернет: www.rosminzdrav.ru размещаются следующие информационные материалы:
1) информация о порядке предоставления государственной услуги, в том числе информация о месте приема заявителей и установленных для приема заявителей днях и часах;
2) перечень нормативных правовых актов, регламентирующих предоставление государственной услуги.
11. Перечень медицинских организаций, аккредитованных на право проведения клинических исследований лекарственных препаратов для медицинского применения, размещается на официальном сайте Министерства в сети Интернет: www.rosminzdrav.ru.
12. Информация, необходимая для заполнения реквизитов распоряжения о переводе денежных средств для оплаты государственной пошлины, предусмотренная правилами указания информации в реквизитах распоряжений о переводе денежных средств в уплату платежей в бюджетную систему Российской Федерации, утвержденными приказом Министерства финансов Российской Федерации.
II. Стандарт предоставления государственной услуги
Наименование государственной услуги
13. Наименование государственной услуги - государственная услуга по аккредитации медицинских организаций на право проведения клинических исследований лекарственных препаратов для медицинского применения.
Наименование федерального органа исполнительной власти, предоставляющего государственную услугу
14. Государственная услуга предоставляется Министерством.
При предоставлении государственной услуги Министерство взаимодействует с:
1) Федеральной налоговой службой (ФНС России);
2) Федеральной службой по надзору в сфере здравоохранения (Росздравнадзор);
3) Федеральным казначейством.
Запрещается требовать от заявителя осуществления действий, в том числе согласований, необходимых для получения государственной услуги и связанных с обращением в иные государственные органы и организации, за исключением получения услуг, включенных в перечень услуг, которые являются необходимыми и обязательными для предоставления государственных услуг, утвержденный Правительством Российской Федерации.
Описание результата предоставления государственной услуги
15. Результатами предоставления государственной услуги являются:
1) направление (вручение) заявителю копии приказа об аккредитации медицинской организации на право проведения клинических исследований лекарственных препаратов для медицинского применения и свидетельства об аккредитации на право проведения клинических исследований лекарственных препаратов для медицинского применения;
2) направление (вручение) заявителю копии приказа об отказе в аккредитации медицинской организации на право проведения клинических исследований лекарственных препаратов для медицинского применения с мотивированным обоснованием;
3) направление (вручение) заявителю дубликата свидетельства об аккредитации на право проведения клинических исследований лекарственных препаратов для медицинского применения;
4) направление (вручение) заявителю копии решения об отказе в выдаче дубликата свидетельства об аккредитации на право проведения клинических исследований лекарственных препаратов для медицинского применения;
5) направление (вручение) заявителю копии решения о продлении срока действия свидетельства об аккредитации на право проведения клинических исследований лекарственных препаратов для медицинского применения, а также свидетельства об аккредитации на право проведения клинических исследований лекарственных препаратов для медицинского применения с соответствующей отметкой о продлении срока;
6) направление (вручение) заявителю копии решения об отказе в продлении срока действия свидетельства об аккредитации на право проведения клинических исследований лекарственных препаратов для медицинского применения;
7) направление (вручение) заявителю копии решения о переоформлении свидетельства об аккредитации на право проведения клинических исследований лекарственных препаратов для медицинского применения и переоформленного свидетельства об аккредитации на право проведения клинических исследований лекарственных препаратов для медицинского применения;
8) направление (вручение) заявителю копии решения об отказе в переоформлении свидетельства об аккредитации на право проведения клинических исследований лекарственных препаратов для медицинского применения;
9) вручение (направление) заявителю копии решения о приостановлении (возобновлении) действия свидетельства об аккредитации на право проведения клинических исследований лекарственных препаратов для медицинского применения;
10) вручение (направление) заявителю копии решения об аннулировании свидетельства об аккредитации на право проведения клинических исследований лекарственных препаратов для медицинского применения;
11) вручение (направление) заявителю копии решения о прекращении действия свидетельства об аккредитации на право проведения клинических исследований лекарственных препаратов для медицинского применения.
Срок предоставления государственной услуги
16. Сроки предоставления государственной услуги:
1) рассмотрение заявления и комплекта документов, принятие решения об аккредитации (отказе в аккредитации) медицинской организации на право проведения клинических исследований лекарственных препаратов для медицинского применения - 30 рабочих дней с даты поступления в Министерство заявления и комплекта документов от заявителя;
2) рассмотрение заявления и выдача заявителю дубликата свидетельства об аккредитации на право проведения клинических исследований лекарственных препаратов для медицинского применения - 10 рабочих дней с даты поступления в Министерство соответствующего заявления;
3) рассмотрение заявления о продлении срока действия свидетельства об аккредитации на право проведения клинических исследований лекарственных препаратов для медицинского применения, принятие решения о продлении (об отказе в продлении) срока действия свидетельства об аккредитации на право проведения клинических исследований лекарственных препаратов для медицинского применения - 15 рабочих дней с даты получения Министерством соответствующего заявления;
4) рассмотрение заявления о переоформлении свидетельства об аккредитации на право проведения клинических исследований лекарственных препаратов для медицинского применения и документов, принятие решения о переоформлении (об отказе в переоформлении) свидетельства об аккредитации медицинской организации на право проведения клинических исследований лекарственных препаратов для медицинского применения - 10 рабочих дней с даты получения Министерством соответствующего заявления и документов;
5) принятие решения о приостановлении (возобновлении) действия свидетельства об аккредитации на право проведения клинических исследований лекарственных препаратов для медицинского применения - 10 рабочих дней со дня регистрации в Министерстве документов, подтверждающих нарушение медицинской организацией требований по аккредитации или устранение нарушений требований по аккредитации;
6) принятие решения об аннулировании свидетельства об аккредитации на право проведения клинических исследований лекарственных препаратов для медицинского применения - 10 рабочих дней со дня получения Министерством документов, подтверждающих сведения, указанные в пункте 72 Административного регламента;
7) принятие решения о прекращении действия свидетельства об аккредитации на право проведения клинических исследований лекарственных препаратов для медицинского применения - 10 рабочих дней со дня получения Министерством документов, подтверждающих сведения, указанные в пункте 75 Административного регламента.
Перечень нормативных правовых актов, регулирующих отношения, возникающие в связи с предоставлением государственной услуги
17. Предоставление государственной услуги осуществляется в соответствии с:
1) Федеральный закон от 27 июля 2010 г. N 210-ФЗ "Об организации предоставления государственных и муниципальных услуг" (Собрание законодательства Российской Федерации, 2010, N 31, ст. 4179; 2011, N 15, ст. 2038; N 27, ст. 3880; N 29, ст. 4291; N 30, ст. 4587; N 49, ст. 7061; 2012; N 31, ст. 4322; 2013, N 14, ст. 1651; N 27, ст. 3480; N 30, ст. 4084; N 51, ст. 6679; N 52, ст. 6952, ст. 6961, ст. 7009; 2014; N 26, ст. 3366; N 30, ст. 4264; N 1, ст. 67; N 1 (часть I), ст. 72; 2015; N 10, ст. 1393; N 29, ст. 4342), ст. 4376; 2016, N 10, ст. 916; N 27, ст. 4293);
2) Федеральный закон от 12 апреля 2010 г. N 61-ФЗ "Об обращении лекарственных средств" (Собрание законодательства Российской Федерации, 2010, N 16, ст. 1815; N 31, ст. 4161; N 42, ст. 5293; N 49, ст. 6409; 2011, N 50, ст. 7351; 2012, N 26, ст. 3446; N 53, ст. 7587; 2013, N 27, ст. 3477; N 48, ст. 6165; 2014, N 11, ст. 1098; N 43, ст. 5797; N 52 (часть I), ст. 7540; 2015, N 10, ст. 1404; N 27, ст. 3951; N 29 (часть I), ст. 4359; N 29 (часть I), ст. 4367); N 29 (часть I), ст. 4388; N 51 (часть III), ст. 7245; 2016, N 1 (часть I), ст. 9; N 23, ст. 3287; N 27, ст. 4238, ст. 4283);
3) Налоговый кодекс Российской Федерации (часть вторая) от 5 августа 2000 г. N 117-ФЗ (Собрание законодательства Российской Федерации, 2000, N 32, ст. 3340, 3341; 2001, N 1, ст. 18; N 23, ст. 2289; N 33, ст. 3413, ст. 3421, 3429; N 49, ст. 4554, ст. 4564; N 53, ст. 5015, ст. 5023; 2002, N 1, ст. 4; N 22, ст. 2026; N 30, ст. 3021, ст. 3027, ст. 3033; N 52, ст. 5132, ст. 5138; 2003, N 1, ст. 2, ст. 6, ст. 8; N 19, ст. 1749; N 21, ст. 1958; N 23, ст. 2174; N 26, ст. 2567; N 27, ст. 2700; N 28, ст. 2874, ст. 2879, ст. 2886; N 46, ст. 4435, 4443, 4444, N 50, ст. 4849; N 52, ст. 5030, ст. 5038; 2004, N 15, ст. 1342; N 27, ст. 2711, ст. 2713, ст. 2715; N 30, ст. 3083, ст. 3084, ст. 3088; N 31, ст. 3219, ст. 3220, ст. 3222, ст. 3231; N 34, ст. 3517, ст. 3518, ст. 3520, ст. 3522, ст. 3523, ст. 3524, ст. 3525, ст. 3527; N 35, ст. 3607; N 41, ст. 3994; N 45, ст. 4377; N 49, ст. 4840; 2005, N 1, ст. 9, ст. 29, ст. 30, ст. 34, ст. 38; N 21, ст. 1918; N 23, ст. 2201; N 24, ст. 2312; N 25, ст. 2427, ст. 2428, ст. 2429; N 27, ст. 2707, ст. 2710, ст. 2717; N 30, ст. 3101, ст. 3104, ст. 3112, ст. 3117, ст. 3118, ст. 3128, ст. 3129, ст. 3130; N 43, ст. 4350; N 50, ст. 5246; N 52, ст. 5581; 2006, N 1, ст. 12, ст. 16, N 3, ст. 280; N 10, ст. 1065; N 12, ст. 1233; N 23, ст. 2380, ст. 2382; N 27, ст. 2881; N 30, ст. 3295; N 31, ст. 3433, ст. 3436, ст. 3443, ст. 3450, ст. 3452; N 43, ст. 4412; N 45, ст. 4627, ст. 4628, ст. 4629, ст. 4630; N 47, ст. 4819; N 50, ст. 5279, ст. 5286; N 52, ст. 5498; 2007, N 1, ст. 7, ст. 20, ст. 31, ст. 39; N 13, ст. 1465; N 21, ст. 2461, ст. 2462, ст. 2463; N 22, ст. 2563, ст. 2564; N 23, ст. 2691; N 31, ст. 3991, ст. 3995, ст. 4013; N 45, ст. 5416, ст. 5417, ст. 5432; N 46, ст. 5553, ст. 5554, ст. 5557; N 49, ст. 6045, ст. 6046, ст. 6071; N 50, ст. 6237, ст. 6245, ст. 6246; 2008, N 18, ст. 1942; N 26, ст. 3022; N 27, ст. 3126; N 30, ст. 3577, ст. 3591, ст. 3598, ст. 3611, ст. 3614, ст. 3616; N 42, ст. 4697; N 48, ст. 5500, ст. 5503, ст. 5504, ст. 5519; N 49, ст. 5723, 5749; N 52, ст. 6218, ст. 6219, ст. 6227, ст. 6236, ст. 6237; 2009, N 1, ст. 13, ст. 19, ст. 21, ст. 22, ст. 31; N 11, ст. 1265; N 18, ст. 2147; N 23, ст. 2772, ст. 2775; N 26, ст. 3123; N 29, ст. 3582, ст. 3598, ст. 3602, ст. 3625, ст. 3638, ст. 3639, ст. 3641, ст. 3642; N 30, ст. 3735, ст. 3739; N 39, ст. 4534; N 44, ст. 5171; N 45, ст. 5271; N 48, ст. 5711, ст. 5725, ст. 5726, ст. 5731, ст. 5732, ст. 5733, ст. 5734, ст. 5737, N 51, ст. 6153, ст. 6155; N 52, ст. 6444, ст. 6450, ст. 6455; 2010, N 15, ст. 1737, ст. 1746; N 18, ст. 2145; N 19, ст. 2291; N 21, ст. 2524; N 23, ст. 2797; N 25, ст. 3070; N 28, ст. 3553; N 31, ст. 4176, ст. 4186, ст. 4198; N 32, ст. 4298; N 40, ст. 4969; N 45, ст. 5750, ст. 5756; N 46, ст. 5918; N 47, ст. 6034; N 48, ст. 6247, ст. 6248, ст. 6249, ст. 6250, ст. 6251; N 49, ст. 6409; 2011, N 1, ст. 7, ст. 9, ст. 21, ст. 37; N 11, ст. 1492, ст. 1494; N 17, ст. 2311, ст. 2318; N 23, ст. 3262, ст. 3265; N 24, ст. 3357, N 26, ст. 3652, N 27, ст. 3881, N 29, ст. 4291, N 30, ст. 4563, ст. 4566, ст. 4575, ст. 4583, ст. 4587, ст. 4593, ст. 4596, ст. 4597, ст. 4606; N 45, ст. 6335; N 47, ст. 6608, ст. 6609, ст. 6610, ст. 6611; N 48, ст. 6729, ст. 6731; N 49, ст. 7014, ст. 7015, ст. 7016, ст. 7017, ст. 7037, ст. 7043, ст. 7061, ст. 7063; N 50, ст. 7347; 2012, N 14, ст. 1545; N 18, ст. 2128; N 19, ст. 2281; N 24, ст. 3066; N 26, ст. 3447; N 27, ст. 3587, ст. 3588; N 29, ст. 3980; N 31, ст. 4319, N 41, ст. 5527; N 49, ст. 6747, ст. 6748, ст. 6749, ст. 6750, ст. 6751; N 50, ст. 6958, ст. 6968; N 53, ст. 7584, ст. 7596, ст. 7603, ст. 7604, ст. 7607, ст. 7619; 2013, N 9, ст. 874; N 14, ст. 1647; N 19, ст. 2321; N 23, ст. 2866, ст. 2888, ст. 2889; N 26, ст. 3207; N 27, ст. 3444; N 30, ст. 4031, ст. 4045, ст. 4046, ст. 4047, ст. 4048, ст. 4049, ст. 4081, ст. 4084, N 40, ст. 5033, ст. 5037, ст. 5038, ст. 5039; N 44, ст. 5640, ст. 5645, ст. 5646; N 48, ст. 6165; N 49, ст. 6335; N 52, ст. 6981, ст. 6985; 2014, N 14, ст. 1544; N 16, ст. 1835, ст. 1838; N 19, ст. 2313, ст. 2314; N 23, ст. 2936, ст. 2938; N 26, ст. 3372, ст. 3373, ст. 3393, ст. 3404, N 30 (часть I), ст. 4222, ст. 4239, (часть I), ст. 4240, (часть I), ст. 4245; N 40, ст. 5315, ст. 5316; N 43, ст. 5796, ст. 5799; N 45, ст. 6157, ст. 6159; N 48, ст. 6647, ст. 6648, ст. 6649, ст. 6650, ст. 6657, ст. 6660, ст. 6661, ст. 6662, ст. 6663; 2015, N 1 (часть I), ст. 5, ст. 15, ст. 16, ст. 17, ст. 18, ст. 30, ст. 32, ст. 33; N 10, ст. 1393, ст. 1402; N 14, ст. 2023; N 24, ст. 3373, ст. 3377; N 27, ст. 3948, ст. 3968, ст. 3969); N 29, ст. 4340, ст. 4358; N 41 (часть II), ст. 5632; N 48, ст. 6683, ст. 6684, ст. 6685, ст. 6686, ст. 6687, ст. 6688, ст. 6689, ст. 6691, ст. 6692, ст. 6693, ст. 6694; 2016, N 1, ст. 6, ст. 16, ст. 17, 18; N 6, ст. 763; N 7, ст. 907, ст. 920; N 9, ст. 1169; N 10, ст. 1322; N11, ст. 1480, ст. 1489; N14, ст. 1902; N 15, ст. 2059; N15, ст. 2061, ст. 2063, ст. 2064; N 22, ст. 3092, ст. 3098; N 27, ст. 4158, ст. 4161, ст. 4175, ст. 4178, ст. 4179, ст. 4180, ст. 4182);
4) Федеральный закон от 6 апреля 2011 N 63-ФЗ "Об электронной подписи" (Собрание законодательства Российской Федерации, 2011, N 15, ст. 2036; N 27, ст. 3880; 2012; N 29, ст. 3988; 2013, N 14, ст. 1668; N 27, ст. 3463, ст. 3477; 2014, N 11, ст. 1098; N 26, ст. 3390); 2016, N 1, ст. 65);
5) постановлением Правительства Российской Федерации от 3 сентября 2010 г. N 683 "Об утверждении Правил аккредитации медицинских организаций на право проведения клинических исследований лекарственных препаратов для медицинского применения" (Собрание законодательства Российской Федерации, 2010, N 37, ст. 4697; 2011, N 50, ст.7390; 2012, N 37, ст. 5002);
6) постановление Правительства Российской Федерации от 19 июня 2012 г. N 608 "Об утверждении Положения о Министерстве здравоохранения Российской Федерации" (Собрание законодательства Российской Федерации, 2012, N 26, ст. 3526; 2013, N 16, ст. 1970; N 20, ст. 2477; N 33, ст. 4386; N 45, ст. 5822; 2014, N 12, ст. 1296; N 26, ст. 3577; N 30, ст. 4307; N 37, ст. 4969; 2015, ст. 491; N 12, ст. 1763; N 23, ст. 3333); 2016, N 2, ст. 325; N 9, ст. 1268; N 27, ст. 4497; N 28, ст. 4741; N 34, ст. 5255, N 49, ст. 6922);
7) постановлением Правительства Российской Федерации от 8 сентября 2010 г. N 697 "О единой системе межведомственного электронного взаимодействия" (Собрание законодательства Российской Федерации, 2010, N 38, ст. 4823; 2011, N 24, ст. 3503; N 49, ст. 7284, N 45, ст. 5827; 2014, N 12, ст. 1303; N 42, ст. 5746; N 48, ст. 6862; N 48, ст. 6876; N 50, ст. 7113; 2016, N 34, ст. 5243);
8) постановлением Правительства Российской Федерации от 20 августа 2009 г. N 689 "Об утверждении Правил аккредитации граждан и организаций, привлекаемых органами государственного контроля (надзора) и органами муниципального контроля к проведению мероприятий по контролю" (Собрание законодательства Российской Федерации, 2009, N 35, ст. 4241; 2012, N 52, ст. 7484);
8) Постановление Правительства Российской Федерации от 20.11.2012 N 1198 "О федеральной государственной информационной системе, обеспечивающей процесс досудебного (внесудебного) обжалования решений и действий (бездействия), совершенных при предоставлении государственных и муниципальных услуг" (Собрание законодательства Российской Федерации, 2012, N 48, ст. 6706; 2013, N 52, ст. 7218; 2015, N2 ст. 518);
9) приказ Минздрава России от 01.04.2016 N 200н "Об утверждении правил надлежащей клинической практики" (зарегистрирован Министерством юстиции Российской Федерации от 23.08.2016 N 43357);
10) приказ Минфина России от 12 ноября 2013 N 107н "Об утверждении Правил указания информации в реквизитах распоряжений о переводе денежных средств в уплату платежей в бюджетную систему Российской Федерации" (зарегистрирован Минюстом России 30 декабря 2013 г., регистрационный N 30913 с поправками, внесенными приказом Минфина России от 30 октября 2014 N 126н и приказом Минфина России от 23 сентября 2015 N 148н).
Исчерпывающий перечень документов, необходимых в соответствии с нормативными правовыми актами для предоставления государственной услуги, которые являются необходимыми и обязательными для предоставления государственной услуги, подлежащих представлению заявителем
18. Для получения заявителем аккредитации на право проведения клинических исследований лекарственных препаратов для медицинского применения необходимы следующие документы, представляемые на бумажном носителе или в форме электронного документа:
а) заявление о предоставлении свидетельства об аккредитации на право проведения клинических исследований лекарственных препаратов для медицинского применения по форме, предусмотренной приложением N 4 к настоящему Административному регламенту;
б) копии учредительных документов;
в) выписка из Единого государственного реестра юридических лиц;
г) копия лицензии на осуществление медицинской деятельности;
д) копия лицензии на осуществление деятельности, связанной с оборотом наркотических средств и психотропных веществ (в случае проведения клинических исследований лекарственных препаратов, содержащих наркотические средства и психотропные вещества);
е) копии документов, подтверждающих наличие у заявителя отделения (палаты) интенсивной терапии и реанимации (в случае проведения клинических исследований лекарственных препаратов для установления их безопасности для здоровых добровольцев и (или) переносимости их здоровыми добровольцами);
ж) копия утвержденного руководителем медицинской организации документа, устанавливающего порядок работы с конфиденциальной информацией;
з) копия документа, подтверждающего уплату государственной пошлины за выдачу документа об аккредитации (государственной аккредитации) организаций. В случае непредставления заявителем указанных документов уполномоченный федеральный орган исполнительной власти проверяет факт уплаты государственной пошлины с использованием информации об уплате государственной пошлины, содержащейся в Государственной информационной системе о государственных и муниципальных платежах, на основании представленных заявителем копий документов.
19. Для продления срока действия свидетельства об аккредитации на право проведения клинических исследований лекарственных препаратов для медицинского применения (далее - свидетельство об аккредитации) представляются:
заявление о продлении срока действия свидетельства об аккредитации по форме, предусмотренной приложением N 5 к Административному регламенту;
действующее свидетельство об аккредитации.
20. Для получения медицинской организацией дубликата свидетельства об аккредитации необходимо заявление о предоставлении дубликата свидетельства об аккредитации по форме, предусмотренной приложением N 6 к Административному регламенту.
21. Для переоформления свидетельства об аккредитации представляется заявление о переоформлении свидетельства об аккредитации по форме, предусмотренной приложением N 7 к Административному регламенту.
Исчерпывающий перечень документов, необходимых в соответствии с нормативными правовыми актами для предоставления государственной услуги, которые находятся в распоряжении государственных органов, участвующих в предоставлении государственной услуги
22. При предоставлении государственной услуги Министерство не вправе требовать от заявителя представления документов, содержащих сведения, находящиеся в распоряжении:
1) ФНС России - сведения о медицинской организации, содержащиеся в Едином государственном реестре юридических лиц (выписки из Единого государственного реестра юридических лиц);
2) Росздравнадзора - сведения о наличии по данным единого реестра лицензий, в том числе лицензий, выданных органами государственной власти субъектов Российской Федерации в соответствии с переданным полномочием по лицензированию отдельных видов деятельности:
лицензии на осуществление медицинской деятельности;
лицензии на осуществление деятельности, связанной с оборотом наркотических средств, психотропных веществ и их прекурсоров, культивированию наркосодержащих растений (в случае проведения клинических исследований лекарственных препаратов, содержащих наркотические средства, психотропные вещества и их прекурсоры);
3) Для предоставления государственной услуги необходима уплата государственной пошлины в соответствии с законодательством Российской Федерации о налогах и сборах, сведения об уплате которой находятся в распоряжении Федерального Казначейства.*(1)
Заявитель вправе представить сведения (документы) об уплате государственной пошлины по собственной инициативе. В случае непредставления таких сведений (документов) по инициативе заявителя Министерство получает сведения об уплате государственной пошлины за предоставление государственной услуги в порядке в Государственной информационной системе о государственных и муниципальных платежах, на основании представленных заявителем копий документов.
23. Министерство не вправе требовать от заявителя представления документов и информации или осуществления действий, представление или осуществление которых не предусмотрено нормативными правовыми актами, регулирующими отношения, возникающие в связи с предоставлением государственной услуги.
Заявитель вправе представить документы и информацию, предусмотренные пунктом 22 Административного регламента по собственной инициативе.
Исчерпывающий перечень оснований для отказа в приеме документов, необходимых для предоставления государственной услуги
24. Оснований для отказа в приеме документов, необходимых для предоставления государственной услуги, не предусмотрено.
Исчерпывающий перечень оснований для отказа в предоставлении государственной услуги
25. Основаниями для отказа в предоставлении государственной услуги являются:
1) несоответствие заявителя требованиям по аккредитации, предусмотренным пунктом 5 Административного регламента;
2) представление не всех документов, предусмотренных пунктом 18 Административного регламента;
3) наличие в документах, представленных в соответствии с пунктом 18 Административного регламента, недостоверной информации;
4) предоставление заявлений по формам, не соответствующим формам, предусмотренным приложениями N 4-7 к Административному регламенту.
5) установление в порядке межведомственного информационного взаимодействия несоответствия заявителя сведений, содержащимся в пункте 22 Административного регламента.
Порядок, размер, и основание взимания государственной пошлины за предоставление государственной услуги
26. За предоставление свидетельства об аккредитации и дубликата свидетельства об аккредитации заявителем уплачивается государственная пошлина в размерах, установленных статьей 333.33 Налогового Кодекса Российской Федерации.
Максимальный срок ожидания в очереди при подаче запроса о предоставлении государственной услуги и при получении результата государственной услуги
27. Максимальный срок ожидания в очереди при подаче документов на предоставление государственной услуги, а также при получении документов, связанных с предоставлением государственной услуги, не должен превышать 15 минут.
Срок и порядок регистрации запроса заявителя о предоставлении государственной услуги, в том числе в форме электронного документа
28. Документы, поступившие от заявителей в Министерство (в том числе представленные в форме электронного документа) для получения государственной услуги, регистрируются в Департаменте управления делами Министерства в течение 1 рабочего дня с даты их поступления.
Требования к помещениям, в которых предоставляется государственная услуга
29. Помещение, в котором предоставляется государственная услуга, обеспечивается необходимыми для предоставления государственной услуги оборудованием, канцелярскими принадлежностями, офисной мебелью, системой кондиционирования воздуха, системой оповещения об очереди, телефоном, компьютером с возможностью печати и выхода в Интернет, доступом к гардеробу, а также печатными материалами, содержащими следующие документы (сведения):
1) нормативные правовые акты Российской Федерации, регулирующие порядок предоставления государственной услуги;
2) Административный регламент;
3) образцы оформления документов, которые представляются для получения государственной услуги;
4) сведения, содержащие информацию, предусмотренную правилами указания информации в реквизитах распоряжений о переводе денежных средств в уплату платежей в бюджетную систему Российской Федерации, утвержденными приказом Министерства финансов Российской Федерации.
Вход и передвижение по помещениям, в которых проводится прием документов, необходимых для предоставления государственной услуги, не должны создавать затруднений для лиц с ограниченными возможностями.
30. В соответствии с Федеральным законом от 24 ноября 1995 г. N 181-ФЗ "О социальной защите инвалидов в Российской Федерации" (Собрание законодательства Российской Федерации, 1995, N 48, ст. 4563; 2016, N 1, ст. 19) инвалидам обеспечиваются:
условия беспрепятственного доступа к объекту (зданию, помещению), в котором предоставляется государственная услуга, а также для беспрепятственного пользования транспортом, средствами связи и информации;
возможность самостоятельного передвижения по территории, на которой расположены объекты (здания, помещения), в которых предоставляется государственная услуга, а также входа в такие объекты и выхода из них, посадки в транспортное средство и высадки из него, в том числе с использованием кресла-коляски;
сопровождение инвалидов, имеющих стойкие расстройства функции зрения и самостоятельного передвижения;
надлежащее размещение оборудования и носителей информации, необходимых для обеспечения беспрепятственного доступа инвалидов к объектам (зданиям, помещениям), в которых предоставляется государственная услуга, с учетом ограничений их жизнедеятельности;
дублирование необходимой для инвалидов звуковой и зрительной информации, а также надписей, знаков и иной текстовой и графической информации знаками, выполненными рельефно-точечным шрифтом Брайля;
допуск сурдопереводчика и тифлосурдопереводчика;
допуск собаки-проводника на объекты (здания, помещения), в которых предоставляется государственная услуга;
оказание инвалидам помощи в преодолении барьеров, мешающих получению ими государственной услуги наравне с другими лицами.
31. В случае невозможности полностью приспособить объект с учетом потребностей инвалидов Минздрав России в соответствии со статьей 15 Федерального закона от 24 ноября 1995 г. N 181-ФЗ "О социальной защите инвалидов в Российской Федерации"*(2) должен принимать меры для обеспечения доступа инвалидов к месту предоставления услуги, либо когда это возможно, обеспечить ее предоставление по месту жительства инвалида или в дистанционном режиме".
Показатели доступности и качества государственной услуги, в том числе количество взаимодействий заявителя с должностными лицами при предоставлении государственной услуги и их продолжительность, возможность получения информации о ходе предоставления государственной услуги, в том числе с использованием информационно-коммуникационных технологий
32. Показателями доступности и качества предоставления государственной услуги являются:
1) открытый доступ для заявителей к информации о порядке и сроках предоставления государственной услуги, порядке обжалования действий (бездействия) должностных лиц Министерства;
2) соблюдение стандарта предоставления государственной услуги;
3) отсутствие жалоб заявителей на действия (бездействие) должностных лиц Министерства при предоставлении государственной услуги.
33. В процессе предоставления государственной услуги заявитель взаимодействует с должностными лицами Министерства:
1) при подаче документов, необходимых для получения государственной услуги (до 15 минут);
2) при получении копии приказа об аккредитации медицинской организации на право проведения клинических исследований лекарственных препаратов для медицинского применения и свидетельства об аккредитации (копии приказа об отказе в аккредитации медицинской организации на право проведения клинических исследований лекарственных препаратов для медицинского применения) (до 15 минут);
3) при получении дубликата свидетельства об аккредитации, копии решения об отказе в выдаче дубликата (до 15 минут);
4) при получении копии решения о продлении срока действия свидетельства об аккредитации и свидетельства об аккредитации с отметкой о продлении срока действия (копии решения об отказе в продлении срока действия свидетельства об аккредитации с мотивированным обоснованием) - до 15 минут;
5) при получении решения о переоформлении свидетельства об аккредитации и переоформленного свидетельства об аккредитации, копии решения об отказе в переоформлении свидетельства об аккредитации (до 15 минут);
6) при получении медицинской организацией копии решения о приостановлении (возобновлении) действия свидетельства об аккредитации (до 15 минут);
7) при получении медицинской организацией копии решения об аннулировании свидетельства об аккредитации (до 15 минут);
8) при получении медицинской организацией копии решения о прекращении свидетельства об аккредитации (до 15 минут);
34. Информацию о ходе предоставления государственной услуги заявитель получает посредством использования информационной системы Государственного реестра лекарственных средств.
III. Состав, последовательность и сроки выполнения административных процедур, требования к порядку их выполнения, в том числе особенности выполнения административных процедур в электронной форме
Перечень административных процедур
35. При предоставлении государственной услуги осуществляются следующие административные процедуры:
1) прием и регистрация заявления и документов, необходимых для предоставления государственной услуги;
2) рассмотрение заявления и комплекта документов, принятие решения об аккредитации (отказе в аккредитации) медицинской организации на право проведения клинических исследований лекарственных препаратов для медицинского применения;
3) формирование и направление межведомственных запросов в органы, участвующие в предоставлении государственной услуги;
4) рассмотрение заявления о выдаче дубликата свидетельства об аккредитации, принятие решения о выдаче (об отказе в выдаче) дубликата свидетельства об аккредитации;
5) рассмотрение заявления о продлении срока действия свидетельства об аккредитации, принятие решения о продлении (об отказе в продлении) срока действия свидетельства об аккредитации;
6) рассмотрение заявления о переоформлении свидетельства об аккредитации, принятие решения о переоформлении (об отказе в переоформлении) свидетельства об аккредитации;
7) приостановление (возобновление), прекращение действия свидетельства об аккредитации, аннулирование свидетельства об аккредитации;
Прием и регистрация заявления и документов, необходимых для предоставления государственной услуги
36. Административная процедура "Прием и регистрация заявления и документов, необходимых для предоставления государственной услуги" осуществляется в связи с поступлением в Министерство заявления и документов, предусмотренных пунктами 18 и 22 Административного регламента.
Заявление и документы, представленные (направленные) заявителем в Министерство в течение одного рабочего дня регистрируются в Департаменте управления делами и кадров Министерства и направляются в Департамент государственного регулирования обращения лекарственных средств Министерства, ответственный за предоставление государственной услуги (далее - Департамент).
37. В течение одного рабочего дня со дня поступления в Департамент заявления и документов из числа сотрудников Департамента назначается лицо, ответственное за предоставление государственной услуги (далее - ответственное лицо).
Фамилия, имя и отчество (последнее - при наличии) ответственного исполнителя, его место работы и номер телефона должны быть сообщены заявителю по его письменному или устному обращению.
Рассмотрение заявления и комплекта документов, принятие решения об аккредитации (отказе в аккредитации) медицинской организации на право проведения клинических исследований лекарственных препаратов для медицинского применения
38. Административная процедура "Рассмотрение заявления и комплекта документов, принятие решения об аккредитации (отказе в аккредитации) медицинской организации на право проведения клинических исследований лекарственных препаратов для медицинского применения" осуществляется в связи с поступлением в Министерство заявления о предоставлении свидетельства об аккредитации и комплекта документов, указанных в пункте 18 Административного регламента (далее - документы), в соответствии с блок-схемой исполнения административной процедуры согласно приложению N 1 к Административному регламенту.
39. Рассмотрение документов и принятие решения об аккредитации или об отказе в аккредитации осуществляется в срок, установленный подпунктом 1 пункта 15 Административного регламента.
Свидетельство об аккредитации выдается на 5 лет.
Срок действия свидетельства об аккредитации может быть сокращен по заявлению медицинской организации.
40. Ответственный исполнитель в течение 12 рабочих дней с даты своего назначения осуществляет проверку сведений, содержащихся в заявлении и комплекте документов, представленных заявителем, с целью определения:
1) наличия всего комплекта документов, определенных пунктом 18 Административного регламента;
2) согласованности предоставленной информации между отдельными документами комплекта;
3) достоверности информации, содержащейся в комплекте документов;
4) соответствия заявителя требованиям по аккредитации, перечисленным в пункте 5 Административного регламента.
41. Министерство при необходимости вправе организовать и провести выездную проверку медицинской организации, предметом которой является оценка возможности выполнения медицинской организацией требований по аккредитации, перечисленных в пункте 5 Административного регламента.
42. В случае положительных результатов проверки представленного заявителем заявления и комплекта документов ответственный исполнитель в течение 1 рабочего дня с даты окончания указанной проверки готовит проект решения об аккредитации.
При наличии одного из оснований, указанных в пункте 25 Административного регламента, ответственный исполнитель готовит проект решения об отказе в аккредитации с мотивированным обоснованием.
Проект решения об аккредитации или проект решения об отказе в аккредитации в течение 1 рабочего дня согласовывается и подписывается директором Департамента.
43. В течение 2 рабочих дней с даты подписания проекта решения об аккредитации ответственный исполнитель готовит проект приказа об аккредитации. В случае принятия решения об отказе в аккредитации ответственный исполнитель в течение 1 рабочего дня с даты подписания такого решения готовит проект приказа об отказе в аккредитации с мотивированным обоснованием.
Проект приказа об аккредитации или проект приказа об отказе в аккредитации в течение 2 рабочих дней согласовывается директором Департамента и заинтересованными департаментами Министерства.
По окончании согласования приказ об аккредитации либо приказ об отказе в аккредитации подписывается уполномоченным заместителем Министра здравоохранения Российской Федерации в течение 2 рабочих дней.
44. Ответственный исполнитель в течение 2 рабочих дней готовит свидетельство об аккредитации по форме, утвержденной постановлением Правительства Российской Федерации от 3 сентября 2010 г. N 683 "Об утверждении Правил аккредитации медицинских организаций на право проведения клинических исследований лекарственных препаратов для медицинского применения", которое оформляется на бланке, являющемся защищенной полиграфической продукцией со степенью защиты уровня "В" и подписывается уполномоченным заместителем Министра здравоохранения Российской Федерации в течение 2 рабочих дней.
45. В случае принятия решения об аккредитации ответственный исполнитель направляет (вручает) заявителю копию приказа об аккредитации и свидетельство об аккредитации в течение 1 рабочего дня с даты подписания свидетельства об аккредитации.
В случае принятия решения об отказе в аккредитации заявителю направляется (вручается) копия приказа об отказе в аккредитации с мотивированным обоснованием в течение 3 рабочих дней с даты его подписания.
46. Результатами административной процедуры являются:
1) направление (вручение) заявителю копии приказа об аккредитации и свидетельства об аккредитации по форме согласно приложению;
2) направление (вручение) заявителю копии приказа об отказе в аккредитации;
47. Выдача нового свидетельства об аккредитации медицинской организации, имеющей аккредитацию и претендующей на проведение клинических исследований лекарственных препаратов для медицинского применения, в целях, не заявленных при первоначальной аккредитации, осуществляется в соответствии с положениями пунктов 36-46 Административного регламента.
В случае принятия решения об аккредитации орган по аккредитации в течение 3 рабочих дней с даты принятия указанного решения направляет (вручает) заявителю копию приказа об аккредитации и свидетельство об аккредитации по форме согласно приложению.
Формирование и направление межведомственных запросов в органы, участвующие в предоставлении государственной услуги
48. Административная процедура "Формирование и направление межведомственных запросов в органы, участвующие в предоставлении государственной услуги" осуществляется в связи с непредставлением заявителем в инициативном порядке документов и информации, предусмотренной пунктом 22 Административного регламента.
49. Ответственный исполнитель в течение пяти рабочих дней с момента поступления заявления о предоставлении государственной услуги направляет в рамках межведомственного электронного взаимодействия запросы о предоставлении сведений в:
1) ФНС России - о медицинской организации, содержащиеся в Едином государственном реестре юридических лиц;
2) Росздравнадзор о наличии по данным единого реестра лицензий, в том числе лицензий, выданных органами государственной власти субъектов Российской Федерации в соответствии с переданным полномочием по лицензированию отдельных видов деятельности:
лицензии на осуществление медицинской деятельности;
лицензии на осуществление деятельности, связанной с оборотом наркотических средств, психотропных веществ и их прекурсоров, культивированию наркосодержащих растений (в случае проведения клинических исследований лекарственных препаратов, содержащих наркотические средства, психотропные вещества и их прекурсоры);
3) Федеральное казначейство - об уплате государственной пошлины за предоставление государственной услуги.
50. Результатом административной процедуры является получение Министерством посредством межведомственного информационного взаимодействия документов и информации, предусмотренной пунктом 49 Административного регламента
Рассмотрение заявления о выдаче дубликата свидетельства об аккредитации, принятие решения о выдаче (об отказе в выдаче) дубликата свидетельства об аккредитации
51. Административная процедура "Рассмотрение заявления о выдаче дубликата свидетельства об аккредитации, принятие решения о выдаче (об отказе в выдаче) дубликата свидетельства об аккредитации" осуществляется при поступлении в Министерство заявления о выдаче дубликата свидетельства об аккредитации по форме, предусмотренной приложением N 6 к Административному регламенту, с указанием обстоятельств, повлекших утрату или порчу свидетельства.
Рассмотрение заявления и выдача заявителю дубликата свидетельства об аккредитации осуществляется в срок, установленный подпунктом 2 пункта 16 Административного регламента.
Выдача дубликата свидетельства об аккредитации осуществляется по форме, установленной постановлением Правительства Российской Федерации от 3 сентября 2010 г. N 683 "Об утверждении правил аккредитации медицинских организаций на право проведения клинических исследований лекарственных препаратов для медицинского применения", с пометкой "дубликат".
Дубликат свидетельства об аккредитации выдается на срок, не превышающий срок действия утраченного (испорченного) свидетельства об аккредитации.
52. Ответственный исполнитель в течение 3 рабочих дней с даты своего назначения осуществляет проверку сведений, содержащихся в заявлении о выдаче дубликата свидетельства об аккредитации, с целью определения их достоверности.
В случае подтверждения сведений о наличии у медицинской организации аккредитации ответственный исполнитель в течение 2 рабочих дней готовит проект решения о выдаче дубликата свидетельства об аккредитации и дубликат свидетельства об аккредитации который оформляется на бланке, являющемся защищенной полиграфической продукцией со степенью защиты уровня "В".
В случае неподтверждения сведений о наличии у медицинской организации аккредитации ответственный исполнитель в течение 2 рабочих дней готовит проект решения об отказе в выдаче дубликата свидетельства об аккредитации.
53. Решение о выдаче (об отказе в выдаче) дубликата свидетельства об аккредитации в течение 1 рабочего дня согласовывается с начальником отдела и подписывается директором Департамента.
Дубликат свидетельства об аккредитации подписывается уполномоченным заместителем Министра здравоохранения Российской Федерации в течение 1 рабочего дня.
Ответственный исполнитель в течение 1 рабочего дня с даты подписания дубликата свидетельства об аккредитации, решения об отказе в выдаче дубликата свидетельства направляет (вручает) соответствующий документ заявителю.
54. Результатами административной процедуры являются:
1) направление (вручение) заявителю дубликата свидетельства об аккредитации;
2) направление (вручение) заявителю решения об отказе в выдаче дубликата свидетельства.
Рассмотрение заявления о продлении срока действия свидетельства об аккредитации, принятие решения о продлении (об отказе в продлении) срока действия свидетельства об аккредитации
55. Административная процедура "Рассмотрение заявления о продлении срока действия свидетельства об аккредитации, принятие решения о продлении (об отказе в продлении) срока действия свидетельства об аккредитации" осуществляется в соответствии с блок-схемой исполнения административной процедуры согласно приложению N 2 к Административному регламенту в связи с поступлением от заявителя в Министерство заявления о продлении срока действия свидетельства об аккредитации.
Заявление о продлении срока действия свидетельства об аккредитации представляется заявителем в Министерство по форме, предусмотренной приложением N 5 к Административному регламенту, не позднее 30 рабочих дней до истечения срока действия свидетельства об аккредитации.
Рассмотрение заявления о продлении срока действия свидетельства об аккредитации и принятие решения о продлении срока действия свидетельства об аккредитации или об отказе в продлении срока действия свидетельства об аккредитации осуществляется в срок, установленный подпунктом 3 пункта 16 Административного регламента.
Срок продления действия свидетельства об аккредитации составляет 5 лет.
56. Ответственный исполнитель в течение 8 рабочих дней с даты своего назначения осуществляет рассмотрение заявления о продлении срока действия свидетельства об аккредитации и имеющихся в распоряжении Министерства материалов проверки соблюдения медицинской организацией правил клинической практики и требований по аккредитации, указанных в пункте 5 Административного регламента (при наличии).
Несоблюдение медицинской организацией требований по аккредитации является основанием для отказа в продлении срока действия свидетельства об аккредитации
57. По результатам рассмотрения заявления о продлении срока действия свидетельства об аккредитации и имеющихся в распоряжении Министерства документов ответственный исполнитель в течение 2 рабочих дней с даты окончания их рассмотрения готовит проект решения о продлении срока действия свидетельства об аккредитации или проект решения об отказе в продлении срока действия свидетельства об аккредитации с мотивированным обоснованием причин отказа.
Проект решения о продлении срока действия свидетельства об аккредитации (об отказе в продлении срока действия свидетельства об аккредитации) в течение 2 рабочих дней согласовывается и подписывается директором Департамента.
58. В течение 1 рабочего дня со дня подписания решения о продлении срока действия свидетельства об аккредитации ответственный исполнитель вносит в свидетельство об аккредитации, представленное заявителем, соответствующую запись которая оформляется на бланке, являющемся защищенной полиграфической продукцией со степенью защиты уровня "В" и подписывается уполномоченным заместителем Министра здравоохранения Российской Федерации в течение 2 рабочих дней, удостоверяемую подписью уполномоченного заместителя Министра здравоохранения Российской Федерации.
Ответственный исполнитель в течение 2 рабочих дней с даты подписания уполномоченным заместителем Министра здравоохранения Российской Федерации свидетельства об аккредитации направляет (вручает) заявителю копию решения о продлении срока действия свидетельства об аккредитации и свидетельство об аккредитации с соответствующей отметкой о продлении его срока действия.
В случае принятия решения об отказе в продлении срока действия свидетельства об аккредитации ответственный исполнитель в течение 3 рабочих дней с даты подписания указанного решения направляет (вручает) его копию заявителю.
59. Результатами административной процедуры являются:
1) направление (вручение) заявителю копии решения о продлении срока действия свидетельства об аккредитации, а также свидетельства об аккредитации с соответствующей отметкой о продлении срока;
2) направление (вручение) заявителю копии решения об отказе в продлении срока действия свидетельства об аккредитации.
Рассмотрение заявления о переоформлении свидетельства об аккредитации, принятие решения о переоформлении (об отказе в переоформлении) свидетельства об аккредитации
60. Административная процедура "Рассмотрение заявления о переоформлении свидетельства об аккредитации и документов, принятие решения о переоформлении (об отказе в переоформлении) свидетельства об аккредитации" осуществляется в соответствии с блок-схемой исполнения административной процедуры согласно приложению N 3 к Административному регламенту в связи с поступлением от заявителя в Министерство заявления о переоформлении свидетельства об аккредитации.
Рассмотрение заявления о переоформлении свидетельства об аккредитации, принятие решения о переоформлении (об отказе в переоформлении) свидетельства об аккредитации осуществляется в срок, установленный подпунктом 4 пункта 16 Административного регламента.
Переоформленное свидетельство об аккредитации выдается на срок, не превышающий срока действия первоначального свидетельства об аккредитации.
61. Свидетельство об аккредитации подлежит переоформлению в случаях:
1) изменения наименования медицинской организации;
2) изменения места нахождения медицинской организации.
62. Ответственный исполнитель в течение 3 рабочих дней с даты своего назначения осуществляет проверку сведений, содержащихся в заявлении о переоформлении свидетельства об аккредитации, и выписке из Единого государственного реестра юридических лиц, содержащую сведения об изменении наименования или места нахождения медицинской организации, с целью определения согласованности представленной информации и достоверности сведений, указанных в заявлении.
При непредставлении заявителем в инициативном порядке выписки из Единого государственного реестра юридических лиц, содержащую сведения, указанные в пункте 61 Административного регламента, ответственный исполнитель запрашивает необходимую информацию путем направления запроса в ФНС России в порядке межведомственного информационного взаимодействия.
63. По результатам проверки заявления о переоформлении свидетельства об аккредитации и выписки из Единого государственного реестра юридических лиц ответственный исполнитель в течение 2 рабочих дней готовит проект решения о переоформлении свидетельства об аккредитации и переоформленное свидетельство об аккредитации, которое оформляется на бланке, являющемся защищенной полиграфической продукцией со степенью защиты уровня "В" и подписывается уполномоченным заместителем Министра здравоохранения Российской Федерации в течение 2 рабочих дней или проект решения об отказе в переоформлении свидетельства.
Решение о переоформлении (об отказе в переоформлении) свидетельства об аккредитации в течение 1 рабочего дня согласовывается с начальником отдела и подписывается директором Департамента.
В течение 1 рабочего дня с даты подписания решения о переоформлении свидетельства об аккредитации переоформленное свидетельство об аккредитации подписывается уполномоченным заместителем Министра здравоохранения Российской Федерации.
64. Ответственный исполнитель в течение 2 рабочих дней с даты подписания уполномоченным заместителем Министра здравоохранения Российской Федерации переоформленного свидетельства об аккредитации направляет (вручает) заявителю копию решения о переоформлении свидетельства об аккредитации и переоформленное свидетельство об аккредитации.
В случае принятия решения об отказе в переоформлении свидетельства об аккредитации ответственный исполнитель в течение 3 рабочих дней с даты подписания указанного решения направляет (вручает) его копию заявителю.
65. Результатами административной процедуры являются:
1) направление (вручение) заявителю копии решения о переоформлении свидетельства об аккредитации и переоформленного свидетельства об аккредитации;
2) направление (вручение) заявителю копии решения об отказе в переоформлении свидетельства об аккредитации.
Приостановление (возобновление), прекращение действия свидетельства об аккредитации, аннулирование свидетельства об аккредитации
66. Административная процедура "Приостановление (возобновление), прекращение действия свидетельства об аккредитации, аннулирование свидетельства об аккредитации".
67. Действие свидетельства об аккредитации приостанавливается Министерством в случае выявления при проведении проверки медицинской организации нарушения требований по аккредитации на срок до момента устранения указанного нарушения.
Действие свидетельства об аккредитации возобновляется Министерством после устранения медицинской организацией нарушения требований по аккредитации.
Принятие решения о приостановлении (возобновлении) действия свидетельства об аккредитации принимается в срок, установленный подпунктом 5 пункта 16 Административного регламента.
68. Поступившие в Министерство документы, подтверждающие нарушение медицинской организацией требований по аккредитации, в том числе акты проверок, проведенных Росздравнадзором при проведении государственного контроля в рамках установленных полномочий, регистрируются в течение 1 рабочего дня в Департаменте управления делами и кадров Министерства и направляются в Департамент.
В течение 1 рабочего дня с даты поступления в Департамент документов, указанных в абзаце 1 пункта 63 Административного регламента, из числа сотрудников Департамента назначается ответственный исполнитель по их рассмотрению.
Фамилия, имя и отчество (последнее - при наличии) ответственного исполнителя, его место работы и номер телефона должны быть сообщены заявителю по его письменному или устному обращению.
Ответственный исполнитель в течение 6 рабочих дней с даты своего назначения рассматривает документы, указанные в пункте 68 Административного регламента, и в случае подтверждения факта нарушения медицинской организацией требований по аккредитации готовит проект решения о приостановлении действия свидетельства об аккредитации и проект решения об устранении выявленного нарушения требований по аккредитации с указанием срока устранения (в 2-х экземплярах).
69. В течение 2 рабочих дней решение о приостановлении действия свидетельства об аккредитации и решение об устранении выявленного нарушения требований по аккредитации согласовываются и подписываются директором Департамента.
Копия решения о приостановлении действия свидетельства об аккредитации и 1 экземпляр решения об устранении выявленного нарушения требований по аккредитации в течение 3 рабочих дней с даты их подписания директором Департамента направляются в медицинскую организацию или вручаются руководителю или уполномоченному представителю медицинской организации.
70. Медицинская организация, действие свидетельства об аккредитации которой приостановлено, в течение срока, установленного Министерством для устранения выявленных нарушений, устраняет соответствующие нарушения, о чем уведомляет Министерство.
Документы, подтверждающие факт устранения нарушения требований по аккредитации, регистрируются в течение 1 рабочего дня в Департаменте управления делами и кадров Министерства и направляются в Департамент.
71. В течение 1 рабочего дня с даты поступления в Департамент документов, указанных в пункте 70 Административного регламента, из числа сотрудников Департамента назначается ответственный исполнитель по их рассмотрению.
Фамилия, имя и отчество (последнее - при наличии) ответственного исполнителя, его место работы и номер телефона должны быть сообщены заявителю по его письменному или устному обращению.
Ответственный исполнитель в течение 6 рабочих дней с даты своего назначения рассматривает документы, указанные в пункте 70 Административного регламента, и в случае подтверждения факта устранения выявленного нарушения требований по аккредитации готовит проект решения о возобновлении действия свидетельства об аккредитации.
Решение о возобновлении действия свидетельства об аккредитации согласовывается и подписывается директором Департамента в течение 2 рабочих дней.
Копия указанного решения в течение 3 рабочих дней с даты его подписания директором Департамента направляется в медицинскую организацию или вручается руководителю или уполномоченному представителю медицинской организации.
72. Министерство аннулирует свидетельство об аккредитации в срок, установленный подпунктом 6 пункта 16 Административного регламента, в следующих случаях:
1) неисполнение медицинской организацией решения об устранении выявленного нарушения требований по аккредитации в срок, установленный пунктом 70 Административного регламента;
2) нарушение медицинской организацией требований по аккредитации, предусмотренных пунктом 5 Административного регламента, за совершение которых действие свидетельства об аккредитации приостанавливалось не менее 2 раз в течение срока его действия.
73. Документы, подтверждающие сведения, указанные в пункте 72 Административного регламента, регистрируются в течение 1 рабочего дня в Департаменте управления делами и кадров Министерства и направляются в Департамент.
В течение 1 рабочего дня с даты поступления в Департамент указанных документов из числа сотрудников Департамента назначается ответственный исполнитель по их рассмотрению.
Фамилия, имя и отчество (последнее - при наличии) ответственного исполнителя, его место работы и номер телефона должны быть сообщены заявителю по его письменному или устному обращению.
74. Ответственный исполнитель в течение 6 рабочих дней с даты своего назначения рассматривает документы, указанные в пункте 73 Административного регламента, и в случае подтверждения содержащихся в них сведений готовит проект решения об аннулировании свидетельства об аккредитации.
Решение об аннулировании действия свидетельства об аккредитации согласовываются и подписываются директором Департамента в течение 2 рабочих дней.
Копия решения об аннулировании действия свидетельства об аккредитации в течение 3 рабочих дней с даты их подписания директором Департамента направляются в медицинскую организацию или вручаются руководителю или уполномоченному представителю медицинской организации.
75. Действие свидетельства об аккредитации прекращается в следующих случаях:
1) истечение срока действия свидетельства об аккредитации;
2) досрочное прекращение клинических исследований лекарственных препаратов для медицинского применения по заявленным целям по заявлению медицинской организации;
3) ликвидация или реорганизация медицинской организации.
Решение о прекращении действия свидетельства об аккредитации принимается в срок, установленный подпунктом 7 пункта 16 Административного регламента.
76. Документы, подтверждающие сведения, указанные в пункте 75 Административного регламента, поступившие в Министерство, регистрируются в течение 1 рабочего дня в Департаменте управления делами и кадров Министерства и направляются в Департамент.
В течение 1 рабочего дня с даты поступления в Департамент указанных документов из числа сотрудников Департамента назначается ответственный исполнитель по их рассмотрению.
Фамилия, имя и отчество (последнее - при наличии) ответственного исполнителя, его место работы и номер телефона должны быть сообщены заявителю по его письменному или устному обращению.
77. Ответственный исполнитель в течение 6 рабочих дней с даты своего назначения рассматривает документы, указанные в пункте 76 Административного регламента, и в случае подтверждения содержащихся в них сведений готовит проект решения о прекращении действия свидетельства об аккредитации.
Решение о прекращении действия свидетельства об аккредитации согласовывается и подписывается директором Департамента в течение 2 рабочих дней.
Копия указанного решения в течение 3 рабочих дней с даты его подписания направляется в медицинскую организацию или вручается руководителю или уполномоченному представителю медицинской организации.
78. Результатами административной процедуры являются:
1) вручение (направление) заявителю копии решения о приостановлении (возобновлении) действия свидетельства об аккредитации;
2) вручение (направление) заявителю копии решения об аннулировании свидетельства об аккредитации;
3) вручение (направление) заявителю копии решения о прекращении действия свидетельства об аккредитации.
IV. Формы контроля за исполнением Административного регламента
Порядок осуществления текущего контроля за соблюдением и исполнением ответственными должностными лицами положений Административного регламента
79. Текущий контроль за соблюдением порядка предоставления государственной услуги, принятием решений должностными лицами Министерства осуществляется постоянно в процессе осуществления административных процедур в соответствии с установленными Административным регламентом содержанием административных действий и сроками их осуществления, а также путем проведения проверок исполнения положений Административного регламента, иных нормативных правовых актов Российской Федерации.
80. Контроль за осуществлением административных процедур при предоставлении государственной услуги осуществляется уполномоченными должностными лицами Министерства, ответственными за организацию работы по предоставлению государственной услуги.
Порядок и периодичность осуществления плановых и внеплановых проверок полноты и качества предоставления государственной услуги
81. В Министерстве проводятся плановые и внеплановые проверки полноты и качества предоставления государственной услуги (далее - проверки).
Периодичность осуществления проверок устанавливается Министром здравоохранения Российской Федерации.
При проведении плановой проверки полноты и качества предоставления государственной услуги могут рассматриваться все вопросы, связанные с предоставлением государственной услуги (комплексные проверки), или вопросы, связанные с осуществлением той или иной административной процедуры (тематические проверки).
Внеплановые проверки проводятся по конкретному обращению граждан и юридических лиц.
Плановые и внеплановые проверки проводятся на основании приказов Министерства.
82. По результатам проведенных плановых и внеплановых проверок в случае выявления нарушений прав заявителей виновные лица несут дисциплинарную ответственность в соответствии с законодательством Российской Федерации.
Ответственность должностных лиц Министерства за решения и действия (бездействие), принимаемые ими в ходе предоставления государственной услуги
83. Персональная ответственность должностных лиц Министерства закрепляется в их должностных регламентах в соответствии с требованиями законодательства Российской Федерации.
Ответственный исполнитель несет персональную ответственность за:
1) соответствие результатов рассмотрения заявления и комплекта документов требованиям законодательства Российской Федерации;
2) соблюдение сроков и порядка приема заявления и комплекта документов;
3) соблюдение сроков и порядка выдачи документов, указанных в пунктах 15 и 16 Административного регламента.
84. Должностные лица, осуществляющие контроль за исполнением Административного регламента, определяются актами Министерства.
Положения, характеризующие требования к порядку и формам контроля за предоставлением государственной услуги, в том числе со стороны граждан, их объединений и организаций
85. Граждане, их объединения и организации вправе получать информацию о порядке предоставления государственной услуги, а также направлять замечания и предложения по улучшению качества и доступности предоставления государственной услуги.
V. Досудебный (внесудебный) порядок обжалования решений и действий (бездействия) Министерства, предоставляющего государственную услугу, а также ее должностных лиц
Информация для заявителя о его праве подать жалобу на действия (бездействие) и решения, принятые (осуществляемые) в ходе предоставления государственной услуги
86. Заявитель имеет право подать жалобу на решение и (или) действие (бездействие) Министерства и (или) их должностных лиц, принятое и осуществляемое в ходе предоставления государственной услуги (далее - жалоба) в досудебном порядке.
87. Заявитель может обратиться с жалобой, в том числе в следующих случаях:
1) нарушение срока регистрации запроса заявителя о предоставлении государственной услуги;
2) нарушение срока предоставления государственной услуги;
3) требование у заявителя документов, не предусмотренных нормативными правовыми актами Российской Федерации для предоставления государственной услуги;
4) отказ в приеме у заявителя документов, предоставление которых предусмотрено нормативными правовыми актами Российской Федерации для предоставления государственной услуги;
5) отказ в предоставлении государственной услуги, если основания отказа не предусмотрены федеральными законами и принятыми в соответствии с ними иными нормативными правовыми актами Российской Федерации;
6) затребование с заявителя при предоставлении государственной услуги платы, не предусмотренной нормативными правовыми актами Российской Федерации;
7) отказ Министерства в исправлении допущенных опечаток и ошибок в выданных в результате предоставления государственной услуги документах либо нарушение установленного срока таких исправлений.
Предмет жалобы
88. Предметом жалобы являются решения и действия (бездействие) Министерства, предоставляющего государственную услугу, ее должностных лиц, принятые (осуществляемые) ими в ходе предоставления государственной услуги в соответствии с настоящим Административным регламентом, которые, по мнению заявителя, нарушают его права и законные интересы.
Органы государственной власти и уполномоченные на рассмотрение жалобы должностные лица, которым может быть направлена жалоба
89. В случае обжалования действий (бездействий) должностного лица структурного подразделения Министерства, жалоба подается на имя руководителя соответствующего структурного подразделения Министерства.
В случае обжалования действий (бездействий) руководителя структурного подразделения Министерства, жалоба подается на имя заместителя Министра здравоохранения Российской Федерации, курирующего данное структурное подразделение в соответствии с распределением обязанностей, установленным приказом Министерства.
Жалоба на действия (бездействия) заместителя Министра здравоохранения Российской Федерации подается на имя Министра здравоохранения Российской Федерации.
Порядок подачи и рассмотрения жалобы
90. В досудебном порядке заявители имеют право обратиться с жалобой в письменной форме по почте, через многофункциональный центр предоставления государственных и муниципальных услуг, с использованием официального сайта Министерства в сети Интернет: www.rosminzdrav.ru и через Единый портал государственных и муниципальных услуг (функций): www.gosuslugi.ru*(3), а также жалоба может быть принята при личном приеме заявителя.
91. Прием жалоб в письменной форме осуществляется Министерством в месте предоставления государственной услуги (в месте, где заявитель подавал запрос на получение государственной услуги, нарушение порядка которой обжалуется, либо в месте, где заявителем получен результат указанной государственной услуги).
Время приема жалоб должно совпадать со временем предоставления государственных услуг.
Жалоба в письменной форме может быть также направлена по почте.
В случае подачи жалобы при личном приеме заявитель представляет документ, удостоверяющий его личность в соответствии с законодательством Российской Федерации.
92. Жалоба должна содержать:
1) наименование органа, предоставляющего государственную услугу, должностного лица Министерства, решения и действия (бездействие) которых обжалуются;
2) фамилию, имя, отчество (последнее - при наличии), сведения о месте жительства заявителя - физического лица либо наименование, сведения о месте
нахождения заявителя - юридического лица, а также номер (номера) контактного телефона, адрес (адреса) электронной почты (при наличии) и почтовый адрес, по которым должен быть направлен ответ заявителю;
3) сведения об обжалуемых решениях и действиях (бездействии) Министерства, должностного лица Министерства;
4) доводы, на основании которых заявитель не согласен с решением и действием (бездействием) Министерства, должностного лица Министерства.
93. Заявителем могут быть представлены документы (при наличии), подтверждающие доводы заявителя, либо их копии.
94. В случае если жалоба подается через представителя заявителя, также представляется документ, подтверждающий полномочия на осуществление действий от имени заявителя. В качестве документа, подтверждающего полномочия на осуществление действий от имени заявителя, может быть представлена:
а) оформленная в соответствии с законодательством Российской Федерации доверенность (для физических лиц);
б) оформленная в соответствии с законодательством Российской Федерации доверенность, заверенная печатью заявителя и подписанная руководителем заявителя или уполномоченным этим руководителем лицом (для юридических лиц);
в) копия решения о назначении или об избрании либо приказа о назначении физического лица на должность, в соответствии с которым такое физическое лицо обладает правом действовать от имени заявителя без доверенности.
95. При подаче жалобы в электронном виде документы, указанные в пункте 94 могут быть представлены в форме электронных документов, подписанных электронной подписью, вид которой предусмотрен законодательством Российской Федерации*(4), при этом документ, удостоверяющий личность заявителя, не требуется.
96. Жалоба подлежит обязательной регистрации в течение 3 (трех) рабочих дней с момента поступления в Министерство.
Сроки рассмотрения жалобы
97. При обращении заявителей с жалобой в письменной форме или в форме электронного документа, срок ее рассмотрения не должен превышать 15 (пятнадцати) рабочих дней со дня ее регистрации, а в случае обжалования отказа Министерства в приеме документов у заявителя либо в исправлении допущенных опечаток и ошибок или в случае обжалования нарушения установленного срока таких исправлений - 5 (пяти) рабочих дней со дня ее регистрации, если Правительством Российской Федерации не установлен иной срок.*(5)
Перечень оснований для приостановления рассмотрения жалобы
98. Основания для приостановления рассмотрения жалобы отсутствуют.
Результат рассмотрения жалобы
99. По результатам рассмотрения жалобы Министерство принимает одно из следующих решений:
1) удовлетворяет жалобу, в том числе в форме отмены принятого решения, исправления допущенных Министерством опечаток и ошибок в выданных в результате предоставления государственной документах, возврата заявителю денежных средств, взимание которых не предусмотрено нормативными правовыми актами Российской Федерации, а также в иных формах;
2) отказывает в удовлетворении жалобы.
Порядок информирования заявителя о результатах рассмотрения жалобы
100. Не позднее дня, следующего за днем принятия решения, заявителю направляется мотивированный ответ о результатах рассмотрения жалобы в письменной форме и, по желанию заявителя, в электронной форме.
101. В случае установления в ходе или по результатам рассмотрения жалобы признаков состава административного правонарушения или преступления должностное лицо, наделенное полномочиями по рассмотрению жалоб, незамедлительно направляет имеющиеся материалы в органы прокуратуры.
Порядок обжалования решения по жалобе
102. Обжалование решения по жалобе осуществляется в порядке, установленном пунктом 89 Административного регламента.
Право заявителя на получение информации и документов, необходимых для обоснования и рассмотрения жалобы
103. Заявители имеют право обратиться в Министерство за получением информации и документов, необходимых для обоснования и рассмотрения жалобы.
Способы информирования заявителей о порядке подачи и рассмотрения жалобы
104. Информирование заявителей о порядке подачи и рассмотрения жалобы осуществляется в соответствии с пунктом 6 Административного регламента.
-------------------------------------------
*(1) Статья 333.33 "Налогового кодекса Российской Федерации (часть вторая)" от 05.08.2000 N 117-ФЗ
*(2) Собрание законодательства Российской Федерации, 1995, N 48, ст. 4563; 2001, N 33, ст. 3426; 2004, N 35, ст. 3607
*(3) Постановление Правительства РФ от 20.11.2012 N 1198 "О федеральной государственной информационной системе, обеспечивающей процесс досудебного (внесудебного) обжалования решений и действий (бездействия), совершенных при предоставлении государственных и муниципальных услуг"
*(4) Федеральный закон от 06.04.2011 N 63-ФЗ "Об электронной подписи".
*(5) Постановление Правительства Российской Федерации от 16 августа 2012 г. N 840 "О порядке подачи и рассмотрения жалоб на решения и действия (бездействие) федеральных органов исполнительной власти и их должностных лиц, федеральных государственных служащих, должностных лиц государственных внебюджетных фондов Российской Федерации".
Приложение № 1
к Административному регламенту Министерства здравоохранения Российской Федерации по предоставлению государственной услуги по аккредитации медицинских организаций на право проведения клинических исследований, утвержденному приказом Минздрава России от «__» _______ 20__ г. № _____
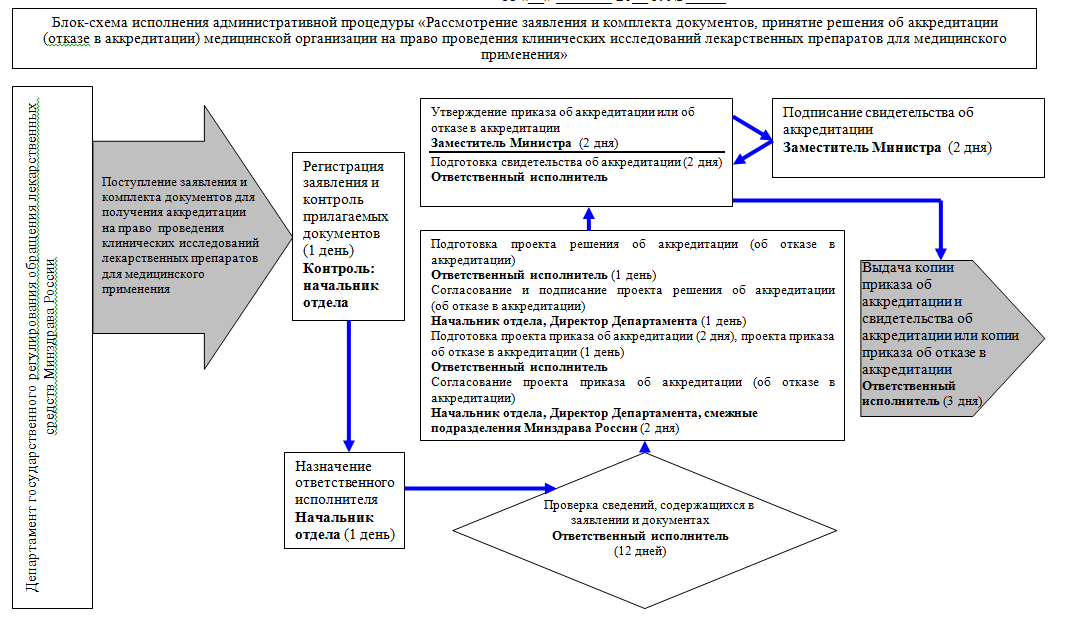
Приложение № 2
к Административному регламенту Министерства здравоохранения Российской Федерации по предоставлению государственной услуги по аккредитации медицинских организаций на право проведения клинических исследований, утвержденному приказом Минздрава России от «__» _______ 20__ г. № ___
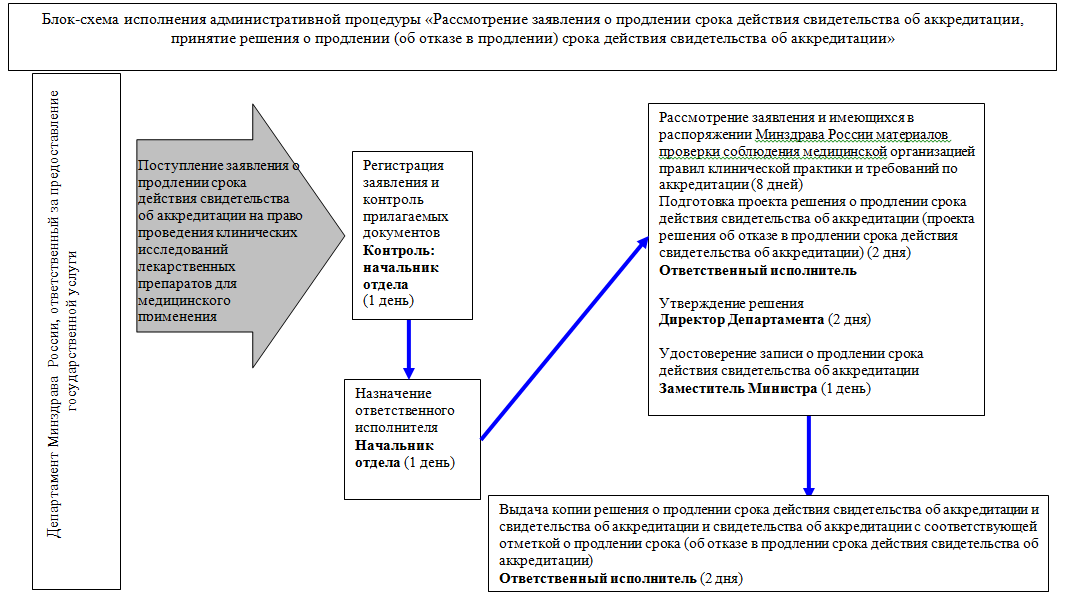
Приложение № 3
к Административному регламенту Министерства здравоохранения Российской Федерации по предоставлению государственной услуги по аккредитации медицинских организаций на право проведения клинических исследований лекарственных препаратов для медицинского применения, утвержденному приказом Минздрава России от «__» _______ 20__ г. № _____
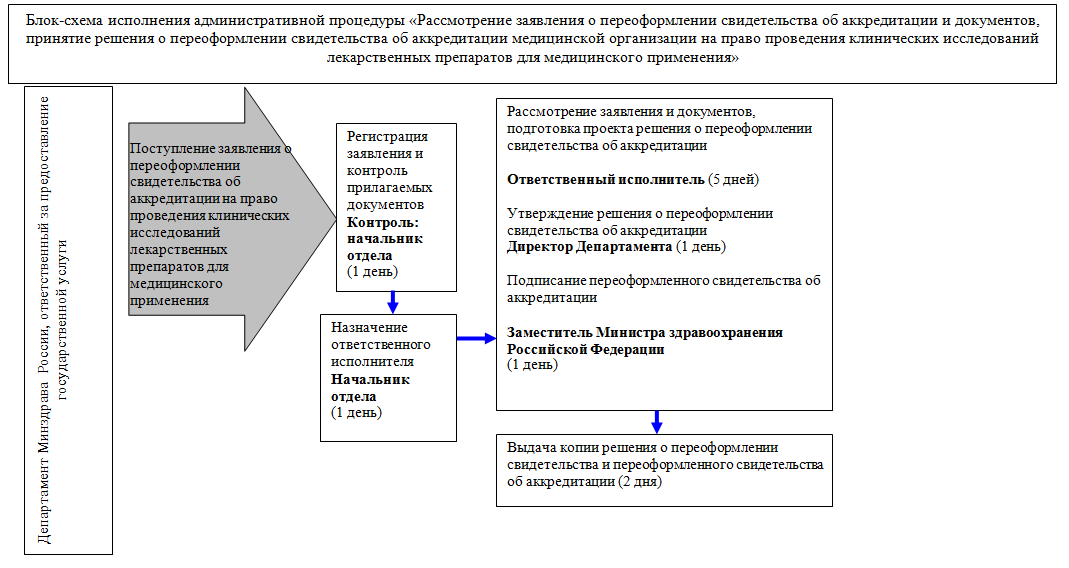
Приложение № 4
к Административному регламенту Министерства здравоохранения Российской Федерации по предоставлению государственной услуги по аккредитации медицинских организаций на право проведения клинических исследований лекарственных препаратов для медицинского применения, утвержденному приказом Минздрава России от «___» ________ 20__ г. №_____
Заявление
о предоставлении свидетельства об аккредитации медицинской организации на право проведения клинических исследований лекарственных препаратов для медицинского применения
В Министерство здравоохранения Российской Федерации
1. От _________________________________________________________________
(указываются полное и сокращенное наименования, организационно-правовая форма медицинской организации)
2. Место нахождения и места осуществления медицинской деятельности
_____________________________________________________________________
(указываются почтовые адреса места нахождения и мест осуществления
медицинской деятельности, номера телефонов, телефаксов, адреса
электронной почты медицинской организации)
3. Основной государственный регистрационный номер записи о государственной регистрации медицинской организации
__________________________________________________________
_____________________________________________________________________
___________
(указываются ОГРН и реквизиты документа, подтверждающего внесение
сведений о медицинской организации в Единый государственный реестр
юридических лиц)
4. Идентификационный номер налогоплательщика __________________________
____________________________________________________________________
(указываются ИНН и реквизиты документа о постановке на учет
в налоговом органе)
Прошу предоставить свидетельство об аккредитации на право проведения клинических исследований лекарственных препаратов для медицинского применения в целях:
1) установления безопасности лекарственных препаратов для здоровых добровольцев и (или) переносимости их здоровыми добровольцами
__________________________________;
2) подбора оптимальных дозировок лекарственного препарата и курса лечения для пациентов с определенным заболеванием, оптимальных доз и схем вакцинации иммунобиологическими лекарственными препаратами здоровых добровольцев
____________________________________________________________________;
3) изучения возможности расширения показаний для медицинского применения и выявления ранее неизвестных побочных действий зарегистрированных лекарственных препаратов
______________________________________________________________________.
(нужное указать)
Заявление составлено «__» ____________ 20_____ г.
_______________________ _____________________ _______________________
| (наименование должности руководителя организации или уполномоченного им лица) | (подпись руководителя медицинской организации или уполномоченного им лица) | (Ф.И.О. руководителя организации или уполномоченного им лица) |
|---|
М.П.
Контактный телефон ___________________________
Приложение № 5
к Административному регламенту Министерства здравоохранения Российской Федерации по предоставлению государственной услуги по аккредитации медицинских организаций на право проведения клинических исследований лекарственных препаратов для медицинского применения, утвержденному приказом Минздрава России от «___» ________ 20__ г. №_____
Форма
Заявление
о продлении срока действия свидетельства об аккредитации на право проведения клинических исследований лекарственных препаратов для медицинского применения
В Министерство здравоохранения Российской Федерации
От ___________________________________________________________________
(указываются полное и (в случае, если имеется) сокращенное наименование медицинской организации)
Место нахождения и места осуществления медицинской деятельности
_____________________________________________________________________
(указываются почтовые адреса места нахождения и мест осуществления
медицинской деятельности)
Прошу продлить срок действия свидетельства об аккредитации на право проведения клинических исследований лекарственных препаратов для медицинского применения
_____________________________________________________________________,
(указываются номер и дата свидетельства об аккредитации)
выданное на основании приказа Минздрава России
_____________________________________________________________________
(указываются номер и дата приказа Минздрава России об аккредитации)
на срок ______________________
(указывается срок аккредитации)
Заявление составлено «__» ____________ 20__ г.
| ______________________ | ______________________ | ______________________ |
|---|---|---|
| (наименование должности руководителя организации или уполномоченного им лица) | (подпись руководителя медицинской организации или уполномоченного им лица) | (Ф.И.О. руководителя организации или уполномоченного им лица) |
М.П.
Контактный телефон ___________________________
Приложение № 6
к Административному регламенту Министерства здравоохранения Российской Федерации по предоставлению государственной услуги по аккредитации медицинских организаций на право проведения клинических исследований лекарственных препаратов для медицинского применения, утвержденному приказом Минздрава России от «___» ________ 20__ г. №_____
Форма
Заявление
о предоставлении дубликата свидетельства об аккредитации на право проведения клинических исследований лекарственных препаратов для медицинского применения
В Министерство здравоохранения Российской Федерации
От __________________________________________________________________
(указываются полное и (в случае, если имеется) сокращенное наименование медицинской организации
Место нахождения и места осуществления медицинской деятельности
_____________________________________________________________________
(указываются почтовые адреса места нахождения и мест осуществления
медицинской деятельности)
В связи с _____________________________________________________________
(указываются обстоятельства, повлекшие утрату (порчу) свидетельства)
Прошу выдать дубликат свидетельства об аккредитации на право проведения клинических исследований лекарственных препаратов для медицинского применения
_____________________________________________________________________,
(указываются номер и дата свидетельства об аккредитации)
выданное на основании приказа Минздрава России
_____________________________________________________________________
(указываются номер и дата приказа Минздравсоцразвития России об аккредитации)
на срок ___________________
(указывается срок аккредитации)
Заявление составлено «__» ____________ 20__ г.
| ______________________ | ______________________ | ______________________ |
|---|---|---|
| (наименование должности руководителя организации или уполномоченного им лица) | (подпись руководителя медицинской организации или уполномоченного им лица) | (Ф.И.О. руководителя организации или уполномоченного им лица) |
М.П.
Контактный телефон ___________________________
Приложение № 7
к Административному регламенту Министерства здравоохранения Российской Федерации по предоставлению государственной услуги по аккредитации медицинских организаций на право проведения клинических исследований лекарственных препаратов для медицинского применения, утвержденному приказом Минздрава России от «___» ________ 20__ г. №_____
Форма
Заявление
о переоформлении свидетельства об аккредитации медицинской организации на право проведения клинических исследований лекарственных препаратов для медицинского применения
В Министерство здравоохранения Российской Федерации
1. От ________________________________________________________________
(указываются полное и (в случае, если имеется) сокращенное наименование медицинской организации)
2. Место нахождения и места осуществления медицинской деятельности
_____________________________________________________________________
(указываются почтовые адреса места нахождения и мест осуществления
медицинской деятельности)
Прошу переоформить свидетельство об аккредитации на право проведения клинических исследований лекарственных препаратов для медицинского применения
_____________________________________________________________________,
(указываются номер и дата свидетельства об аккредитации)
выданное на основании приказа Минздрава России
_____________________________________________________________________
(указываются номер и дата приказа Минздрава России об аккредитации)
на срок ______________________
(указывается срок аккредитации)
В связи с _____________________________________________________________
(указываются причины/основание для переоформления свидетельства)
Заявление составлено «__» ____________ 20__ г.
| ______________________ | ______________________ | ______________________ |
|---|---|---|
| (наименование должности руководителя организации или уполномоченного им лица) | (подпись руководителя медицинской организации или уполномоченного им лица) | (Ф.И.О. руководителя организации или уполномоченного им лица) |
М.П.
Контактный телефон ___________________________
Приложение № 8
к Административному регламенту Министерства здравоохранения Российской Федерации по предоставлению государственной услуги по аккредитации медицинских организаций на право проведения клинических исследований лекарственных препаратов для медицинского применения, утвержденному приказом Минздрава России от «___» ________ 20__ г. №_____
Форма
Заявление
о предоставлении выписки из перечня медицинских организаций, аккредитованных на право проведения клинических исследований лекарственных препаратов для медицинского применения
В Министерство здравоохранения Российской Федерации
От __________________________________________________________________
(указываются сведения о заявителе: Ф.И.О. и паспортные данные физического лица или полное и (в случае, если имеется) сокращенное наименование юридического лица)
Прошу выдать выписку из перечня медицинских организаций, аккредитованных на право проведения клинических исследований лекарственных препаратов для медицинского применения
В отношении __________________________________________________________
(указывается наименование медицинской организации, аккредитованной на право проведения клинических исследований лекарственных препаратов для медицинского применения)
Заявление составлено «__» ____________ 20__ г.
| ______________________ | ______________________ | ______________________ |
|---|---|---|
| (наименование должности руководителя организации или уполномоченного им лица) | (подпись руководителя медицинской организации или уполномоченного им лица) | (Ф.И.О. руководителя организации или уполномоченного им лица) |
М.П.
Контактный телефон ___________________________
Приложение № 9
к Административному регламенту Министерства здравоохранения Российской Федерации по предоставлению государственной услуги по аккредитации медицинских организаций на право проведения клинических исследований лекарственных препаратов для медицинского применения, утвержденному приказом Минздрава России от «__» _________20__ г. № _____

Обзор документа
Представлен проект Административного регламента Минздрава России по аккредитации медицинских организаций на право проведения клинических исследований лекарственных препаратов для медицинского применения.
Госуслугу планируется оказывать в течение 30 рабочих дней. Продление срока действия свидетельства об аккредитации будет возможно в течение 15 рабочих дней. Для переоформления документа потребуется 10 рабочих дней. Предусматриваются иные процедуры, определяются сроки их совершения.
Приводится перечень документов, необходимых для получения госуслуги. За выдачу свидетельства уплачивается госпошлина в порядке и размерах, установленных НК РФ.
Определяются показатели доступности и качества госуслуги. Закрепляется досудебный (внесудебный) порядок обжалования действий (бездействия) и решений ответственных должностных лиц.
Форма заявления о предоставлении свидетельства об аккредитации признается утратившей силу.



(1).jpg)


