Методические указания МУ 3.1.3490-17 "Изучение популяционного иммунитета к гриппу у населения Российской Федерации" (утв. Главным государственным санитарным врачом РФ 27 октября 2017 г.)
Методические указания МУ 3.1.3490-17
"Изучение популяционного иммунитета к гриппу у населения Российской Федерации"
(утв. Главным государственным санитарным врачом РФ 27 октября 2017 г.)
Введены впервые
I. Область применения
1.1. Настоящие методические указания устанавливают порядок и организацию проведения серологического мониторинга в рамках эпидемиологического надзора за гриппом для достижения следующих целей:
- прогнозирование эпидемиологической ситуации путем оценки состояния коллективного иммунитета к актуальным и ранее циркулировавшим антигенным вариантам возбудителей гриппа в предэпидемический период;
- мониторинг за циркуляцией возбудителей гриппа с помощью обнаружения специфических антител к различным антигенным вариантам вирусов гриппа в сыворотках крови в реакции торможения гемагглютинации (РТГА);
- объективная оценка эффективности специфической профилактики гриппа.
1.2. Настоящие методические указания предназначены для специалистов органов, осуществляющих федеральный государственный санитарно-эпидемиологический надзор, центров гигиены и эпидемиологии, научно-исследовательских и лечебно-профилактических организаций.
II. Общие положения
2.1. Проведение серологического мониторинга с целью изучения популяционного иммунитета к гриппу является обязательным элементом эпидемиологического надзора, поскольку эпидемиологическое благополучие населения в отношении гриппа определяется состоянием популяционного иммунитета к актуальным штаммам возбудителей.
2.2. Серологические исследования также важны для ретроспективного анализа вспышек, которые могут иметь место в учреждениях закрытого типа, школах, больницах, геронтологических учреждениях.
2.3. В методических указаниях представлен общий методический подход, порядок организации и проведения лабораторных исследований по оценке популяционного иммунитета к гриппу. Особое внимание уделено описанию формирования репрезентативных групп населения для изучения популяционного иммунитета в зависимости от преследуемой цели, обработке результатов и их интерпретации.
2.4. Методические указания разработаны с целью установки единых требований к порядку сбора, хранения, транспортировке образцов сыворотки крови в ходе серомониторинга гриппа в Российской Федерации, оценке результатов исследований, а также проведению экспертизы и оценки качества иммунопрофилактики гриппа объективными методами.
2.5. Методические указания предназначены для применения в организациях и учреждениях Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека, в лечебно-профилактических и других организациях, обеспечивающих выполнение противоэпидемических мероприятий.
2.6. Информация о состоянии популяционного иммунитета необходима для разработки прогноза развития эпидемиологической ситуации, а также планирования мероприятий по вакцинопрофилактике гриппа.
2.7. Перечень задач, решаемых в рамках изучения популяционного иммунитета к гриппу:
- оценка состояния популяционного иммунитета к различным антигенным вариантам актуальных вирусов гриппа в группах населения различного возраста в предэпидемический период для разработки прогноза заболеваемости и планирования профилактических мероприятий;
- выявление в предэпидемический период групп риска заболевания гриппом среди населения и территорий риска высокой заболеваемости;
- оценка состояния популяционного иммунитета в сравнительном аспекте постэпидемического и предэпидемического периодов с целью определения этиологии эпидемии гриппа и истинной заболеваемости;
- мониторинг вирусов гриппа животных у лиц, контактирующих с животными с помощью серологических методов;
- объективная оценка эффективности иммунизации населения в регионах;
- оценка эффективности вакцин против гриппа.
2.8. Проведение серологического мониторинга состояния коллективного иммунитета оформляется постановлением Главного государственного санитарного врача по субъекту Российской Федерации, в котором по согласованию с органами управления здравоохранением определяются территории, время (график), контингенты и численность групп населения, подлежащих обследованию, определяются лаборатории для проведения исследований, а также лица, ответственные за организацию и проведение этой работы. В развитие постановления Главного государственного санитарного врача по субъекту Российской Федерации издается приказ органа управления здравоохранением субъекта Российской Федерации.
2.9. Проведение серологического мониторинга ежегодно включается в планы работы территориальных органов Роспотребнадзора, центров гигиены и эпидемиологии и научно-исследовательских организаций Роспотребнадзора и организаций здравоохранения.
III. Введение
3.1. Коллективный иммунитет популяции является лимитирующим фактором в отношении распространения различных антигенных вариантов вируса гриппа А и В. В этой связи исследование популяционного иммунитета может быть полезным для прогноза возникновения эпидемий, выявления особенностей эпидемического процесса, а также широко используется с целью оценки средств специфической профилактики при их разработке и использовании.
3.2. Оценка состояния популяционного иммунитета может проводиться с целью прогнозирования возникновения эпидемического подъема гриппа. Высокий уровень популяционного иммунитета к определенному антигенному варианту гемагглютинина на протяжении 2 лет подряд указывает на возможность исчезновения из циркуляции этих антигенных вариантов вируса. Низкий уровень популяционного иммунитета к определенному антигенному варианту гемагглютинина в предэпидемический период может служить предвестником эпидемического подъема гриппа, вызванного данным вариантом вируса гриппа. Помимо этого низкий уровень популяционного иммунитета в течение длительного периода к ранее циркулировавшему антигенному варианту вируса гриппа может служить настораживающим прогностическим признаком, указывающим на возможность эпидемической циркуляции близкого антигенного варианта вируса гриппа в будущем.
3.3. Наряду с другими тестами оценка состояния популяционного иммунитета по окончании эпидемии гриппа может служить дополнительным критерием оценки этиологии прошедшей эпидемии гриппа.
3.4. Особое значение имеют сероэпидемиологические исследования, направленные на определение у людей антител к вирусам гриппа животных, таких как высокопатогенный вирус гриппа A (H5N1), поскольку обнаружение антител к вирусу гриппа с пандемическим потенциалом у людей, не контактировавших с птицей, будет косвенно свидетельствовать о приобретении вирусами способности передаваться от человека к человеку. Такие исследования наряду с ПЦР-исследованиями позволили бы выяснить, какова доля бессимптомных случаев инфицирования людей вирусами гриппа животных.
3.5. С целью оценки эффективности вакцинации исследуется популяционный иммунитет до и после вакцинации. С целью оценки эффективности вакцин против гриппа исследуется иммунитет в целевых группах, которым рекомендована исследуемая вакцина.
3.6. Поскольку доказана корреляция между титром антител в сыворотке крови к определенному антигенному варианту гемагглютинина (НА) вирусов гриппа, определенным в реакции торможения гемагглютинации (РТГА) и наличием защиты против инфицирования вирусом гриппа, имеющим данный антигенный вариант гемагглютинина, это исследование успешно используется для оценки коллективного иммунитета к гриппу. Уровень антител (или титр, определяемый в РТГА при последовательных двукратных разведениях сыворотки), при котором доля зараженных лиц (infection rate) падает в 2 раза по сравнению с наблюдаемой у лиц, не имеющих гомологичных антител, считают защитным 50% титром. Определенные опытным путем показатели 50% защитного титра различаются для вирусов гриппа разных субтипов и людей разного возраста, тем не менее, защитным считают титр 1:40, однако, некоторые исследователи считают, что для детей этот показатель должен составлять 1:80.
3.7. Низким титром считают значение 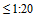 , промежуточным (или средним) от 1:40 до 1:80, высоким
, промежуточным (или средним) от 1:40 до 1:80, высоким 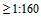 . Среди лиц, имеющих антитела к гомологичному вирусу гриппа в среднем или высоком титре после перенесенной ране инфекции, заразиться при контакте с возбудителем могут 9%, среди лиц, приобретших антитела в таком же титре в результате вакцинации - 23%, тогда как среди лиц, не имеющих антител, инфицируются 80%.
. Среди лиц, имеющих антитела к гомологичному вирусу гриппа в среднем или высоком титре после перенесенной ране инфекции, заразиться при контакте с возбудителем могут 9%, среди лиц, приобретших антитела в таком же титре в результате вакцинации - 23%, тогда как среди лиц, не имеющих антител, инфицируются 80%.
IV. Организация исследований
4.1. Мониторинг состояния коллективного иммунитета к вирусам гриппа предусматривает серологическое обследование на каждой территории различных групп населения, при этом в одной пробе сыворотки крови определяют максимальный спектр антител к различным антигенным вариантам разных субтипов вирусов гриппа (эпидемическим вирусам гриппа человека: A/H1N1, A/H3N2, B/Yamagata и B/Victoria, высокопатогенным вирусам гриппа животных и пандемическим вирусам гриппа).
4.2. Отбор контингентов для обследования начинается с определения территорий. Границы территории определяются сферой обслуживания той или иной организацией здравоохранения. Это может быть отдельный организованный коллектив детей и взрослых, врачебный участок, населенный пункт, приписанный к фельдшерско-акушерскому пункту, территория обслуживания одной поликлиники, фермерское хозяйство.
4.3. Серологический мониторинг целесообразно проводить в первую очередь на крупных административных территориях субъектов Российской Федерации (в городах, районных центрах). Каждый сезон в обследование должны включаться разные районы и поликлиники города (районного центра). Периодичность их обследования должна составлять 6-7 лет (по графику).
4.5. Сбор образцов сыворотки крови осуществляется при условии анонимности методом случайной выборки у людей разных возрастных групп и с различным прививочным анамнезом в отношении гриппа. Перед проведением серологического обследования отобранных лиц медицинские работники должны провести разъяснительную работу, в том числе с родителями обследуемых детей, о целях проверки у них напряженности иммунитета к гриппу. По результатам серологического обследования детей в различных возрастных группах оценивается качество прививок, проводимых в организованных коллективах.
4.6. В зависимости от преследуемой цели исследования сбор сывороток производят от определенных контингентов людей в определенные сроки с соблюдением правил сбора, транспортирования и хранения собранных проб (Приложение 1 к методическим указаниям). Следует учитывать, что сыворотки не подлежат повторному размораживанию-замораживанию, поэтому при необходимости их многократного использования сыворотки следует предварительно аликвотировать.
4.7. Для осуществления серологического мониторинга гриппа на территории Российской Федерации используется РТГА (Приложение 2 к методическим указаниям). Для проведения РТГА должны использоваться зарегистрированные в Российской Федерации диагностикумы.
4.8. Результаты серологического обследования контингентов фиксируются в рабочих журналах лабораторий (таблицы 1-3 в Приложении 6 к методическим указаниям) с указанием населенного пункта, организации, обследуемого и титра антител.
4.9. Динамическое слежение за состоянием иммунитета населения к гриппу, позволяет оценить потенциальную уязвимость населения и своевременно корректировать противоэпидемические мероприятия. При выявлении на какой-либо территории снижения уровня популяционного иммунитета в той или иной возрастной группе, принимаются управленческие решения, направленные на увеличение уровня иммунной прослойки среди населения с учетом того, какой штамм представляет наибольшую эпидемическую опасность. Особое значение имеют сероэпидемиологические исследования высокопатогенных вирусов гриппа животных (например: A/H5N1, А/H7N9), поскольку значимое повышение количества людей, имеющих антитела к вирусу гриппа с пандемическим потенциалом и профессионально не контактирующих с животными, будет свидетельствовать о появлении варианта вируса, способного передаваться от человека к человеку.
V. Оценка состояния популяционного иммунитета с целью прогноза заболеваемости
5.1. Изучение коллективного иммунитета к актуальным антигенным вариантам вирусов гриппа проводится по результатам исследования сывороток, собранных в предэпидемический период, в количестве не менее 150 сывороток в каждом субъекте Российской Федерации. Оптимальные сроки сбора сывороток - август-сентябрь.
5.2. Обследование проводится среди здорового детского и взрослого населения вне зависимости от наличия или отсутствия перенесенного гриппа в анамнезе и прививочного анамнеза в предшествовавшие эпидемические сезоны. Исследуют сыворотки крови, взятые от лиц следующих возрастных групп: 3-6 лет, 7-14 лет, 15-18 лет, 18-60 лет, старше 60 лет (не менее 30 образцов из каждой группы).
5.3. Собранные сыворотки следует аликвотировать и хранить замороженными в аликвотах для последующего использования (оценка соответствия вирусам, выделенным в начале эпидемического сезона, сравнительное исследование с сыворотками после вакцинации и постэпидемического периода).
5.4. Анализу подлежат следующие показатели:
- доля сывороток с защитным уровнем антител 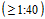 к актуальным штаммам вирусов гриппа (штаммы, рекомендованные в состав вакцины на предстоящий эпидемический сезон, штаммы, циркулировавшие в популяции людей ранее);
к актуальным штаммам вирусов гриппа (штаммы, рекомендованные в состав вакцины на предстоящий эпидемический сезон, штаммы, циркулировавшие в популяции людей ранее);
- доля сывороток с низким уровнем антител 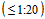 к актуальным штаммам вирусов гриппа (штаммы, рекомендованные в состав вакцины на предстоящий эпидемический сезон, штаммы, циркулировавшие в популяции людей ранее);
к актуальным штаммам вирусов гриппа (штаммы, рекомендованные в состав вакцины на предстоящий эпидемический сезон, штаммы, циркулировавшие в популяции людей ранее);
- доля сывороток, не содержащих антител к актуальным штаммам вирусов гриппа (штаммы, рекомендованные в состав вакцины на предстоящий эпидемический сезон, штаммы, циркулировавшие в популяции людей ранее).
5.5. Низкий уровень популяционного иммунитета - более 80% лиц, не имеющих в предэпидемический период антител или низкий титр 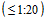 к актуальному гемагглютинину, может служить предвестником значительного эпидемического подъема гриппа, вызванного данным вариантом вируса гриппа.
к актуальному гемагглютинину, может служить предвестником значительного эпидемического подъема гриппа, вызванного данным вариантом вируса гриппа.
5.6. Высокий уровень популяционного иммунитета (менее 20% лиц с низким уровнем антител 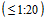 или их отсутствием) к актуальному гемагглютинину на протяжении 2 лет подряд указывает на возможность исчезновения из циркуляции этих антигенных вариантов вируса гриппа и высокую вероятность изменения его антигенной структуры.
или их отсутствием) к актуальному гемагглютинину на протяжении 2 лет подряд указывает на возможность исчезновения из циркуляции этих антигенных вариантов вируса гриппа и высокую вероятность изменения его антигенной структуры.
VI. Оценка состояния популяционного иммунитета с целью определения этиологии эпидемии гриппа и истинной заболеваемости
6.1. Исследование коллективного иммунитета к актуальным антигенным вариантам вирусов гриппа проводится среди здорового детского и взрослого населения вне зависимости от наличия или отсутствия перенесенного гриппа в анамнезе и прививочного статуса в сравнительном аспекте оценки уровня популяционного иммунитета в предэпидемический и постэпидемический период.
6.2. Одномоментному исследованию подвергаются сыворотки, собранные в постэпидемический период (май) в количестве не менее 150 сывороток в каждом субъекте Российской Федерации, и аликвоты сывороток, собранных в предэпидемический период (август-сентябрь) и хранившихся в замороженном состоянии. Сыворотки крови, берут от здорового населения разных возрастных групп (3-6 лет, 7-14 лет, 15-18 лет, 18-60 лет, старше 60 лет, не менее 30 образцов из каждой группы).
6.3. Анализу подлежат следующие показатели:
- доля образцов, не имеющих антител к актуальным штаммам вирусов гриппа (штаммы, циркулировавшие в данный эпидемический сезон), доля образцов, содержащих антитела в низком, среднем и высоком титре;
- средние значения геометрических титров антител (СГТ) (Приложение 3 к методическим указаниям), к актуальным штаммам вирусов гриппа (штаммы, циркулировавшие в данный эпидемический сезон).
6.4. Индикатором активности вируса гриппа определенной антигенной структуры является кратность прироста антител к данному гемагглютинину в постэпидемический период по сравнению с предэпидемическим периодом.
6.5. Показателем эпидемической активности вируса служит достоверное снижение доли лиц с отрицательным и низким уровнем антител к нему, достоверное увеличение доли лиц с высоким уровнем антител к нему и увеличение СГТ в 2 и более раз.
VII. Определение антител к вирусам гриппа животных у людей
7.1. Биологический материал для исследования берут у населения, профессионально контактирующего с сельскохозяйственными животными (свиньями, птицей), и дикой птицей.
7.2. С целью серологического мониторинга сыворотки крови собирают в августе-сентябре каждого года от людей, контактирующих с животными, в количестве не менее 100 образцов в каждом из 39 субъектов Российской Федерации, определенных в приказах Роспотребнадзора от 30.09.2013 N 714 "Об организации мониторинга за циркуляцией вирусов гриппа птиц" и от 04.08.2016 N 842 "Об организации опорных баз по мониторингу за вирусом гриппа с пандемическим потенциалом".
7.3. В случае контакта людей с животными, у которых лабораторно подтверждено наличие РНК вируса гриппа А с пандемическим потенциалом, необходимо собирать у контактных лиц парные сыворотки (1-я сыворотка - не позднее 7 дней от момента контакта, 2-я сыворотка - через 3 недели после контакта) с целью определения уровня сероконверсии в результате контакта с больным животным. Объем каждого образца сыворотки должен быть не менее 1,0 мл.
VIII. Оценка эффективности вакцинации
8.1. Оценка эффективности вакцинации против гриппа в текущем эпидемическом сезоне проводится путем сравнения состояния популяционного иммунитета до вакцинации (в предэпидемический период) и после вакцинации среди привитого населения, до начала сезонного подъема заболеваемости данной инфекцией.
8.1.1. Отбор сывороток проводят через один месяц после вакцинации.
8.1.2. Сыворотки крови, берут в количестве не менее 150 образцов от вакцинированного населения разных возрастных групп (3-6 лет, 7-14 лет, 15-18 лет, 18-60 лет, старше 60 лет, не менее 30 образцов из каждой группы) и из числа групп риска в отношении этой инфекции.
8.2. К группам риска в отношении сезонного гриппа относят лиц, подвергающихся повышенному риску контакта с вирусом гриппа (прежде всего, медицинские работники), а также тех, у кого грипп может протекать в тяжелой форме, способной привести к опасным осложнениям, госпитализации и к летальному исходу (например: беременные женщины, дети в возрасте до 5 лет, пожилые люди, больные хроническими заболеваниями сердечно-сосудистой системы, органов дыхания, эндокринной системы, включая метаболические нарушения, сопровождающиеся увеличением индекса массы тела).
8.3. В группу вакцинированных для изучения эффективности вакцинопрофилактики гриппа не включают:
- детей, у которых отсутствуют сведения о прививках в изучаемом эпидемическом сезоне;
- не привитых против гриппа;
- перенесших какое-либо острое заболевание за 1-1,5 месяца до обследования, так как отдельные болезни могут привести к временному снижению титра специфических антител.
8.4. По усмотрению специалистов, осуществляющих федеральный государственный санитарно-эпидемиологический надзор, серологическое обследование может быть проведено и в других возрастных и профессиональных группах.
8.5. При формировании обследуемых групп населения, следует придерживаться следующих принципов: единство вакцинного препарата, места получения прививки, единство прививочного анамнеза и сходство эпидемиологической ситуации, в условиях которой формируются обследуемые группы.
8.5.1. Единство места получения прививки (организация здравоохранения, детское дошкольное учреждение, школа, предприятие и другие организации, в которых проводилась вакцинация). Этот принцип формирования групп позволяет выявить организации с низким качеством прививочной работы в данном эпидемическом сезоне, а при последующем тщательном расследовании определить конкретные ее недостатки (например: нарушение правил хранения, транспортирования вакцин, фальсификацию прививок, технические ошибки).
8.5.2. Единство прививочного анамнеза: обследуемая группа населения должна быть однородной, для чего необходим отбор лиц, вакцинированных одинаковым вакцинным препаратом (одного состава и производителя). Наличие вакцинации в предыдущие эпидемические сезоны не учитывается.
8.6. Одномоментному исследованию подвергаются сыворотки, собранные в субъекте Российской Федерации от вакцинированных через один месяц после вакцинации до начала сезонного подъема заболеваемости и аликвоты сывороток, собранных в предэпидемический период (август-сентябрь) и хранившихся в замороженном состоянии.
8.7. Оценку эффективности вакцинации проводят по критериям прироста среднегеометрического титра антител и уровня серопротекции после вакцинации по сравнению с предэпидемическим периодом (Приложения 3 и 4 к методическим указаниям МУ 3.1.-17). Показателем эффективности вакцинации считают достоверный прирост уровня серопротекции или увеличение СГТ в 2,0 и более раз.
8.8. При выявлении в какой-либо группе привитых лиц несоответствия указанному критерию по каждому из актуальных вакцинных штаммов вируса гриппа необходимо:
- провести анализ прививочной документации на выявленных лиц без сероконверсии для установления факта наличия прививки - сопоставить сведения о прививках во всех учетных формах (например: карта профилактических прививок (ф. N 063/у), история развития ребенка (ф. N 112/у), амбулаторная карта больного (ф. N 025/у), рабочие журналы);
- оценить условия хранения и транспортирования вакцины, порядок проведения иммунизации;
- дополнительно проверить состояние иммунитета к гриппу у лиц того же возраста в количестве не менее 100 человек, но в 2 других коллективах той же организации здравоохранения, где выявлены несоответствия;
- если после дополнительного обследования количество не защищенных от гриппа будет превышать приведенные критерии, следует провести проверку учреждения здравоохранения, в которых выявлены несоответствия, с целью установления фальсификации прививок.
8.9. Материалы серологического мониторинга состояния коллективного иммунитета обобщаются по организациям разного типа, поликлиникам, району, городу (районному центру) и субъекту Российской Федерации в целом. Далее по каждой возрастной группе результаты серологического обследования сопоставляют с уровнем охвата прививками, что позволит подтвердить официальные данные об иммунизации населения или выявить несоответствие охвата прививками уровню коллективного иммунитета.
IX. Оценка эффективности вакцин
9.1. Эффективность средства специфической профилактики складывается из его иммунологической эффективности и профилактической эффективности.
9.1.1. Наиболее объективную оценку иммунологической эффективности (или иммуногенности) препарата вакцины можно получить при вакцинации серонегативных к специфическим антигенам людей. Из таких лиц формируют опытную и контрольную группы. Лица, получившие вакцинацию против гриппа в течение предыдущих 6 месяцев, исключаются из исследования.
9.1.1.1. При формировании групп соблюдают единство места получения прививки и единообразие возраста, эпидемиологической ситуации, в условиях которой формируются обследуемые группы.
9.1.1.2. Первый сбор сывороток должен быть осуществлен непосредственно перед вакцинацией (сентябрь-октябрь) и содержать не менее 200 образцов.
9.1.1.3. По результатам скрининга в РТГА следует отобрать не менее 50 участников испытания, имеющих наименьшие титры по отношению к антигенам вируса гриппа, входящим в состав вакцины. Из исследования исключаются лица, имеющие титр антител в РТГА 1:80 и более ко всем антигенам вакцины.
9.1.1.4. Второй сбор сывороток у отобранных для испытания участников проводят спустя 21 сутки (минимум) или 28 суток (максимум) после вакцинации.
9.1.2. Оценка иммунологической эффективности вакцин проводится согласно Приложению 4 к методическим указаниям.
9.1.3. Сведения о возможности переноса критериев оценки иммунологической эффективности, установленных для взрослых, на педиатрическую популяцию весьма противоречивы, в связи с чем, наиболее адекватной оценкой эффективности вакцин для детей, считается оценка их профилактической эффективности. В этом случае наряду с оценкой иммунологической эффективности проводится оценка профилактической эффективности.
9.2. В связи с тем, что живые аттенуированные или рекомбинантные вакцины могут способствовать выработке специфического секреторного или клеточного иммунитета, иммунологические критерии, установленные для инактивированных вакцин, для них могут быть не всегда корректны. В таких случаях наряду с оценкой иммунологической эффективности проводится оценка профилактической эффективности. Профилактическая эффективность препарата вакцины против гриппа оценивается путем сравнения долей заболевших гриппом в группе привитых и в группе непривитых (контрольных).
9.2.1. Объективной оценкой заболевания гриппом является лабораторное подтверждение, с этой целью проводится исследование методом полимеразной цепной реакции с зарегистрированными в Российской Федерации наборами реагентов с идентификацией субтипа гриппа и проведением углубленного молекулярно-генетического анализа вирусов гриппа в одном из референс-центров Роспотребнадзора по мониторингу за гриппом.
9.2.2. Формируются 2 группы добровольцев, одна из них - группа вакцинированных, вторая является контрольной (невакцинированные).
9.2.2.1. При формировании групп соблюдают единообразие возраста и эпидемиологической ситуации, в условиях которой формируются обследуемые группы. Объем репрезентативной выборки в каждой группе рассчитывается исходя из статистических критериев, основываясь на прогнозируемой заболеваемости гриппом, и должен увеличиваться по мере снижения ожидаемой заболеваемости.
9.2.2.2. За обеими группами проводится эпидемиологическое наблюдение в течение всего эпидемического сезона (с момента вакцинации до конца мая), и при появлении клинических проявлений острой респираторной инфекции, у участника испытаний (любой группы) берут мазки из верхних дыхательных путей для проведения лабораторного обследования.
9.2.3. По окончании эпидемического сезона проводят расчет индекса эффективности, и коэффициента эффективности (коэффициент защищенности) согласно Приложению 5 к методическим указаниям.
X. Описание метода РТГА
10.1. Метод основан на способности вирусов гриппа прикрепляться посредством гемагглютинина к эритроцитам человека, кур, морской свинки и других млекопитающих, вызывая образование своеобразной решетки, связывая два эритроцита.
10.1.1. Эритроциты, которые не связались вирусом гриппа, оседают на дно лунки и образуют "пуговицу". Эритроциты, прикрепившиеся к вирусным частицам, образуют решетку, покрывающую лунку, и получается "зонтик".
10.1.2. Подсчитано, что 1 гемагглютинирующая единица (ГАЕ) различных типов и субтипов вируса гриппа содержит приблизительно 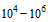 вирусных частиц.
вирусных частиц.
10.1.3. Реакция торможения гемагглютинации позволяет определить уровень антител к вирусу гриппа в образцах сыворотки.
10.1.4. Суть реакции торможения гемагглютинации в том, что антитела к вирусу гриппа препятствуют прикреплению вируса к эритроцитам. Поэтому, если в сыворотке есть антитела к данному или родственному штамму и если их количество достаточно для связывания 4 ГАЕ вируса, гемагглютинация подавляется в присутствии сыворотки. В этом случае гемагглютинации в лунках наблюдаться не будет, пока разведение сыворотки не приведет к такому разбавлению антител, что их будет недостаточно для торможения гемагглютинации.
10.1.5. Наивысшее разведение сыворотки (наименьшая концентрация антител), останавливающее гемагглютинацию, называется титром сыворотки в РТГА.
10.2. Анализ занимает не более 30 минут и поэтому часто используется в лабораториях для определения относительных количеств вирусных частиц в свежеприготовленной вируссодержащей аллантоисной или культуральной жидкости.
10.3. Постановка РТГА (Приложение 2 к методическим указаниям) включает следующие этапы работы: получение препарата антигена вируса гриппа, определение его титра в реакции гемагглютинации, подготовка сывороток, приготовление взвеси эритроцитов, и постановка реакции.
XI. Нормативные и методические документы
11.1. Федеральный закон от 17.09.1998 N 157-ФЗ (ред. от 31.12.2014) "Об иммунопрофилактике инфекционных болезней".
11.2. Санитарно-эпидемиологические правила СП 3.1/3.2.3146-13 "Общие требования по профилактике инфекционных и паразитарных болезней".
11.3. Санитарно-эпидемиологические правила СП 3.1.2.3117-13 "Профилактика гриппа и других острых респираторных вирусных инфекций".
11.4. Методические указания. МУ 3.3.2.1758-03 "Методы определения показателей качества иммунобиологических препаратов для профилактики и диагностики гриппа".
11.5. Приказ Роспотребнадзора от 31.03.2005 N 373 "О совершенствовании системы эпидемиологического надзора и контроля за гриппом и острыми респираторными вирусными инфекциями" (вместе с "Положением об организации деятельности Федерального центра по гриппу и острым респираторным вирусным инфекциям", "Положением об организации деятельности опорной базы Федерального центра по гриппу и острым респираторным вирусным инфекциям", "Положением об организации деятельности Центра экологии и эпидемиологии гриппа", "Положением об организации деятельности опорной базы Центра экологии и эпидемиологии гриппа", "Порядком представления информации по форме "Срочное донесение о заболеваемости гриппом и острыми респираторными вирусными инфекциями (ОРВИ)", "Порядком представления донесений о результатах лабораторных исследований в опорных базах Федерального центра по гриппу и ОРВИ и Центра экологии и эпидемиологии гриппа", "Порядком представления информации о заболеваемости гриппом и острыми респираторными вирусными инфекциями Федеральным центром по гриппу и острым респираторным вирусным инфекциям и Центром экологии и эпидемиологии гриппа").
11.6. Приказ Роспотребнадзора от 30.09.2013 N 714 "Об организации мониторинга за циркуляцией вирусов гриппа птиц".
XII. Список сокращений
МУ - методические указания
ПЦР - полимеразная цепная реакция
РТГА - реакция торможения гемагглютинации
РНК - рибонуклеиновая кислота
RDE - фермент, разрушающий неспецифические ингибиторы
СГТ - среднегеометрический титр
ФСБР - фосфатно-солевой буферный раствор
Приложение 1
к методическим указаниям
МУ 3.1.3490-17
Порядок сбора, транспортирования и хранения сывороток крови
1. Техника взятия и первичная обработка крови (не для станций переливания крови)
При проведении исследований по мониторингу популяционного иммунитета в организованных коллективах детей и учащихся составляется список обследованных лиц, в котором указываются город (район), номер детского дошкольного учреждения, группы, школы, класса, номер среднего специального учреждения, группы, название вуза, факультета, группы, регистрационный номер, фамилия, имя пациента, дата рождения, дата прививок против гриппа, дата взятия крови, подпись ответственного лица.
Капиллярную кровь берут из пальца в асептических условиях. Перед взятием крови кисть руки пациента согревают горячей водой, затем насухо вытирают чистым полотенцем. Палец, протерев 70% спиртом, прокалывают стерильным скарификатором одноразового пользования. Кровь в объеме 1,0-1,5 мл собирают непосредственно через край стерильной одноразовой центрифужной пробирки с пробкой (или в специальные микропробирки для взятия капиллярной крови). После взятия крови место укола смазывают 5% раствором йода.
При определении антител к вирусам гриппа животных у людей из групп риска, при оценке эффективности вакцинации и оценке эффективности вакцины берут кровь из вены в асептических условиях в объеме не менее 3 мл.
Пробирку следует пронумеровать и приложить к ней этикетку с указанием регистрационного номера, фамилии, инициалов, даты взятия крови.
Для получения сывороток пробирку с кровью ставят в кабинете, где проводился забор крови, при комнатной температуре на 20-30 мин для образования сгустка, после чего пробирку с кровью встряхивают для отделения сгустка от стенки пробирки.
Пробирки вместе со списками направляют в клинико-диагностическую лабораторию ЛПО, где пробирки с кровью оставляют на ночь в холодильнике при температуре 4-8°C.
После отделения сыворотки от сгустка (пробирки обводят по внутренней поверхности стерильной пастеровской пипеткой) ее центрифугируют при 1000-1200 об./мин в течение 15-20 мин. Затем сыворотку осторожно переливают или переносят пипеткой в стерильные центрифужные (пластиковые) пробирки с обязательным переносом на них этикетки с соответствующей пробирки.
В лаборатории сыворотки (без сгустка) до исследования можно хранить в холодильниках при температуре (5 +/- 3)°C в течение 7 дней. При более длительном хранении сыворотка должна быть заморожена при -20°C или ниже. Не допускается повторное замораживание размороженной сыворотки. Собрав необходимое количество сывороток, их отправляют в лабораторию ФБУЗ "Центр гигиены и эпидемиологии" Роспотребнадзора в субъекте Российской Федерации на исследование.
2. Транспортирование образцов сыворотки (крови)
Перед транспортированием собранного материала из района обследования очень важно принять меры предосторожности: проверить наличие собранной информации, прочно закрыть пробирки пробкой, расположить пробы согласно их номерам и пр. На месте сбора следует хранить списки обследованных лиц. Для транспортирования сыворотки крови используют термоконтейнеры (сумки-холодильники). В течение всего периода транспортировки сыворотки должны оставаться при температуре -20°C или ниже.
При пересылке проб железнодорожным или воздушным транспортом лаборатории необходимо известить (по телефону, телеграммой) о номере поезда (рейса), дате и времени отправки и прибытия, количестве проб и пр.
Приложение 2
к методическим указаниям
МУ 3.1.3490-17
Проведение реакции торможения гемагглютинации (РТГА)
Подготовка сывороток
Материалы
1. Фермент, разрушающий неспецифические ингибиторы - RDE.
2. ФСБР - фосфатно-солевой буферный раствор.
3. Пробирки, пипетки.
4. Водяная баня.
Процедура
Сыворотки крови животных и людей содержат различные полисахариды, включающие сиаловые кислоты, которые могут прикрепляться к гемагглютинину вируса гриппа и затруднять связывание специфических в отношении гриппа гемагглютинирующих антител. Для удаления этих неспецифических ингибиторов гемагглютинации образцы сыворотки обрабатываются ферментом RDE, разрушающим сиаловые кислоты. Работа проводится в ламинарном боксе II класса биобезопасности.
1. Быстро разморозьте исследуемые сыворотки крови при +37°C на водяной бане. Сразу после разморозки поместите сыворотки в лед и держите на льду во время использования.
2. Добавьте 40 мкл образца сыворотки в пробирку.
3. Добавьте 120 мкл RDE в каждую пробирку.
4. Закройте пробирки пробками.
5. Выдерживайте на водяной бане при +37°C от 18 до 20 часов.
6. Затем поместите пробирки в водяную баню при +56°C на 30 минут.
7. Добавьте 240 мкл ФСБР, pH = 7,2 в каждую пробирку. Конечное разведение сыворотки имеет соотношение 1:10. Конечный объем 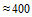 мкл.
мкл.
8. Оставьте на ночь при +4°C. Если необходимо более долгое хранение, заморозьте до -20°C или ниже.
Подготовка эритроцитов
Материалы
1. Кровь человека группы 0 или морской свинки в буфере Олсвера должна быть свежей. Для работы с некоторыми антигенами штаммов вируса гриппа могут быть использованы эритроциты петуха, индейки или лошади. Допустимо хранение эритроцитов при +4°C не более 1 недели.
2. Стерильная хлопковая марлевая салфетка.
3. Физиологический раствор с ФСБР (0,01 M ФСБР, pH = 7,2). Должен быть холодным. Хранить при температуре +4°C и держать на льду или при +4°C во время использования.
4. 70% этанол в деионизованной воде.
5. Конические центрифужные пробирки для отмывания эритроцитов.
6. Стерильные пипетки.
Примечание. 0,5% эритроциты готовятся в тот же день, когда тестируются сыворотки на неспецифические агглютинины, и могут храниться при +4°C для использования в РТГА на второй день. Остатки необходимо уничтожить в конце второго дня.
Процедура
1. Аккуратно наберите, используя пипетку объемом 10 мл, примерно 5 мл эритроцитов со дна колбы. Профильтруйте через стерильную хлопковую марлевую салфетку в коническую центрифужную пробирку объемом 50 мл.
2. Осторожно наполните коническую пробирку холодным ФСБР, закройте пробкой и слегка перемешайте, переворачивая пробирку.
3. Центрифугируйте при 1200 об./мин в течение 10 минут при +4°C.
4. Удалите надосадочную жидкость, используя пипетку объемом 10 мл. Будьте внимательны: не всколыхните осадок эритроцитов.
5. С осторожностью повторите промывку холодным ФСБР (пункты 2-4) еще два раза, чтобы всего было три промывки эритроцитов. Для предотвращения гемолиза всегда бережно обращайтесь с эритроцитами, держите ФСБР на льду при температуре +4°C и не промывайте эритроциты больше трех раз.
6. Удалите оставшийся супеpнатант при помощи микропипетки и храните уплотненные эритроциты на льду.
7. Приготовьте рабочую суспензию эритроцитов: добавьте 2,5 мл уплотненных эритроцитов к 247,5 мл холодного ФСБР в стеклянную колбу объемом 500 мл (сполосните колбу ФСБР перед использованием). Перемешайте с помощью вращательных движений.
8. Приготовьте раствор суспензии эритроцитов 1:100. Для этого добавьте 100 мкл эритроцитов к 9,9 мл холодного ФСБР в конической пробирке объемом 15 мл. Осторожно перемешайте, переворачивая пробирку.
9. Тщательно вымойте гемоцитометр 70% этанолом и протрите насухо бумагой для оптических стекол или мягкой тканью, не оставляющей ворса. Вымойте и просушите покровное стекло тем же способом и аккуратно положите его в гемоцитометр так, чтобы оно покрывало зону чувствительности счетчика.
10. Поместите 10 мкл разбавленных 1:100 эритроцитов в гемоцитометр, вставляя наконечник автоматической пипетки в канал и позволяя клеткам распределиться по счетной зоне. Будьте внимательны: не переполняйте канал.
11. Посчитайте эритроциты в каждом из 4 больших угловых квадратов в гемоцитометре.
12. Каждое большое поле содержит 16 маленьких полей. Обратите внимание, что предполагаемое число эритроцитов в одном большом поле составляет от 40 до 60 клеток. Если количество клеток в каждом большом поле <40, то добавьте еще уплотненных эритроцитов и посчитайте снова. Если количество клеток в каждом большом поле >70, то добавьте холодного ФСБР к суспензии эритроцитов и посчитайте снова. Если количество эритроцитов в больших полях отличается друг от друга более чем в 2 раза, то это указывает на неверную загрузку или плохое перемешивание эритроцитов, и, следовательно, необходимо провести процедуру повторно.
А. После подсчета эритроцитов сполосните гемоцитометр и покровное стекло 70% этанолом и протрите насухо.
В. Рассчитайте, какое количество холодного ФСБР необходимо добавить для получения 0,5% суспензии эритроцитов. Для этого используйте следующую формулу:
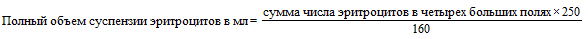
Пример:
| 1) | Количество эритроцитов в каждом большом угловом поле |
|---|---|
| 50 | |
| 48 | |
| 42 | |
| 40 | |
2) 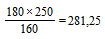 мл
мл
|
|
| 3) (281,25 мл) - (250 мл) = 31,25 мл ФСБР надо добавить к суспензии эритроцитов. | |
Адсорбция сывороток с эритроцитами для удаления неспецифических агглютининов
Присутствие неспецифических агглютининов в образцах сывороток может привести к ложноотрицательному результату в РТГА. Наличие неспецифических агглютининов можно обнаружить, если к разбавленной сыворотке добавить раствор эритроцитов. Если наблюдается гемагглютинация, то в этом случае сыворотка должна быть адсорбирована с эритроцитами перед тестированием в реакции торможения гемагглютинации.
Материалы
1. Эритроциты человек группы 0 или морской свинки.
2. Физиологический раствор с ФСБР (0,01 M ФСБР, pH = 7,2). Должен быть холодным. Хранить при температуре +4°C и во время использования держать на льду.
3. Образцы сывороток, обработанных RDE.
4. Полистироловый 96-луночный микропланшет с V-образным дном.
5. Стерильные пипетки.
6. Одноразовые наконечники для многоканальных пипеток.
7. Микроцентрифужные пробирки.
Тестирование неспецифических агглютининов
(работа в ламинарном боксе II класса биобезопасности!)
1. Разделите планшет с V-образным дном пополам, прочертив линию маркером со стойкими чернилами между рядами D и E. Лунки рядов A и E будут служить для внесения в них сывороток. Сыворотки из ряда A будут тестироваться между рядами A и D. Сыворотки из ряда E будут тестироваться между рядами E и H.
2. Добавьте 25 мкл холодного ФСБР в лунки от ряда B до ряда D (с B1-B10 до D1-D10) для сывороток, которые будут протестированы в планшете торможения гемагглютинации N 1, и в лунки от ряда F до ряда H (с F1-F10 до H1-H10) для сывороток, которые будут протестированы в планшете торможения гемагглютинации N 2.
3. Добавьте по 50 мкл каждой сыворотки в лунки A1-A10 и E1-E10, соответствующие пронумерованным колонкам. В каждом планшете будет содержаться 22 образца сывороток.
4. Произведите серию двукратных разведений, перенося 25 мкл сыворотки из первого ряда в последующие ряды. Другими словами, перенесите из A в B, из B в C и из C в D. Удалите 25 мкл после ряда D. Также перенесите 25 мкл из E в F, из F в G, из G в H. Удалите 25 мкл после ряда H.
5. Добавьте 25 мкл холодного ФСБР во все лунки, содержащие сыворотки; колонки 1-10.
6. Добавьте 50 мкл холодного ФСБР в колонку 12 на планшете в качестве контроля эритроцитов. Колонка 11 остается пустой.
7. Слегка постучите по планшету, чтобы сыворотки хорошо перемешались с ФСБР.
8. Добавьте 50 мкл 0,5% эритроцитов во все лунки, кроме 11-й колонки.
9. Слегка постучите по планшету для лучшего перемешивания.
10. Выдержите при комнатной температуре в течение 30 минут, чтобы эритроциты смогли осесть.
11. Наклоните планшет под углом от 45° до 60°. Осевшие эритроциты в колонке 12 должны "потечь", напоминая слезу, под воздействием гравитации. Дождитесь, пока эти эритроциты не перестанут течь, и после этого запишите, в каких сыворотках произошла агглютинация эритроцитов. Агглютинированные эритроциты не "текут" и не образуют капли наподобие слезы.
12. Образцы сывороток с агглютинированными эритроцитами в лунках с разведением сыворотки 1:20 или больше должны быть адсорбированы с эритроцитами до тестирования в РТГА. Если агглютинация наблюдается только в первой лунке - разведение сыворотки 1:10, - тогда адсорбция необязательна.
Адсорбция сывороток с эритроцитами
(работа в ламинарном боксе II класса биобезопасности!)
1. Смешайте в микроцентрифужной пробирке 100 мкл уплотненных эритроцитов с 400 мкл сыворотки, обработанной RDE.
2. Осторожно переверните, чтобы перемешать содержимое, и выдержите 30 минут при температуре +4°C.
3. Снова осторожно переверните и выдержите еще 30 минут при температуре +4°C.
4. Центрифугируйте в микроцентрифуге Эппендорф при 600 x g в течение 5 минут.
5. Аккуратно соберите сыворотку, не затрагивая эритроциты.
Определение титра гемагглютинина вируса гриппа
Материалы
1. 0,5% суспензия эритроцитов человека группы 0 или морской свинки в ФСБР.
2. Физиологический раствор с ФСБР (0,01 M ФСБР, pH = 7,2). ФСБР необходимо хранить при температуре +4°C.
3. Антиген вируса гриппа.
Примечание. Антиген вируса гриппа должен храниться при температуре -70°C в аликвотах одноразового использования. Быстро разморозьте антиген вируса незадолго до использования и положите на лед. После работы все остатки антигена вируса гриппа должны быть утилизированы. Никогда не используйте размороженный и повторно замороженный антиген вируса гриппа.
4. Полистироловый 96-луночный микропланшет с V-образным дном.
5. Стерильные пипетки, одноразовые наконечники для многоканальных пипеток.
Процедура
1. На V-образных планшетах подпишите названия двух антигенов вирусов, которые вы будете использовать в тесте. Каждый антиген вируса тестируется дважды.
2. Добавьте 50 мкл холодного ФСБР в лунки со 2 по 12 в рядах A и B для первого антигена и в лунки со 2-й по 12-ю в рядах D и E для второго антигена.
3. Добавьте 50 мкл холодного ФСБР во весь ряд H. Этот ряд будет выполнять функцию контроля эритроцитов.
4. Добавьте 100 мкл первого антигена для тестирования в лунки A1 и B1. Добавьте 100 мкл второго тестируемого антигена в лунки D1 и E1.
5. Проведите серию двукратных разведений, перенеся 50 мкл из первой лунки в каждую последующую до 12-й лунки. Из 12 лунки удалите 50 мкл.
6. Добавьте 50 мкл 0,5%-й суспензии эритроцитов во все лунки в рядах A, B, D, E и H на планшете.
7. Аккуратно постучите по планшету, чтобы перемешать содержимое.
8. Выдержите при комнатной температуре или при + 4° С в течение 30 минут.
9. Определите титры гемагглютининов, наклонив планшет под углом от 45° до 60°. Осевшие эритроциты в ряду H должны "потечь" и образовать каплю. Дождитесь, пока эти эритроциты не перестанут течь, после чего отметьте те лунки, в которых эритроциты образовали "пуговки" и потекли. Наибольшее разведение антигена, которое дает полную гемагглютинацию ("зонтик"), считается титром гемагглютинина.
10. Разведите антиген вируса в холодном ФСБР таким образом, чтобы приготовить рабочий раствор, содержащий 8 ГАЕ/50 мкл. Например, у Вас получился титр HA, равный 160. Разделите его на 8, получите 20. Следовательно, необходимо разбавить исходный вирусный антиген в 20 раз, т. е. смешать 1 часть антигена с 19 частями холодного ФСБР.
11. Убедитесь в том, что разведенный антиген содержит 8 ГАЕ на 50 мкл, проведя вторую реакцию гемагглютинации (РГА), как описано выше. Титр вирусного антигена должен равняться 8. Если у Вас получилось другое число, использовать этот рабочий раствор антигена нельзя!
12. Храните рабочее разведение антигена на льду и используйте в тот же день.
Примечание. Стандартное рабочее разведение вирусного антигена должно иметь титр HA, равный 8 ГАЕ в 50 мкл. Это то же самое, что и 4 ГАЕ в 25 мкл. При таком титре наблюдается гемагглютинация в первых четырех лунках при титровании антигена в РГА. Если полная гемагглютинация наблюдается в 5 лунках, антиген имеет титр 16 ГАЕ/50 мкл и тестовый антиген должен быть разбавлен в 2 раза. И наоборот, если гемагглютинация наблюдается только в 3 лунках, то антиген имеет титр 4 ГАЕ/50 мкл. В этом случае к рабочему разведению антигена надо добавить такой же объем исходного антигенного раствора, какой был взят вначале. Это удвоит концентрацию антигена в рабочем разведении, чтобы дать титр 8 ГАЕ/50 мкл. Если после 1-2 исправлений у вас так и не получился титр 8 ГАЕ/50 мкл, процедуру приготовления рабочего раствора антигена лучше повторить сначала с постановки реакции гемагглютинации.
Реакция торможения гемагглютинации (протокол)
Материалы
1. 0,5% суспензия эритроцитов в ФСБР.
2. Физиологический раствор с ФСБР (0,01 M ФСБР, pH = 7,2). ФСБР необходимо хранить при температуре +4°C.
3. Диагностикумы гриппозные сухие для РТГА (применять согласно инструкции изготовителя).
4. Вирус гриппа, инактивированный бета-пропиолактоном (BPL-антиген). Аликвоты аллантоисной или культуральной антигенсодержащей жидкости хранить при -70°С.
5. Образцы сывороток, обработанные RDE, тестированные на неспецифические агглютинины эритроцитов.
Примечание. Сыворотка должна быть заморожена один раз и храниться при температуре от -20 до -70°C.
6. Полистироловый 96-луночный микропланшет с V-образным дном. В каждом планшете может быть протестировано 11 образцов сывороток.
7. Стерильные пипетки.
8. Конические центрифужные пробирки для разведения антигена.
9. Одноразовые наконечники для многоканальных пипеток.
Процедура
1. Быстро разморозьте сыворотки на водяной бане при +37°C. Как только сыворотки растают, держите их на льду во время работы.
2. Пронумеруйте планшеты и подпишите названия двух тестируемых антигенов. Сыворотки тестируются в повторах на двух идентичных планшетах.
3. Добавьте 25 мкл холодного ФСБР в ряды от B до H (от B1-B11 до H1-H11).
4. Добавьте 50 мкл каждого образца сывороток в первую лунку (A1-A10).
5. Внесите 50 мкл положительного контроля в лунку А11 одного планшета и отрицательного контроля в лунку A11 второго планшета.
6. Проведите серию двукратных разведений, перемещая 25 мкл сыворотки из A1-11 в лунки последующих рядов. Последние 25 мкл сыворотки из ряда H утилизируйте.
7. Добавьте 25 мкл рабочего раствора антигена, содержащего 4 ГАЕ, в лунки, содержащие сыворотки. Обратите внимание на то, что это то же самое, что 50 мкл, содержащих 8 ГАЕ.
8. Аккуратно постучите по планшету, чтобы перемешать содержимое.
9. Выдержите при комнатной температуре в течение 30 минут.
10. Добавьте 50 мкл ФСБР в колонку 12, что послужит контролем эритроцитов.
11. Добавьте 50 мкл 0,5% суспензии эритроцитов в каждую лунку.
12. Аккуратно постучите по планшету, чтобы перемешать содержимое.
13. Выдержите при комнатной температуре или при + 4°С в течение 30 минут.
14. Результат оценивают через 30 минут инкубирования, наклонив планшет под углом от 45° до 60°C. Осевшие эритроциты в колонке 12 должны "потечь" и образовать каплю. Дождитесь, пока эти эритроциты не перестанут течь, после чего отметьте те лунки, в которых эритроциты образовали "пуговки" и потекли так же, как в 12-й колонке. Лунки, где произошло полное торможение гемагглютинации, будут выглядеть как контрольные.
Если произошло взаимодействие антиген/антитело, гемагглютинация эритроцитов будет ингибирована. Для записи данных следует пользоваться следующими знаками: знак "+" - для полной гемагглютинации ("зонтик"), знак "+/-" - для частичной гемагглютинации и знак "-" - для торможения гемагглютинации ("пуговка"). Титр в РТГА соответствует наибольшему разведению сыворотки, которое полностью тормозит гемагглютинацию (последняя "пуговка"). Необходимо внимательно следить за инкубацией. Если реакция проведена при комнатной температуре результат следует прочитать сразу после того, как эритроциты в контроле полностью осядут. Если реакция проведена при температуре +4°С результат можно прочитать в течение 0,5-1 часа после того, как эритроциты в контроле полностью осядут.
15. Титр сыворотки в РТГА - это разведение сыворотки в последней лунке с полным торможением гемагглютинации, например, 1:640. Обратный титр сыворотки - это величина, обратная титру, например, 640.
Приложение 3
к методическим указаниям
МУ 3.1.3490-17
Расчет среднегеометрических титров антител (СГТ)
Для проведения расчета СГТ титр антител в РТГА менее 1:10 принимают равным 1:5. Титр антител в РТГА равный или более 1:1280 принимают равным 1:1280. Для определения СГТ обратные титры антител переводят в логарифмы по основанию 2, суммируют и делят на число исследованных сывороток. Полученную в результате деления цифру используют как показатель степени числа 2, а число, получившееся после возведения 2 в эту степень, представляет собой обратный среднегеометрический титр сывороток исследуемой группы добровольцев.
Образец расчета СГТ:
| Количество обследованных сывороток | Количество сывороток с указанными титрами антител | Доля серонегативных лиц, % | СГТ | ||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
<1:10
(2,3  )
)
|
1:10
(3,3 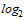 )
)
|
1:20
(4,3 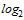 )
)
|
1:40
(5,3 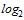 )
)
|
1:80
(6,3 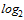 )
)
|
1:160
(7,3 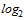 )
)
|
1:320
(8,3 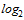 )
)
|
1:640
(9,3 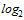 )
)
|
>=1:1280
(10,3  )
)
|
|||
| 148 | 10 | 20 | 68 | 40 | 10 | 0 | 0 | 0 | 0 | 66 | 1:22 |
из 148 исследованных сывороток 10 имели титр менее 1:10; 20 - титр 1:10; 68 - титр 1:20; 40 - титр 1:40 и 10 - титр 1:80. Переведя абсолютные значения титров в логарифмы по основанию 2, получим следующую величину среднегеометрического титра (СГТ) антител:
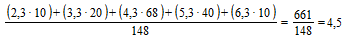 .
. 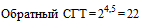 . СГТ = 1:22.
. СГТ = 1:22.
Приложение 4
к методическим указаниям
МУ 3.1.3490-17
Оценка иммунологической эффективности вакцин
При оценке иммунологической эффективности вакцин против гриппа пользуются критериями, определенными Европейским медицинским агентством (COMMITTEE FOR PROPRIETARY MEDICINAL PRODUCTS (CPMP); http://www.ema.europa.eu/docs/en_GB/document_library/Scientific_guideline/2009/09/WC500003945.pdf).
Определяют фактор сероконверсии, уровень сероконверсии и уровень серопротекции:
- Фактор сероконверсии - кратность нарастания среднегеометрического титра (СГТ) антител после вакцинации по сравнению со среднегеометрическим титром до вакцинации;
- Уровень сероконверсии - суммарная доля лиц, выраженная в процентах, с повышением титра от серонегативного (<1:40) до серопозитивного 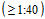 или с четырехкратным приростом титра антител после вакцинации, если до вакцинации титр был
или с четырехкратным приростом титра антител после вакцинации, если до вакцинации титр был 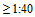 ;
;
- Уровень серопротекции - доля лиц, выраженная в процентах, с защитным титром антител 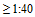 через 21-28 дней после вакцинации.
через 21-28 дней после вакцинации.
Измерение титров антител проводится одновременно в парных сыворотках крови, взятых непосредственно до и через один месяц после вакцинации.
По крайней мере, один из параметров должен отвечать требованиям, представленным в таблице.
| Параметры иммуногенности вакцины гриппа | возраст | |
|---|---|---|
| 18-60 лет | Старше 60 лет | |
| Фактор сероконверсии | Более 2,5 | Более 2,0 |
| Уровень сероконверсии | Более 40% | Более 30% |
| Уровень серопротекции | Более 70% | Более 60% |
Приложение 5
к методическим указаниям
МУ 3.1.3490-17
Оценка профилактической эффективности вакцин
Оценка профилактической эффективности вакцин против гриппа проводится путем расчета индекса эффективности и коэффициента эффективности по следующим формулам:
Индекс эффективности: K = b / a,
где а - доля заболевших гриппом среди вакцинированных,
b - доля заболевших гриппом среди невакцинированных.
Коэффициент эффективности: E = 100% х (b - a) / b,
где а - доля заболевших гриппом среди вакцинированных,
b - доля заболевших гриппом среди невакцинированных.
Приложение 6
к методическим указаниям
МУ 3.1.3490-17
ТАБЛИЦЫ ДЛЯ ОФОРМЛЕНИЯ РЕЗУЛЬТАТОВ
Таблица 1
Результаты РТГА для серомониторинга гриппа
| Субъект Российской Федерации |
N п/п |
ФИО или идентификационный код | Пол | Возраст | Наличие вакцинации против гриппа за последние 2 года | Наличие контакта с животными или птицей | Дата сбора образца сыворотки | Титр в РТГА с антигеном (в обратных величинах) | ||
|---|---|---|---|---|---|---|---|---|---|---|
| A(H1N1) | A(H3N2) | В | ||||||||
| "____" ____________ 20__ г. | Руководитель лаборатории |
|---|
Таблица 2
Учет заболеваемости гриппом лиц, вакцинированных против гриппа
| Субъект РФ | ФИО или идентификационный код | Наименование вакцины | Возбудитель (ПЦР) | Состояние противогриппозного иммунитета после вакцинации (РТГА) | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| H1N1 | H3N2 | B | H1N1 | H3N2 | B | |||||||||
| <1:20 | 1:20-1:40 | >1:40 | <1:20 | 1:20-1:40 | >1:40 | <1:20 | 1:20-1:40 | >1:40 | ||||||
| "____" ____________ 20__ г. | Руководитель лаборатории |
|---|
Таблица 3
Оценка эффективности вакцинации против гриппа
| Субъект РФ | Наименование вакцины | Антигенная формула вируса гриппа* | Количество обследованных сывороток | Количество сывороток с указанными титрами антител | Доля** серонегативных лиц,% | Среднегеометрические титры антител | ||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
<1:10
(2,3 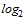 )
)
|
1:10
(3,3 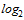 )
)
|
1:20
(4,3 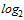 )
)
|
1:40
(5,3 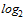 )
)
|
1:80
(6,3  )
)
|
1:160
(7,3 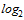 )
)
|
1:320
(8,3 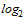 )
)
|
1:640
(9,3 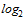 )
)
|
>=1:1280
(10,3 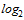 )
)
|
||||||
| Титр противогриппозных антител в популяции до вакцинации | ||||||||||||||
| А (H1N1) | ||||||||||||||
| А (H3N2) | ||||||||||||||
| В | ||||||||||||||
| А (H1N1) | ||||||||||||||
| А (H3N2) | ||||||||||||||
| В | ||||||||||||||
| А (H1N1) | ||||||||||||||
| А (H3N2) | ||||||||||||||
| В | ||||||||||||||
| Титр противогриппозных антител у привитых через 1 месяц после вакцинации | ||||||||||||||
| А (H1N1) | ||||||||||||||
| А (H3N2) | ||||||||||||||
| В | ||||||||||||||
| А (H1N1) | ||||||||||||||
| А (H3N2) | ||||||||||||||
| В | ||||||||||||||
| А (H1N1) | ||||||||||||||
| А (H3N2) | ||||||||||||||
| В | ||||||||||||||
| Титр противогриппозных антител в популяции после окончания эпидсезона | ||||||||||||||
| А (H1N1) | ||||||||||||||
| А (H3N2) | ||||||||||||||
| В | ||||||||||||||
| А (H1N1) | ||||||||||||||
| А (H3N2) | ||||||||||||||
| В | ||||||||||||||
| А (H1N1) | ||||||||||||||
| А (H3N2) | ||||||||||||||
| В | ||||||||||||||
Примечание:
* Используются только диагностические штаммы, рекомендованные для производства вакцины.
** - с титром антител 1:20 и ниже.
| "____" ____________ 20__ г. | Руководитель лаборатории |
|---|
|
Руководитель Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека, Главный государственный санитарный врач Российской Федерации |
А.Ю. Попова |
Обзор документа
Утвержены методические указания по изучению популяционного иммунитета к гриппу у населения России (МУ 3.1.3490-17).
Документ устанавливает порядок и организацию проведения серологического мониторинга в рамках эпидемиологического надзора за гриппом. Это необходимо для прогнозирования эпидемиологической ситуации, мониторинга за циркуляцией возбудителей гриппа и объективной оценки эффективности специфической профилактики гриппа.
В методических указаниях представлен общий методический подход, порядок организации и проведения лабораторных исследований по оценке популяционного иммунитета к гриппу. Приведены оценки эффективности вакцинации и вакцин.
Методические указания предназначены для применения в организациях и учреждениях Роспотребнадзора, в лечебно-профилактических и других организациях, обеспечивающих выполнение противоэпидемических мероприятий.



(1).jpg)


