Проект Постановления Правительства Российской Федерации "О внесении изменений в Правила формирования перечней лекарственных препаратов для медицинского применения и минимального ассортимента лекарственных препаратов, необходимых для оказания медицинской помощи" (подготовлен Минздравом России 05.06.2017)
Досье на проект
Правительство Российской Федерации постановляет:
Утвердить прилагаемые изменения, которые вносятся в Правила формирования перечней лекарственных препаратов для медицинского применения и минимального ассортимента лекарственных препаратов, необходимых для оказания медицинской помощи, утвержденные постановлением Правительства Российской Федерации от 28 августа 2014 г. N 871.
| Председатель Правительства Российской Федерации | Д. Медведев |
УТВЕРЖДЕНЫ
постановлением Правительства Российской Федерации
от ______________ г. N _____
Изменения,
которые вносятся в Правила формирования перечней лекарственных препаратов для медицинского применения и минимального ассортимента лекарственных препаратов, необходимых для оказания медицинской помощи
1. В пункте 2:
а) после слов "стандартов медицинской помощи" дополнить словами ", результатов клинической апробации";
б) подпункт "г" изложить в следующей редакции:
"г) лекарственный препарат имеет лекарственную форму, предусмотренную перечнем утвержденным уполномоченным федеральным органом исполнительной власти.".
2. Пункт 6 дополнить подпунктом "ж" следующего содержания:
"ж) по результатам анализа информации о сравнительной клинической эффективности и безопасности лекарственного препарата, оценки экономических последствий его применения, изучении дополнительных последствий применения лекарственного препарата (далее - комплексная оценка) проводимой в рамках фармакотерапевтических групп.".
3. Дополнить пунктом 61 следующего содержания:
"61. В перечни и минимальный ассортимент не рекомендуются к включению комбинированные лекарственные препараты, и/(или) комбинации лекарственных препаратов, за исключением лекарственных препаратов, предназначенных для лечения заболевания, вызываемого вирусом иммунодефицита человека (ВИЧ-инфекции), туберкулеза, бронхиальной астмы и хронической обструктивной болезни легких, растворов для инфузий для коррекции водно-электролитного баланса, а также в случае клинической нецелесообразности применения лекарственного препарата без соответствующего кофактора терапии.".
4. В пункте 11 слова "Министерства регионального развития Российской Федерации" исключить.
5. Пункт 13 изложить в следующей редакции:
"13. Субъекты обращения лекарственных средств и (или) общественные объединения, осуществляющие деятельность в сферах здравоохранения, обращения лекарственных средств и защиты прав граждан в этих сферах (далее - заявители), направляют ежегодно в комиссию не позднее 15 января включительно на бумажном носителе и в электронном виде по форме, установленной Министерством здравоохранения Российской Федерации, следующие предложения с приложением соответствующих документов и сведений:".
6. В абзаце втором пункта 17 слова "1 июня" заменить словами "15 февраля".
7. В пункте 19 слова "дальнейшему рассмотрению комиссией" заменить словами "проведению комплексной оценки".
8. Пункт 20 изложить в следующей редакции:
"20. Комиссия в срок, не превышающий 7 дней со дня вынесения положительного заключения по результатам документальной экспертизы в отношении лекарственных препаратов, предлагаемых для включения (исключения) в перечни, направляет предложение с предоставлением доступа к электронным версиям представленных заявителями документов и сведений, в том числе документов регистрационного досье на лекарственный препарат, размещенным в установленном порядке на официальном сайте в сети "Интернет":
а) в профильную федеральную государственную образовательную организацию высшего образования (медицинского и (или) фармацевтического) и (или) дополнительного профессионального образования, осуществляющую в качестве уставного вида деятельности научно-исследовательскую деятельность, либо в медицинскую и (или) фармацевтическую научную организацию, подведомственную Министерству здравоохранения Российской Федерации или находящуюся в ведении Федерального агентства научных организаций (далее - экспертная организация) для проведения анализ информации о сравнительной клинической эффективности и безопасности лекарственного препарата;
б) в федеральное государственное бюджетное учреждение "Центр экспертизы и контроля качества медицинской помощи" Министерства здравоохранения Российской Федерации (далее - ФГБУ "ЦЭККМП" Минздрава России) для проведения оценки экономических последствий применения лекарственного препарата и изучения дополнительных последствий его применения.".
9. Пункт 22 изложить в следующей редакции:
"22. Анализ информации о сравнительной клинической эффективности и безопасности лекарственного препарата проводится экспертной организацией в течение 30 дней со дня получения от комиссии предложения.
Оценка экономических последствий применения лекарственного препарата и изучения дополнительных последствий его применения осуществляется ФГБУ "ЦЭККМП" Минздрава России до 15 июля текущего года.".
10. В пункте 23:
а) слово "экспертиза" заменить словами "комплексной оценки";
б) после слов "экспертная организация" дополнить словами "и ФГБУ "ЦЭККМП" Минздрава России";
в) слово "создает" заменить словом "создают".
11. В пункте 24:
а) абзац первый изложить в следующей редакции:
"24. Анализ информации заявителя о сравнительной клинической эффективности и безопасности лекарственного препарата осуществляется на основе следующих интегральных шкал клинической оценки лекарственного препарата, приведенных в приложении N 6:
а) шкала оценки уровней доказательности результатов клинических исследований лекарственных препаратов;
б) шкала оценки уровней убедительности доказательств клинических исследований лекарственных препаратов;
в) интегральная количественная оценка качества клинического исследования лекарственного препарата для медицинского применения;
г) количественная оценка эффективности применения лекарственного препарата в рамках клинических исследований;
д) количественная оценка безопасности применения лекарственного препарата в рамках клинических исследований;
е) количественная оценка дополнительной терапевтической ценности лекарственного препарата;
ж) количественная оценка дополнительных данных о лекарственном препарате.";
б) абзацы второй и третий признать утратившими силу;
в) абзац четвертый изложить в следующей редакции:
"В целях получения необходимой дополнительной информации и уточнения представленных в предложении сведений экспертная организация при проведении анализа информации о сравнительной клинической эффективности и безопасности лекарственного препарата осуществляет поиск информации о клинических исследованиях лекарственного препарата (полнотекстовые публикации прилагаются к заключению).".
12. Дополнить пунктом 241 следующего содержания:
"241. Оценка экономических последствий применения лекарственного препарата осуществляется на шкалы клинико-экономической оценки лекарственного препарата, которая приведена в приложении N 6.
Требования к представлению результатов клинико-экономических исследований приведены в приложении N 8.
Оценка экономических последствий применения лекарственного препарата проводится с использованием методов клинико-экономического анализа в сравнении с препаратами, включенными в перечни и имеющими аналогичные показания к применению. Если клиническая эффективность рассматриваемого лекарственного препарата ниже клинической эффективности препарата сравнения, экономические последствия его применения не рассматриваются.
Оценка экономических последствий применения лекарственного препарата проводится только в том случае, если исходы, изучаемые в представленных на экспертизу клинико-экономических исследованиях, совпадают с исходами, изучаемыми в представленных на экспертизу клинических исследованиях.
Оценка экономических последствий применения лекарственного препарата осуществляется в том числе на основании расчета стоимости курса (года) терапии предлагаемым лекарственным препаратом по сравнению с лекарственными препаратами, включенными в действующие перечни, исходя из расчетной цены, представляющей статистическую медиану зарегистрированных в установленном порядке цен соответствующих воспроизведенных лекарственных препаратов (при наличии).
При отсутствии зарегистрированных в установленном порядке цен на лекарственные препараты сравнение и оценка осуществляются в отношении расчетных цен на закупаемые лекарственные препараты по данным электронных площадок, на которых проводятся электронные аукционы по закупке лекарственных препаратов для государственных и муниципальных нужд. При этом расчетная цена на лекарственный препарат представляет статистическую медиану цен фактических закупок на воспроизведенные лекарственные препараты (при наличии).
При оценке дополнительных последствий применения лекарственного препарата осуществляется анализ данных о государственной регистрации, анализ обращения лекарственного препарата, подаваемого на включение (исключение) в перечни лекарственных препаратов для медицинского применения, а также лекарственных препаратов, включенных в перечни лекарственных препаратов для медицинского применения, имеющих аналогичные вносимому препарату показания к назначению в рамках соответствующих анатомо-терапевтическо-химических групп. Оценка дополнительных последствий применения лекарственного препарата может включать оценку других социально-значимых последствий применения лекарственного препарата, представленных заявителем.
ФГБУ "ЦЭККМП" Минздрава России может выносить предложения по исключению лекарственных препаратов из перечней и минимального ассортимента.
В целях получения необходимой дополнительной информации и уточнения представленных в предложении сведений ФГБУ "ЦЭККМП" Минздрава России может осуществлять систематический поиск и анализ информации о лекарственном препарате.".
13. Пункту 25 и 26 изложить в следующей редакции:
"25. По результатам комплексной оценки экспертная организация составляет заключение по форме согласно приложению N 7, а ФГБУ "ЦЭККМП" Минздрава России составляет заключение по форме согласно приложению N 9 и представляют их в комиссию на бумажном носителе и в электронном виде.
26. Заключение экспертной организации с приложением к нему предложения в течение 7 дней со дня его получения направляется комиссией эксперту (внештатному специалисту) Министерства здравоохранения Российской Федерации (далее - главный эксперт) с учетом профиля его деятельности для подготовки научно обоснованной рекомендации о включении (об исключении, отказе во включении) лекарственного препарата в перечни по этому предложению с предоставлением доступа к электронным версиям документов и сведений, в том числе документов регистрационного досье на лекарственный препарат, размещенным в установленном порядке на официальном сайте в сети "Интернет".
Заключение ФГБУ "ЦЭККМП" Минздрава России, содержащее предложение по исключению лекарственных препаратов из перечней, направляется комиссией главному эксперту в течение 7 дней со дня их получения.".
14. Абзац первый пункта 27 изложить в следующей редакции:
"27. Главные эксперты в течение 15 дней со дня получения заключения экспертной организации, а также заключения ФГБУ "ЦЭККМП" Минздрава России, содержащее предложение по исключению лекарственных препаратов из перечней, представляют в комиссию на бумажном носителе и в электронном виде подготовленные на основе анализа заключения по результатам экспертизы научно обоснованные рекомендации о включении (об исключении, отказе во включении) лекарственного препарата в перечни.".
15. В пункте 28 слова "заключением по результатам экспертизы" заменить словами "заключением экспертной организации, а также предложением ФГБУ "ЦЭККМП" Минздрава России по исключению лекарственных препаратов из перечней".
16. Пункт 31 изложить в следующей редакции:
"31. Решения по предложениям принимаются в соответствии с листами голосования членов комиссии на заседаниях комиссии, на которых рассматриваются заключения по результатам комплексной оценки, при этом главные эксперты персонально представляют подготовленные ими научно обоснованные рекомендации указанные в пунктах 27 и 29 настоящих Правил, а ФГБУ "ЦЭККМП" Минздрава России представляет подготовленные заключения, указанные в пункте 25 настоящих Правил.".
17. В пункте 33 слово "экспертиз" заменить словами "комплексной оценки".
18. В абзаце втором пункта 34:
а) после слов "экспертной организации" дополнить словами "ФГБУ "ЦЭККМП" Минздрава России";
б) слово "экспертиз" заменить словами "комплексной оценки".
19. В пункте 36 слова "Министерства регионального развития Российской Федерации" исключить.
20. В приложении N 6 к указанным Правилам:
а) в наименовании "ЭКСПЕРТИЗЫ" заменить словами "КОМПЛЕКСНОЙ ОЦЕНКИ";
б) шкалу "Количественная оценка клинико-экономической эффективности лекарственного препарата" изложить в следующей редакции:
"Шкала клинико-экономической оценки лекарственного препарата
| N | Результат оценки | Методологическое качество анализа | Балл |
|---|---|---|---|
| 1 | Клиническая эффективность рассматриваемого лекарственного препарата статистически значимо выше клинической эффективности препарата сравнения, при этом применение лекарственного препарата характеризуется меньшей стоимостью, чем применение препарата сравнения | Удовлетворительное | 10 |
| Неудовлетворительное | 0 | ||
| 2 | Клиническая эффективность рассматриваемого лекарственного препарата статистически значимо выше клинической эффективности препарата сравнения, при этом применение лекарственного препарата требует меньших затрат здравоохранения в рамках программы государственных гарантий бесплатного оказания гражданам медицинской помощи | Удовлетворительное | 9 |
| Неудовлетворительное | 0 | ||
| 3 |
Клиническая эффективность рассматриваемого лекарственного препарата статистически значимо выше клинической эффективности препарата сравнения, при этом применение лекарственного препарата не требует существенного увеличения затрат здравоохранения (находятся в пределах 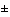 10%) в рамках программы государственных гарантий бесплатного оказания гражданам медицинской помощи
10%) в рамках программы государственных гарантий бесплатного оказания гражданам медицинской помощи
|
Удовлетворительное | 8 |
| Неудовлетворительное | 0 | ||
| 4 | Клиническая эффективность рассматриваемого лекарственного препарата статистически значимо выше клинической эффективности препарата сравнения, при этом применение лекарственного препарата требует увеличения затрат здравоохранения в рамках программы государственных гарантий бесплатного оказания гражданам медицинской помощи | ||
| 4.1 | инкрементный показатель "затраты/эффективность" рассматриваемого лекарственного препарата существенно ниже (более чем на 10%), чем инкрементный показатель "затраты/эффективность" лекарственных препаратов уже включенных в анализируемый перечень и применяющихся по тем же показаниям, что и рассматриваемый препарат | Удовлетворительное | 7 |
| Неудовлетворительное | 0 | ||
| 4.2 |
инкрементный показатель "затраты/эффективность" рассматриваемого лекарственного препарата сопоставим (находится в пределах 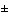 10%) с инкрементным показателем "затраты/эффективность" лекарственных препаратов уже включенных в анализируемый перечень и применяющихся по тем же показаниям, что и рассматриваемый препарат
10%) с инкрементным показателем "затраты/эффективность" лекарственных препаратов уже включенных в анализируемый перечень и применяющихся по тем же показаниям, что и рассматриваемый препарат
|
Удовлетворительное | 5 |
| Неудовлетворительное | 0 | ||
| 4.3 | инкрементный показатель "затраты/эффективность" рассматриваемого лекарственного препарата существенно выше (более чем на 10%) инкрементного показателя "затраты/эффективность" лекарственных препаратов уже включенных в анализируемый перечень и применяющихся по тем же показаниям, что и рассматриваемый препарат | Удовлетворительное | 2 |
| Неудовлетворительное | 0 | ||
| 5 | Клиническая эффективность рассматриваемого лекарственного препарата сопоставима (статистически значимые различия отсутствуют) клинической эффективности препарата сравнения | ||
| 5.1 | показатель минимизации затрат существенно ниже (более чем на 10%), чем показатель минимизации затрат для лекарственных препаратов, уже включенных в анализируемый перечень и применяющихся по тем же показаниям, что и рассматриваемый препарат | Удовлетворительное | 6 |
| Неудовлетворительное | 0 | ||
| 5.2 |
показатель минимизации затрат сопоставим (находится в пределах 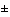 10%) с показателем минимизации затрат для лекарственных препаратов, уже включенных в анализируемый перечень и применяющихся по тем же показаниям, что и рассматриваемый препарат
10%) с показателем минимизации затрат для лекарственных препаратов, уже включенных в анализируемый перечень и применяющихся по тем же показаниям, что и рассматриваемый препарат
|
Удовлетворительное | 4 |
| Неудовлетворительное | 0 | ||
| 5.3 | показатель минимизации затрат существенно выше (более чем на 10%) показателя минимизации затрат для лекарственных препаратов, уже включенных в анализируемый перечень и применяющихся по тем же показаниям, что и рассматриваемый препарат | Удовлетворительное | 1 |
| Неудовлетворительное | 0 | ||
Примечания:
1. В случае если анализируемый лекарственный препарат не имеет аналогов в перечнях лекарственных препаратов для медицинского применения (представляет собой новый подход к лечению), инкрементный показатель "затраты/эффективность" для него сравнивается с инкрементным показателем "затраты/эффективность" для лекарственных препаратов, уже включенных в анализируемый перечень лекарственных препаратов и применяющихся при заболеваниях из того же класса Международной классификации болезней 10-го пересмотра.
2. Сравниваться должны инкрементные показатели "затраты/эффективность", рассчитанные на одинаковый клинический эффект (стоимость достижения выздоровления, ремиссии, годы сохраненной качественной жизни, годы сохраненной жизни и др.).
3. В качестве препарата сравнения используется препарат (ы), включенный(е) в перечень лекарственных препаратов для медицинского применения и применяющийся в текущей практике лечения пациентов по тем же показаниям и в такой же клинической ситуации, что и рассматриваемый препарат (препарат, предложенный к включению в перечень). Сравнение с препаратами, не включенными в перечни, допускается при отсутствии в перечне подходящих вариантов
4. Рассматривается соответствие выбора показаний к применению лекарственного препарата действующей инструкции по медицинскому применению препарата и показаниям, изученным в клинических исследованиях, которые предоставляются в качестве обоснования доказательств клинической эффективности лекарственного препарата в предложении.
5. Затраты на медицинские услуги должны быть рассчитаны на основе в действующих в системе бюджетно-страхового здравоохранения нормативов финансовых затрат и/или тарифов. При определении размера затрат недопустимо использование тарифов на платные медицинские услуги.
6. Цена препарата, подаваемого на включение в перечни, используемая для расчета затрат, должна быть не ниже цены, которая будет подаваться для государственной регистрации (предельная отпускная цена производителя). В качестве источника информации о ценах на лекарственные препараты, включенные в перечни, должен быть использован Государственный реестр предельных отпускных цен на жизненно необходимые и важнейшие лекарственные препараты.
7. Оценивается обоснованный выбор временного горизонта проведения клинико-экономического исследования c учетом объективных факторов, таких как длительность лечения или продолжительность жизни больного.
8. Выбор критериев должен быть произведен на основании обобщения анализа клинических исследований, предоставленных в предложении.
9. Зарубежные модели, использованные для проведения клинико-экономических исследований, должны быть адаптированы к системе российского здравоохранения. Должен быть представлен анализ чувствительности результатов расчетов к изменениям исходных параметров модели (колебаниям численности целевой популяции пациентов, цен на лекарственные препараты и др.). Выбор параметров для проведения анализа чувствительности должен быть обоснован.
10. Источники информации, использованные при проведении клинико-экономического исследования должны характеризовать отечественную систему здравоохранения и состояние здоровья населения в Российской Федерации. Использование зарубежных данных допускается только при отсутствии отечественных.".
21. В приложении N 7 к указанным Правилам
а) наименование изложить в следующей редакции:
"Заключение по результатам анализа информации заявителя о сравнительной клинической эффективности и безопасности лекарственного препарата";
б) пункт 6 исключить;
в) пункты 7, 8, 9, 10 считать пунктами 6, 7, 8, 9 соответственно.
22. Дополнить Правила приложениями N 8 и N 9 следующего содержания:
"Приложение N 8
к Правилам формирования перечней лекарственных препаратов
для медицинского применения и минимального ассортимента
лекарственных препаратов, необходимых для оказания
медицинской помощи
Требования
к представлению результатов клинико-экономических исследований
1. В предложении о включении/исключении лекарственных препаратов в перечни лекарственных препаратов для медицинского применения должны быть представлены результаты отечественных клинико-экономических исследований.
2. Результаты клинико-экономических исследований должны быть представлены в форме отчета и научной публикации (при наличии) по результатам проведенного клинико-экономического исследования.
3. Цена на лекарственный препарат, на основании которой были проведены клинико-экономические исследования, не должна быть ниже планируемой к государственной регистрации цены на лекарственный препарат а также предельной отпускной цены производителя, которая рассчитывается в случае включения лекарственного препарата в перечень жизненно необходимых и важнейших лекарственных препаратов с учетом положений части 3 статьи 61 Федерального закона от 12 апреля 2010 г. N 61-ФЗ "Об обращении лекарственных средств".
4. При включении лекарственных препаратов в перечень дорогостоящих лекарственных препаратов и перечень лекарственных препаратов для обеспечения отдельных категорий граждан должны быть предоставлены результаты анализа влияния на бюджет программы лекарственного обеспечения.
5. При проведении клинико-экономических исследований с использованием методов математического моделирования в приложении к отчету должны быть предоставлены математические модели, выполненные с использованием программного обеспечения (MS Excel, TreeAge Pro и др.), и текстовый файл с подробным описанием методики моделирования (описание структуры модели, основных допущений модели с их обоснованием, ключевых параметров для расчетов, использованных источников информации о значениях ключевых параметров). Зарубежные модели, использованные для проведения клинико-экономических исследований, должны быть адаптированы к системе российского здравоохранения.
6. В отчете должны быть указаны ссылки на использованные источники информации при проведении клинико-экономического исследования, при этом необходимо учитывать данные, характеризующие отечественную систему здравоохранения и состояние здоровья населения в Российской Федерации. Использование зарубежных данных допустимо при отсутствии отечественных.
7. Показания к применению, по которым проводилась клинико-экономическая оценка рассматриваемого препарата, должны соответствовать зарегистрированным в инструкции по медицинскому применению показаниям; эффективность применения препарата по этим показаниям должна подтверждаться результатами клинических исследований, предоставляемых в предложении.
8. Расчет затрат, обусловленных заболеванием (состоянием) и применением анализируемых препаратов, должен производиться на основе нормативов финансирования и/или тарифов бюджетно-страховой системы здравоохранения Российской Федерации.
9. Исходы применения препарата, учтенные в рамках клинико-экономического исследования, проведенного с использованием метода "затраты-эффективность", должны совпадать с исходами, изучаемыми в клинических исследованиях, представленных в Предложении в соответствующем разделе.
10. При наличии у рассматриваемого лекарственного препарата нескольких показаний должны быть предоставлены результаты клинико-экономических исследований применения препарата либо по всем показаниям, либо по показаниям при заболеваниях, обладающих наибольшей медико-социальной значимостью для системы здравоохранения (приводящим к наибольшей заболеваемости, смертности, инвалидизации, ассоциированной с заболеванием и др.).
11. При описании результатов клинико-экономического исследования должны быть отдельно указаны прямые медицинские (из них расходы на анализируемые лекарственные препараты в денежном выражении и в % от общих затрат), прямые немедицинские и непрямые (косвенные) затраты. Если предложенный к включению лекарственный препарат характеризуется большей эффективностью и большей стоимостью, чем препарат сравнения, для него приводится значение показателя приращения эффективности затрат (инкрементный показатель "затраты/эффективность").
Приложение N 9
к Правилам формирования перечней лекарственных препаратов
для медицинского применения и минимального ассортимента
лекарственных препаратов, необходимых для оказания
медицинской помощи
(форма)
В Комиссию Министерства здравоохранения Российской Федерации
ЗАКЛЮЧЕНИЕ
по результатам оценки экономических последствий применения лекарственного препарата и изучению дополнительных последствий его применения
1. Настоящее заключение касается материалов, представленных для:
1.1. включения лекарственного препарата в:
1.1.1. перечень жизненно необходимых и важнейших лекарственных
препаратов;
1.1.2. перечень дорогостоящих лекарственных препаратов;
1.1.3. перечень лекарственных препаратов для обеспечения отдельных
категорий граждан;
1.2. Исключения лекарственного препарата из:
1.2.1. перечня жизненно необходимых и важнейших лекарственных
препаратов;
1.2.2. перечня дорогостоящих лекарственных препаратов;
1.2.3. перечня лекарственных препаратов для обеспечения отдельных
категорий граждан.
2. Информация о сотрудниках ФГБУ "ЦЭККМП" Минздрава России, осуществляющих оценку:
2.1. Фамилия, имя, отчество, должность _____________________________;
2.2. Адрес (место нахождения) ФГБУ "ЦЭККМП" Минздрава России ____
____________________________________________________________________
телефон (факс)___________________; электронная почта____________________.
3. Информация о лекарственном препарате:
3.1. наименование:
3.1.1. международное непатентованное наименование _________________;
3.1.2. в случае отсутствия международного непатентованного наименования - группировочное наименование ____________________________;
3.1.3. в случае отсутствия международного непатентованного и группировочного наименований - химическое наименование ________________;
3.1.4. в случае отсутствия иных наименований - торговое наименование ____________________________________________________________________;
3.2. код анатомо-терапевтическо-химической (далее - АТХ) классификации лекарственного препарата ________________________________;
3.3. предлагаемые к включению или исключению лекарственные формы зарегистрированного лекарственного препарата (перечислить) _______________;
3.4. информация о воспроизведенных лекарственных препаратах (при наличии): ____________________________________________________________.
3.5 информация о лекарственных препаратах, включенных в действующий перечень лекарственных препаратов в рамках соответствующих АТХ-групп, а также лекарственных препаратах с аналогичными показаниями к применению:
____________________________________________________________________ _.
4. Сроки проведения оценки: с ____________ по ____________.
5. Результаты оценки экономических последствий применения лекарственного препарата, предлагаемого к включению в перечень или исключения его из перечня, относительно включенных в указанный перечень лекарственных препаратов, имеющих аналогичные показания:
Итоговый балл по результатам оценки сравнительной клинико-экономической эффективности лекарственного препарата по каждому показанию:
Показание______________Балл_______________
Итоговая оценка по результатам оценки сравнительной клинико-экономической эффективности лекарственного препарата (не менее + 5 хотя бы по одному из заявленных показаний) для рекомендации к включению.
6. Результаты оценки дополнительных последствий применения лекарственного препарата.
6.1. Результаты анализа данных о государственной регистрации лекарственного препарата в Российской Федерации согласно государственному реестру лекарственных средств:
Результаты проверки актуальных сведений о государственной регистрации лекарственного препарата, в том числе лекарственных препаратов, включенных в действующий перечень, в рамках соответствующих АТХ - групп, имеющих аналогичные показания: _______________________________________________.
5.2. Результаты анализа обращения лекарственного препарата в Российской Федерации:
Результаты анализа объема обращения лекарственных препаратов на отечественном рынке в натуральном (упаковки) выражении за период не менее календарного года, предшествующего подаче предложения, в том числе лекарственных препаратов, включенных в действующий перечень, в рамках соответствующих АТХ - групп, имеющих аналогичные показания:
____________________________________________________________________ _
Результаты анализа динамики обращения лекарственных препаратов в РФ в натуральном (упаковки) выражении за период не менее календарного года, предшествующего подаче предложения, в том числе лекарственных препаратов, включенных в действующий перечень, в рамках соответствующих АТХ - групп, имеющих аналогичные показания:
____________________________________________________________________ _
Результаты анализа объемов государственных закупок соответствующих лекарственных препаратов за предшествующий календарный год, в том числе лекарственных препаратов, включенных в действующий перечень, в рамках соответствующих АТХ - групп, и имеющих аналогичные показания:
____________________________________________________________________ _.
6. Рекомендации ФГБУ "ЦЭККМП" Минздрава России о целесообразности включения (исключения) лекарственного препарата в перечни относительно включенных в указанный перечень лекарственных препаратов, имеющих аналогичные показания, с учетом заключений по результатам экспертизы, представленных экспертной организацией, рекомендаций главных экспертов: __________________________________________________________.
7. Предложения по результатам экспертизы ФГБУ "ЦЭККМП" Минздрава России об исключении лекарственных препаратов из перечня лекарственных препаратов, а также о коррекции наименований и лекарственных форм лекарственных препаратов в соответствии с государственным реестром лекарственных средств: _______________________________________________.
8. Подписи и расшифровка подписей сотрудников ФГБУ "ЦЭККМП" Минздрава России, осуществляющих экспертную оценку лекарственного препарата:
____________________________________________________________________ _
(Ф.И.О. сотрудника ФГБУ "ЦЭККМП" Минздрава России, подпись)
____________________________________________________________________ _
(генеральный директор ФГБУ "ЦЭККМП" Минздрава России, ФИО, подпись)
Дата ________________ ".
Обзор документа
Предложено скорректировать правила формирования перечней лекарственных препаратов для медицинского применения и минимального ассортимента для оказания медицинской помощи.
Так, вместо экспертизы вводится понятие комплексной оценки препаратов. Она будет включать в себя оценку экономических последствий применения препарата, а также дополнительных последствий применения. Этим будет заниматься ФГБУ "ЦЭККМП" Минздрава России. Данное учреждение сможет выносить предложения по исключению лекарственных препаратов из перечней важнейших лекарственных препаратов, дорогостоящих препаратов, препаратов для обеспечения отдельных категорий граждан. Приводится форма соответствующего заключения. Определяется порядок вынесения решений по данным предложениям. Закрепляется, как будет проводиться вышеназванная оценка, какие данные при этом будут учитываться и анализироваться.
Соответственно, дополняется перечень оснований исключения препаратов из указанных перечней.
Уточняется, что перечень важнейших лекарственных препаратов формируется в т. ч. по результатам клинической апробации. Также закрепляется, что препарат из указанного перечня должен будет иметь лекарственную форму, предусмотренную перечнем, утвержденным уполномоченным ФОИВ.
Меняются сроки направления предложений субъектов обращения лекарственных средств (общественных объединений) в комиссию по формированию перечней лекарственных препаратов и минимального ассортимента. Уточняются действия комиссии по направлению указанных предложений в профильную образовательную (научную) организации и в ФГБУ "ЦЭККМП".
Приводятся требования к представлению результатов клинико-экономических исследований.
Пересматривается шкала клинико-экономической оценки лекарственного препарата.



(1).jpg)


