Методические рекомендации МР 4.2.0339-“Отбор, хранение и транспортирование биоматериалов для лабораторной диагностики респираторного микоплазмоза” (утв. Федеральной службой по надзору в сфере защиты прав потребителей и благополучия человека 22 декабря 2023 г.)
4.2. Методы контроля. Биологические и микробиологические факторы
Методические рекомендации МР 4.2.0339-23
“Отбор, хранение и транспортирование биоматериалов для лабораторной диагностики респираторного микоплазмоза”
(утв. Федеральной службой по надзору в сфере защиты прав потребителей и благополучия человека 22 декабря 2023 г.)
I. Область применения и общие положения
1.1. Настоящие Методические рекомендации (далее - МР) описывают алгоритм отбора, хранения и транспортирования биоматериала от больных с симптомами поражения верхних и нижних дыхательных путей, переболевших или бессимптомных бактерионосителей с целью лабораторной диагностики респираторного микоплазмоза (далее - РМ).
1.2. Настоящие МР описывают правила безопасной работы при выполнении технических операций по отбору, хранению и транспортированию биоматериала.
1.3. Настоящими МР руководствуются при микробиологических, молекулярно-генетических и иммунологических методах диагностики РМ, а также при микробиологическом мониторинге и организации противоэпидемических и лечебных мероприятий.
II. Общие сведения о респираторном микоплазмозе
2.1. РМ, вызываемый Mycoplasma pneumoniae (далее М. pneumoniae), занимает одно из ведущих мест в этиологической структуре инфекционных заболеваний органов дыхания человека. РМ распространен во многих странах и протекает как в виде эндемических вспышек, так и в виде эпидемий, которые, как правило, возникают с периодичностью от 3 до 7 лет и представляют для здравоохранения серьезную проблему. Организацию диагностики РМ, микробиологический мониторинг инфекции рекомендуется проводить с учетом знаний биологии возбудителя, патогенеза, клиники и эпидемиологии болезни.
Краткие сведения о возбудителе
2.2. М. pneumoniae, возбудитель РМ, является представителем класса Mollecutes, объединяющего мелких, с минимальным геномом, не имеющих клеточной стенки, бактерий. Микоплазмы микроорганизмы, не имеющие клеточной стенки, способные к самостоятельному размножению и существованию в организме человека. Размер клеток М. pneumoniae 1 2 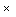 0,1 - 0,2 мкм. Объем клетки микоплазм составляет менее 5% объема клетки бацилл. Геном возбудителя состоит из 816304 пар оснований, что составляет 1/6 от величины генома Escherichia coli. Клетки М. pneumoniae отличаются от обычных бактерий полиморфизмом, пластичностью, осмотической хрупкостью и способностью проходить через поры размером 0,22 мкм. У М. pneumoniae обнаружены специальные органеллы (структуры), отвечающие за адгезию возбудителя к эпителию дыхательных путей. Такую же функцию у возбудителя выполняет и синтезируемая ими капсульная субстанция. Жгутики, флагеллы и пили у М. pneumoniae не обнаружены, однако микроб способен передвигаться по поверхности клеток с помощью так называемого «скользящего» движения. Как установлено, такое движение у микоплазм тесно связано с их патогенностью.
0,1 - 0,2 мкм. Объем клетки микоплазм составляет менее 5% объема клетки бацилл. Геном возбудителя состоит из 816304 пар оснований, что составляет 1/6 от величины генома Escherichia coli. Клетки М. pneumoniae отличаются от обычных бактерий полиморфизмом, пластичностью, осмотической хрупкостью и способностью проходить через поры размером 0,22 мкм. У М. pneumoniae обнаружены специальные органеллы (структуры), отвечающие за адгезию возбудителя к эпителию дыхательных путей. Такую же функцию у возбудителя выполняет и синтезируемая ими капсульная субстанция. Жгутики, флагеллы и пили у М. pneumoniae не обнаружены, однако микроб способен передвигаться по поверхности клеток с помощью так называемого «скользящего» движения. Как установлено, такое движение у микоплазм тесно связано с их патогенностью.
Являясь облигатным паразитом, М. pneumoniae трудно культивируется на искусственных питательных средах. Для роста используют триптические гидролизаты говяжьего сердца с добавлением 20% нормальной лошадиной сыворотки и дрожжевого экстракта. Сыворотку добавляют в качестве источника стиролов (стеринов), которые являются важным структурным компонентом трехслойной мембраны микоплазм, обеспечивающей жизнеспособность клетки. Рост микроба на питательных средах замедленный: при первичном посеве исследуемого материала отдельные колонии на плотной среде появляются через несколько дней или недель (до 35 суток). Предпочтительнее инкубировать посевы в микроаэрофильных условиях при температуре 37°С. При температуре выше 42°С микоплазмы быстро погибают. На плотных питательных средах они образуют нежные, равномерно зернистые, колонии диаметром 0,1 - ,3 мм, с плотным центром, напоминающие яичницу глазунью. М. pneumoniae ферментирует глюкозу, фруктозу, ксилозу, мальтозу, маннозу, крахмал и некоторые другие углеводы с образованием молочной и уксусной кислот. Патоген восстанавливает соли тетразолия, чем и отличается от комменсальных орофарингеальных микоплазм, нередко присутствующих у человека.
Для М. pneumoniae характерным признаком является образование гемолизина, вызывающего бета-гемолиз эритроцитов человека и разных видов животных. Патоген также вызывает гемосорбцию и гемагглютинацию.
М. pneumoniae: в незащищенном виде быстро погибает в окружающей; среде, микроорганизм высоко чувствителен к поверхностно-активным веществам, спиртам, щелочам, фенолам, перекиси водорода, перманганату калия; относительно резистентен к осмотическому шоку: высокоустойчив при температурах от 0 до 4°С, а при температуре 37°С обладает низкой устойчивостью. Бульонные культуры М. pneumoniae обладают высокой резистентностью к многократному замораживанию и оттаиванию. В лиофильно высушенном состоянии, когда в качестве защитной среды используют лошадиную сыворотку, микоплазмы сохраняются несколько десятков лет. Длительно сохраняются микоплазмы и при температуре минус 80°С.
Штаммы М. Pneumoniae:
чувствительны к макролидам, тетрациклинам, линкозаминам, фторхинолонам, хлорамфениколу и аминогликозидам;
устойчивы - к пенициллину и его производным. В последние годы во многих странах от больных РМ выделяют М. pneumoniae, устойчивые к макролидам - антибиотикам, широко используемым для лечения респираторной микоплазменной инфекции.
Основными факторами патогенности М. pneumoniae являются белки-адгезины, расположенные на специфических органеллах клетки (адгезины Р1, Р30, Р41, Р24), обеспечивающие прилипание возбудителя к эпителиальным клеткам хозяина и его взаимодействие с ними; АДР - рибозилтрансфераза (экзотоксин), вызывающая вакуолизацию и цилиостаз хозяйских клеток; гемолизин супероксидные анионы и перекись водорода, повреждающие клетки реснитчатого эпителия и эритроциты; нейраминидаза, влияющая на рецепторный аппарат клетки, а также протеазы, нуклеазы и другие ферменты патогенности.
До настоящего времени реальной модели для пневмонии, вызываемой М. pneumoniae у животных нет.
Эпидемиология, патогенез, клиника и диагностика инфекции
2.3. РМ - это группа инфекционно-воспалительных заболеваний, вызываемых патогенными микроорганизмами рода Mycoplasma, преимущественно М. pneumoniae, при котором поражаются верхние и нижние дыхательные пути человека. Болезнь регистрируется во многих странах и занимает одно из ведущих мест в этиологической структуре инфекций респираторного тракта. РМ может проявляться как в виде эндемических вспышек, так и виде эпидемий. Инфекция поражает людей всех возрастов. Климат, сезонность и география мало влияют на распространение болезни.
2.3.1. При внебольничных пневмониях (далее - ВП), которые по данным Всемирной организации здравоохранения (ВОЗ) ежегодно в мире регистрируются у 8 - 15 млн людей, доля заболеваний, вызванных М. pneumoniae, составляет приблизительно от 10 до 40%. По своей этиологической значимости патоген уступает только Streptococcus pneumonia (далее - S. pneumonia), на долю которого приходится от 30 до 50% случаев ВП. По данным российских исследователей РМ составляет от 10 до 16% от общего числа острых респираторных заболеваний, однако на пике эпидемии РМ эта доля может достигать 50% и более. У 10 - 30% пациентов с ВП выявляется смешанная или ко-инфекция, которая может быть вызвана ассоциацией различных бактериальных возбудителей (например, S. pneumoniae с Н. influenzae или М. pneumoniae), либо их сочетанием с респираторными вирусами. ВП, вызванная ассоциацией возбудителей, имеет тенденцию к более тяжелому течению и худшему прогнозу. У 3 - 10% пациентов с микоплазмозной инфекцией рентгенологически диагностируют пневмонию, в 1 - 5% случаев заболевания требуется госпитализация.
2.3.2. Резервуаром и источником М. pneumoniae являются больные, переболевшие или бессимптомные бактерионосители. Больные выделяют возбудитель в среднем 7 - 10 дней от начала болезни. Механизм передачи возбудителя аспирационный, путь передачи воздушно капельный, возможно заражение воздушно-пылевым, а также контактно-бытовым путем через контаминированные возбудителем руки или предметы обихода. Инкубационный период болезни может составлять от 4 до 25 дней, чаще от 7 до 14 дней.
2.3.3. Наиболее чувствительны к инфекции дети старше 5 лет и подростки до 15 лет, М. pneumoniae - наиболее частый этиологический агент в данной возрастной группе, являющийся причиной 14 - 35% госпитализаций. Эпидемиологической особенностью М pneumoniae является возможность вызывать вспышки инфекций нижних дыхательных путей (в том числе и ВП) в организованных коллективах с тесными контактами (например, в дошкольных, школьных и студенческих группах, у военнослужащих). Число лиц, инфицированных в таких коллективах, может достигать 80%. Описаны семейные вспышки РМ. Ввиду длительности инкубационного периода (до 1 месяца) вспышки РМ развиваются медленно и имеют продолжительное течение (3 - 5 месяцев).
Считается, что в эпидемиологии РМ основная роль принадлежит двум субтипам М. pneumoniae, часто выделяемым из клинических образцов больных: субтип 1 и субтип 2. Субтипы существенно отличаются друг от друга по химическому составу антигена Р1 и структуре генов, детерминирующих его синтез. Исследователи отмечают периодическую сменяемость этих двух генетических линий М. pneumoniae в этиологии эндемических и эпидемических вспышек РМ.
У большинства переболевших РМ развивается постинфекционный иммунитет длительностью 5-10 лет и более, однако по данным разных авторов, в 13-18% случаев отмечается повторное заболевание, что связывают со сменой антигенных вариантов (субтипов, генетических линий) эпидемических штаммов М. pneumoniae, способных преодолевать ранее сформировавшийся у переболевших постинфекционный иммунитет.
Поставить диагноз микоплазменной инфекции, в том числе микоплазменной пневмонии, только на основании клинических и рентгенологических данных весьма трудно, поскольку РМ не имеет патогномических черт1.
Основная роль в подтверждении микоплазменной этиологии заболевания отводится лабораторной диагностике, которая включает:
- обнаружение методом полимеразной цепной реакции (далее - ПЦР) в клиническом материале ДНК М. pneumoniae;
- выявление в реакции прямой иммунофлуоресценции (далее - РИФ) специфических антигенов М. pneumoniae;
- обнаружение с помощью иммуноферментного анализа (далее ИФА) специфических антимикоплазмозных антител класса М (далее - Ig М) в день постановки первичного диагноза и класса G (Ig G) и при наличии симптоматики заболевания;
- обнаружение в парных сыворотках крови спустя 3-4 недели после первого отбора крови больных 4-х кратного увеличения специфических антимикоплазмозных антител класса G (далее - Ig G);
- микробиологическое выделение из клинических образцов чистой культуры М. pneumoniae или других видов микоплазм, способных вызывать у человека РМ. Поскольку выделение культуры микоплазм занимает длительное время (от 2 до 5 недель), использование микробиологического метода в диагностике РМ ограничено. Тем не менее, выделение возбудителя РМ имеет исключительно важное значение для определения этиологической структуры РМ, выявления эпидемически важных генетических линий возбудителя, дифференциации патогенных микоплазм от микоплазм комменсалов, а также для контроля антибиотикочувствительности микоплазм.
III. Отбор, хранение и транспортирование биоматериала для лабораторной диагностики респираторного микоплазмоза2
Биоматериал для исследования
3.1. Вид биоматериала определяется методом дальнейшего исследования.
3.1.1. Клинические образцы материала для бактериологического анализа:
1) из верхних дыхательных путей:
- мазок из слизистых передних отделов полости носа;
- мазок из носоглотки;
- мазок из зева (глотки);
- назальный смыв;
- аспираты из носоглотки.
2) из нижних дыхательных путей:
- мокрота, свободно отделяемая (отхаркиваемая);
- мокрота, полученная в результате индукции посредством ингаляции гипертоническим раствором натрия хлорида;
- пробы смыва с бронхов;
- жидкость, полученная при бронхоальвеолярном лаваже (далее жидкость БАЛ);
- соскобы с бронхов;
- образцы транстрахеальной биопсии;
- пробы аспирата легких;
- пробы биоптатов легких.
От умерших для исследования отбирают образцы легких, трахеи, тканей головного мозга, печени, поджелудочной железы, спинномозговую жидкость.
3.1.2. Клинические образцы материала для исследований с помощью ПЦР:
1) из верхних дыхательных путей:
- объединенный мазок из носоглотки и задней стенки зева (глотки);
- объединенный носоглоточный и глоточный смыв.
2) из нижних дыхательных путей:
- мокрота, полученная при глубоком откашливании;
- мокрота, полученная в результате индукции посредством ингаляции гипертоническим раствором натрия хлорида;
- аспираты из трахеи;
- жидкость БАЛ.
От умерших для исследования отбирают аутоптаты тканей лёгкого, образцы тканей головного мозга, печени, поджелудочной железы.
3.1.3. Клинические образцы материала для исследований иммунологическими методами:
- образцы крови (сыворотка крови), взятые от больных:
1) в день постановки первичного диагноза отбор крови для определения с помощью ИФА титров IgM;
2) спустя 3-4 недели после первого отбора крови - для определения с помощью ИФА в парных сыворотках титров IgG-антител;
- мазки из носоглотки, жидкость БАЛ, мокрота, биоптаты от больного для определения в них антигенов М. pneumoniae с помощью РИФ.
От умерших для определения антигенов М. pneumoniae берут образцы тканей легких, мозга, паренхиматозных органов.
Отбор, хранение и транспортирование биоматериала
3.2. Все манипуляции по отбору проб материала для исследования на присутствие возбудителя РМ выполняются медицинским персоналом только после подготовки больного к предстоящим манипуляциям по отбору материала.
3.2.1. Отбор проб материала от больных с подозрением на РМ осуществляется в соответствии с санитарно-эпидемиологическими требованиями3 и соблюдением правил асептики и антисептики с целью предотвращения инфицирования пациента в процессе выполнения инвазивных мероприятий (процедур) и недопущения контаминации проб материала посторонней, нецелевой микрофлорой.
3.2.2. Пробы материала для микробиологического исследования от больного отбирают по возможности до начала антимикробной терапии. В противном случае - непосредственно перед употреблением антимикробных (антимикоплазменных) препаратов.
Отбор биоматериала для ПЦР и крови для ИФА исследований не зависит от проведения антибиотикотерапии.
3.2.3. От больного для исследования отбирают, по возможности, две пробы материала: одну из верхних дыхательных путей, другую - из нижних дыхательных путей. При возможности от больного берут три и более проб материала из верхних и нижних дыхательных путей. Особенно это важно при бактериологической диагностике РМ (целесообразно осуществлять повторный забор при устойчивом подозрении и отрицательным результатом ПЦР в первой пробе).
3.2.4. Пробы материала помещают в специальные, разрешенные к использованию в Российской Федерации, стерильные пластиковые или стеклянные емкости (контейнеры, пробирки) с закручивающимися или плотно закрывающимися крышками, или в пробирки с закручивающимися крышками с одной из рекомендуемых специальных транспортных сред (приложение к настоящим МР).
Выбор емкостей для сбора клинического материала и транспортирования его в лабораторию определяется целями исследования и временем от отбора пробы до начала проведения исследования.
3.2.5. Биологические жидкости и ткани не требуют транспортных сред в случае, если время начала проведения исследования не превышает 1 ч с момента отбора материала, и образцы защищены от высыхания. В остальных случаях пробы с материалом хранят при температуре не выше минус 70°С в забуференном физиологическом растворе или в транспортных средах (приложение к настоящим МР).
При температуре минус 70°С и ниже микоплазмы могут сохраняться в течение длительного времени, однако хранение при температуре минус 20°С может привести к потере их жизнеспособности.
3.2.6. Для исследования методом ПЦР допускается хранение образца мокроты в течение 1 суток при температуре (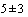 )°С, более длительно - при температуре не выше минус 70°С (Желательно разделить пробу на аликвоты - одну на ПЦР для работы в течение суток, другую немедленно заморозить при температуре не выше минус 70°С для дальнейшей транспортировки4.
)°С, более длительно - при температуре не выше минус 70°С (Желательно разделить пробу на аликвоты - одну на ПЦР для работы в течение суток, другую немедленно заморозить при температуре не выше минус 70°С для дальнейшей транспортировки4.
3.2.7. Для транспортирования клинических образцов применяют забуференный физиологический раствор или транспортные среды (приложение к настоящим МР). Емкости с отобранными пробами материала при температуре не выше минус 16°С, транспортируют любым видом транспорта только с применением сумок - холодильников, термоконтейнеров, термосов с хладоагентами (температура минус 18°С или «сухой лед»)5.
3.2.8. Для отбора проб рекомендуется использовать зонд-тампоны, состоящие из пластикового зонда и тампона из вискозы, полиэфирного материала или велюра. Не рекомендуется использование зонд-тампонов с ватными тампонами или с деревянными зондами в связи с наличием в них жирных кислот и других ингибирующих веществ, что может привести к получению ложноотрицательных результатов анализа.
3.2.9. Каждая емкость (контейнер, пробирка) с материалом должна иметь направление, в котором указывают фамилию, имя, отчество и год рождения больного, название отобранного материала, наименование ЛПУ, где отобран образец, число, месяц, год и время суток отбора материала, предполагаемый диагноз больного и задачи исследования взятого материала.
Все образцы биоматериала (в том числе аутопсийный материал, выделенные культуры, ДНК, ПЦР-положительные мазки) обязательно должны быть переданы в Референс-центр по микоплазмозам (в ФБУН ГНЦ прикладной микробиологии и биотехнологии Роспотребнадзора) в кратчайшие сроки.
Все образцы от каждого пациента необходимо сохранять до завершения исследования при температуре не выше минус 70°С.
Материально-техническое обеспечение отбора, хранения и транспортировки биоматериала для лабораторных исследований6
3.3. Реактивы:
- вода дистиллированная или деионизованная;
- раствор солей Хэнкса с ионами кальция и магния;
- сыворотка эмбриональная бычья;
- сахароза;
- калий фосфорнокислый двузамещенный трехводный (К2НРO4 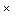 3Н2O);
3Н2O);
- калий фосфорнокислый однозамещенный (КН2РО4);
- натрий фосфорнокислый двузамещенный (Na2HPO4);
- натрий хлористый (NaCl);
- амфотерицин В;
- спирт этиловый 70%;
- коммерческие транспортные среды или транспортные системы с криопротектором, пригодные для поддержания жизнеспособности микоплазм.
3.4. Посуда лабораторная:
- колбы мерные (50, 100, 200, 500, 1000 мл);
- пипетки градуированные (0,1 1,0; 0,2 - 2,0; 0,5 - 5,0; 1,0 10,0 мл);
- пробирки бактериологические (16 х 150 мм);
- цилиндр мерный (25; 100; 1000 мл);
- штативы для пробирок и микропробирок;
- микроцентрифужные пробирки вместимостью 1,5; 2,0 мл;
- шприцы одноразовые (5,10,20, 50 мл);
- фильтровальные мембраны из регенерированной целлюлозы или полиэфирсульфона с размером пор 0,22 или 0,45 мкм, автоклавируемые;
- фильтродержатель для фильтровальной мембраны, автоклавируемый;
- одноразовые стерильные контейнеры для сбора и транспортирования мокроты, плевральной жидкости, трахеального аспирата, жидкости БАЛ с устойчивым основанием, изготовленные из прозрачного материала (желательно пластика с целью предотвращения поломки, облегчения дезинфекции и утилизации контейнера); крышка должна герметично закрывать контейнеры и легко открываться; контейнер не должен содержать химические вещества, негативно влияющие на жизнеспособность находящихся в мокроте бактерий;
- стерильные герметично закрывающиеся пластиковые пробирки для транспортной среды;
- зонды-тампоны стерильные одноразовые с пластиковым зондом и с тампоном из вискозы, полиэфирного материала или велюра. Не рекомендуется использование зонд-тампонов с ватными тампонами или с деревянными зондами в связи с наличием в них жирных кислот и других ингибирующих веществ, что может привести к получению ложноотрицательных результатов анализа.
3.5. Оборудование:
- автоклав электрический;
- дистиллятор;
- морозильная камера, обеспечивающая температуру минус 20°С;
- термостат суховоздушный, поддерживающий температуру в камере в пределах (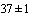 )°С;
)°С;
- центрифуга;
- холодильник бытовой, обеспечивающий температуру (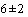 )°С;
)°С;
- низкотемпературный холодильник, поддерживающий температуру в камере в пределах от минус 80 до минус 70°С;
- шкаф сушильно-стерилизационный с диапазоном автоматически поддерживаемой температуры в рабочей камере от 50 до 200°С;
- термоконтейнер или термосумка, или термос, пригодные для соблюдения правил «Холодовой цепи» с соответствующими хладоэлементами или системой охлаждения внутренней камеры.
Отбора, хранения и транспортирования биологического материала для микробиологического, ПЦР и иммунологического анализов
3.6. Отбор, хранение и транспортирование биоматериала для исследования осуществляется в соответствии с санитарно-эпидемиологическими требованиями7, а также методическими документами8».
Мазки из верхних дыхательных путей
3.7. Материал берут после полоскания полости рта кипяченой водой комнатной температуры. Если полость носа заполнена слизью, перед процедурой рекомендуется провести высмаркивание. В течение 6 ч перед процедурой нельзя использовать медикаменты, орошающие носоглотку или ротоглотку и препараты для рассасывания во рту.
Мазки у пациента берут двумя разными зондами-тампонами сначала со слизистой нижнего носового хода, а затем из ротоглотки, при этом концы зондов-тампонов после отбора мазков последовательно помещаются в одну пробирку с 0,5 - 3,0 мл забуференного физиологического раствора или транспортной среды.
3.8. Мазки со слизистой носоглотки у детей берут сухим стерильным назофарингеальным велюр-тампоном с пластиковым стержнем, у взрослых рекомендуется использовать любые стерильные сухие зонды-тампоны (см. п. 4.2). Зонд-тампон вводят легким движением по наружной стенке носа на глубину 2-3 см до нижней раковины, слегка опускают книзу, вводят в нижний носовой ход под нижнюю носовую раковину, делают вращательное движение и удаляют вдоль наружной стенки носа. Общая глубина введения зонда-тампона должна составлять примерно половину расстояния от ноздри до ушного отверстия (3 - 4 см для детей и 5 - 6 см для взрослых). После забора материала зонд-тампон опускают в пробирку с транспортной средой или забуференным физиологическим раствором, конец зонда отламывают, придерживая крышкой пробирки, при невозможности отломить зонд тампон используют стерильные ножницы. Пробирку герметично закрывают. Смена перчаток и обработка рук медицинским персоналом осуществляется после каждого пациента.
3.9. Мазки из ротоглотки берут сухим стерильным зондом-тампоном вращательными движениями с поверхности миндалин, небных дужек и задней стенки ротоглотки, аккуратно прижимая язык пациента шпателем. После забора материала рабочую часть зонда-тампона помещают в ту же пробирку с транспортной средой или забуференным физиологическим раствором, в которую был помещен зонд-тампон с мазком из носоглотки. Конец зонда отламывают, придерживая крышкой пробирки с расчетом, чтобы он позволил плотно закрыть пробирку.
Свободно отделяемая мокрота
3.10. Для сбора мокроты рекомендуется использовать стерильные герметично закрывающиеся пластиковые контейнеры. Перед сбором мокроты необходимо попросить пациента тщательно прополоскать рот кипяченой водой. Сбор мокроты осуществляется натощак или не ранее 2 ч после еды.
3.11. Пациента просят сделать несколько глубоких вдохов с задержкой дыхания на несколько секунд, затем с силой выдохнуть, что способствует появлению продуктивного кашля и очищению верхних дыхательных путей от мокроты. Затем пациента просят хорошо откашляться и собрать отделяемое из нижних дыхательных путей (не слюну) в стерильный контейнер. Объем образца мокроты должен быть не менее 3 мл для взрослых и около 1 мл для детей.
Индуцированная мокрота, жидкость, получаемая при бронхоальвеолярном лаваже (жидкость БАЛ), трахеальный аспират, плевральная жидкость
3.12. Отбор проб осуществляют в соответствии с методическими документами9.
3.13. Для исследования методом ПЦР допускается хранение образца в течение 1 суток при температуре (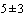 )°С, более длительно - при температуре не выше минус 70°С.
)°С, более длительно - при температуре не выше минус 70°С.
Аутопсийный материал
3.14. Посмертный материал собирают в течение первых суток после гибели больного стерильным индивидуальным инструментом (отдельным для каждого органа) из зоны поврежденной ткани объемом от 1 до 3 см3, помещают в одноразовые стерильные пластиковые контейнеры с герметично завинчивающейся крышкой.
Материал для серологической диагностики
3.15. Для серологического исследования (определение антител с помощью ИФА) необходимы три пробы сыворотки крови. Первая проба сыворотки крови берется в день постановки первичного диагноза, для определения с помощью ИФА в Ig М), вторая проба - через 3-4 недели после первого отбора крови (для определения с помощью ИФА в парных сыворотках IgG).
1) в день постановки первичного диагноза отбор крови для определения с помощью ИФА титров IgM;
2) спустя 3-4 недели после первого отбора крови для определения с помощью ИФА в парных сыворотках титров IgG-антител;
3.16. Отбор крови осуществляется из вены в объеме 3-4 мл, или из третьей фаланги среднего пальца в объеме 0,5 - 1,0 мл в одноразовую пластиковую пробирку без антикоагулянта. Пробы крови отстаивают при комнатной температуре в течение 30 мин или помещают в термостат с температурой 37°С на 15 мин. После центрифугирования (10 мин при 3000 об/мин) сыворотку переносят в стерильные пробирки, используя для каждого образца отдельный наконечник с аэрозольным барьером.
Срок хранения цельной крови - не более 6 ч, замораживание недопустимо. Срок хранения сыворотки крови при комнатной температуре - в течение 6 ч, при температуре (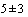 )°С в течение 5 сут., более длительно при температуре не выше минус 16°С (многократное замораживание/ размораживание недопустимо).
)°С в течение 5 сут., более длительно при температуре не выше минус 16°С (многократное замораживание/ размораживание недопустимо).
3.17. Кратко технический процесс отбора, хранения и транспортирования биоматериала для исследований представлен на рис. 1 - 4.
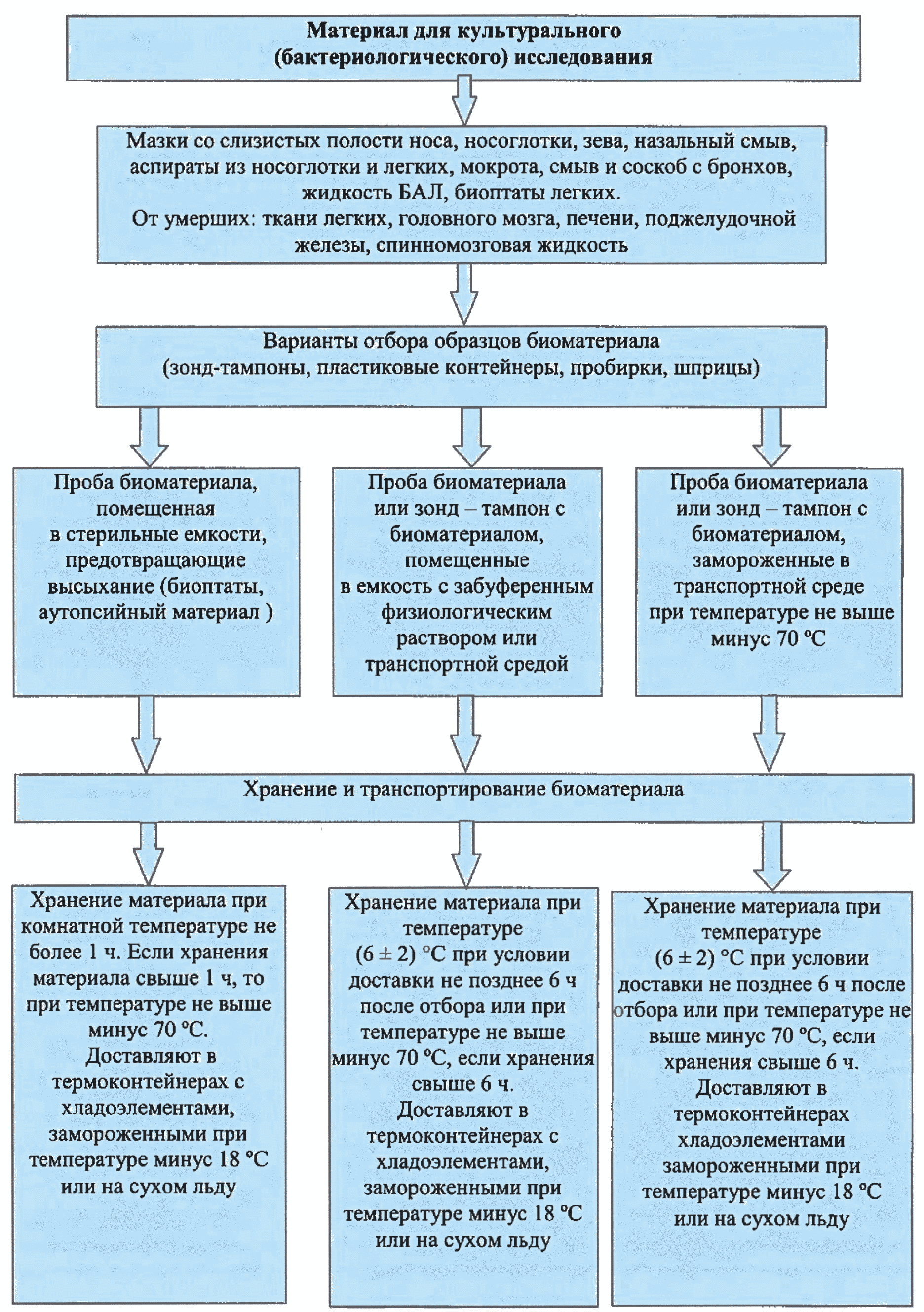
Рис. 1. Отбор, хранение и транспортировка материала для культурального (бактериологического) исследования на присутствие М. pneumoniae и других видов микоплазм
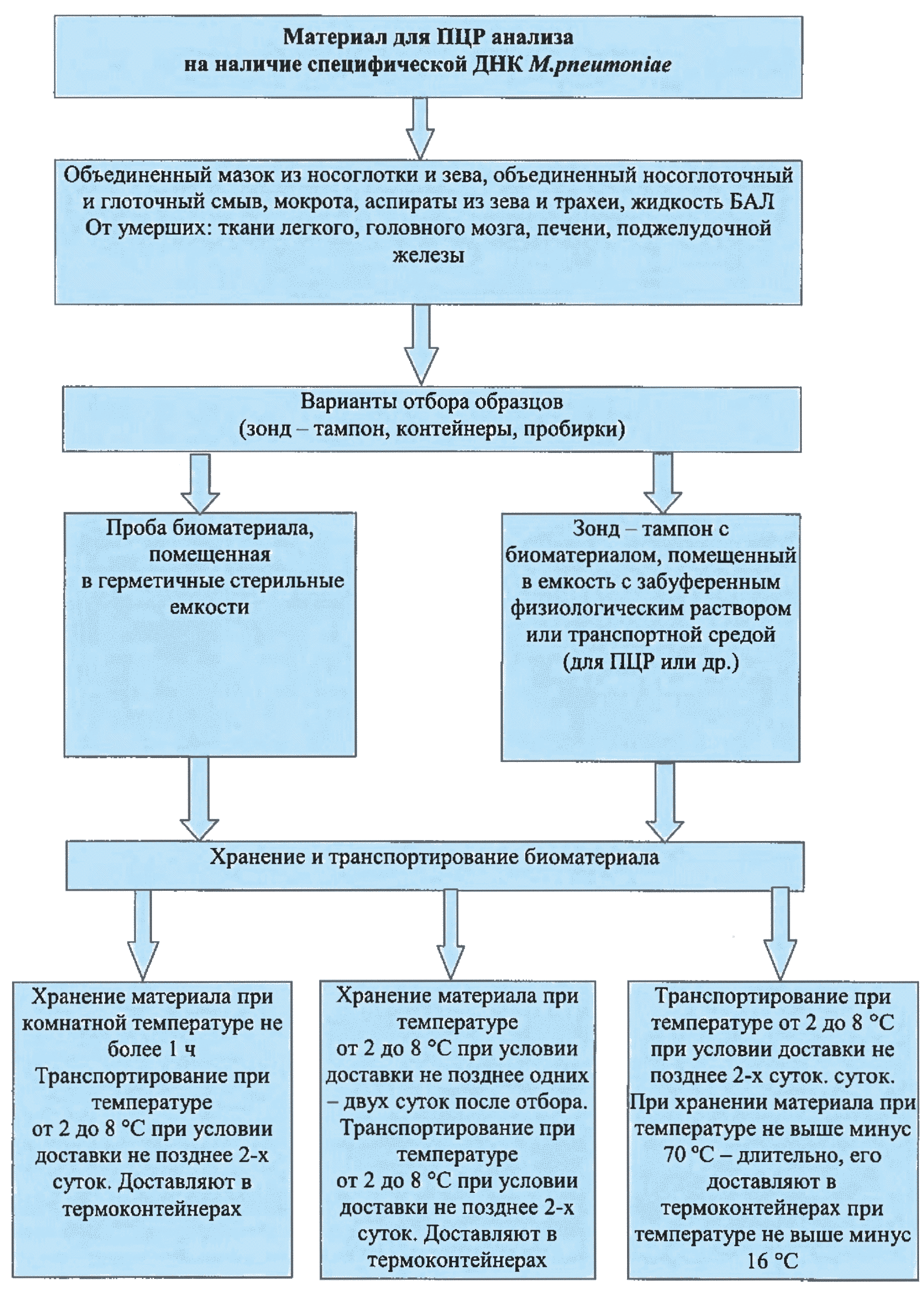
Рис. 2. Отбор, хранение и транспортировка материала для ПЦР анализа на наличие специфической ДНК M.pneumoniae
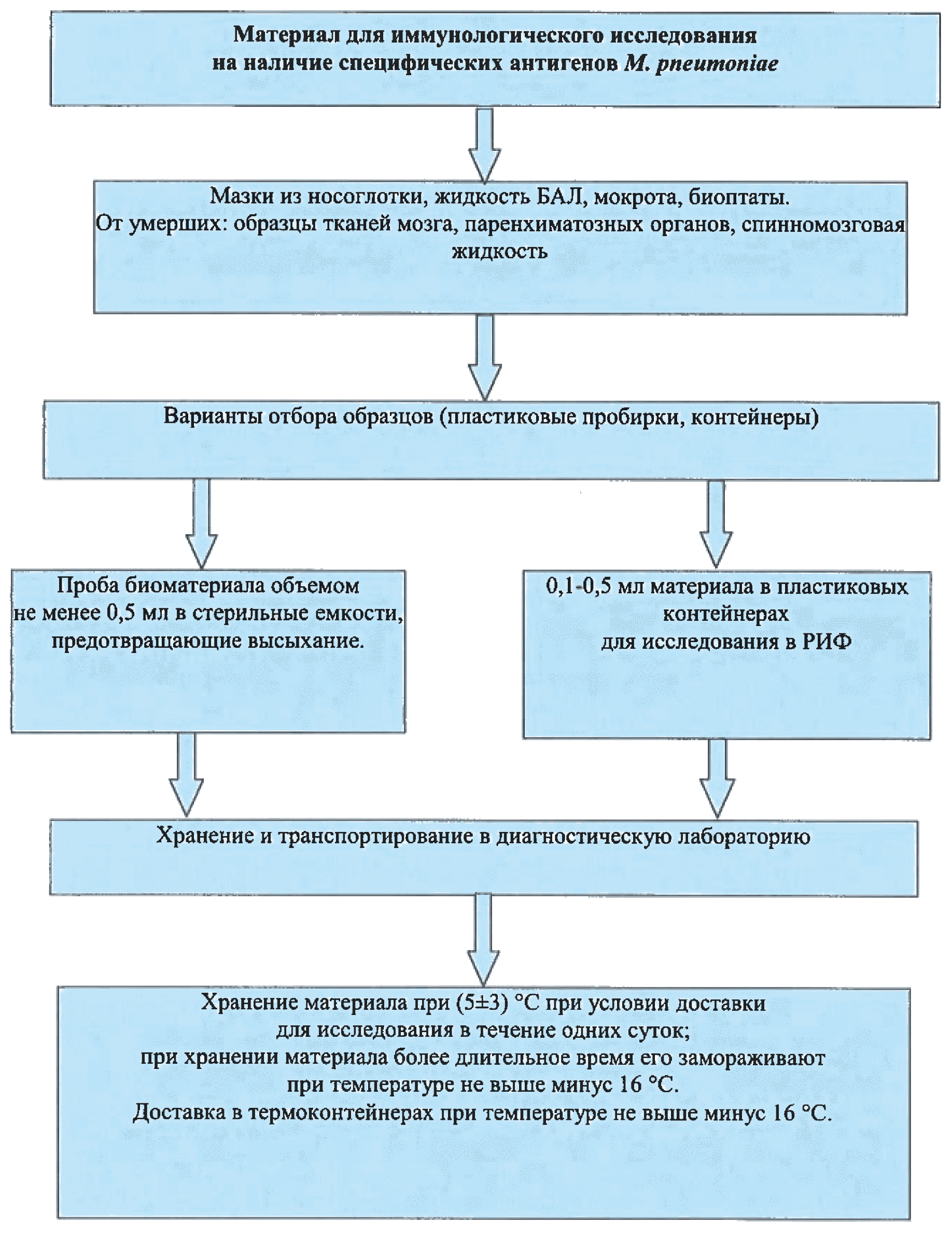
Рис. 3. Отбор, хранение и транспортировка материала для иммунологического исследования на наличие специфических антигенов М. pneumoniae
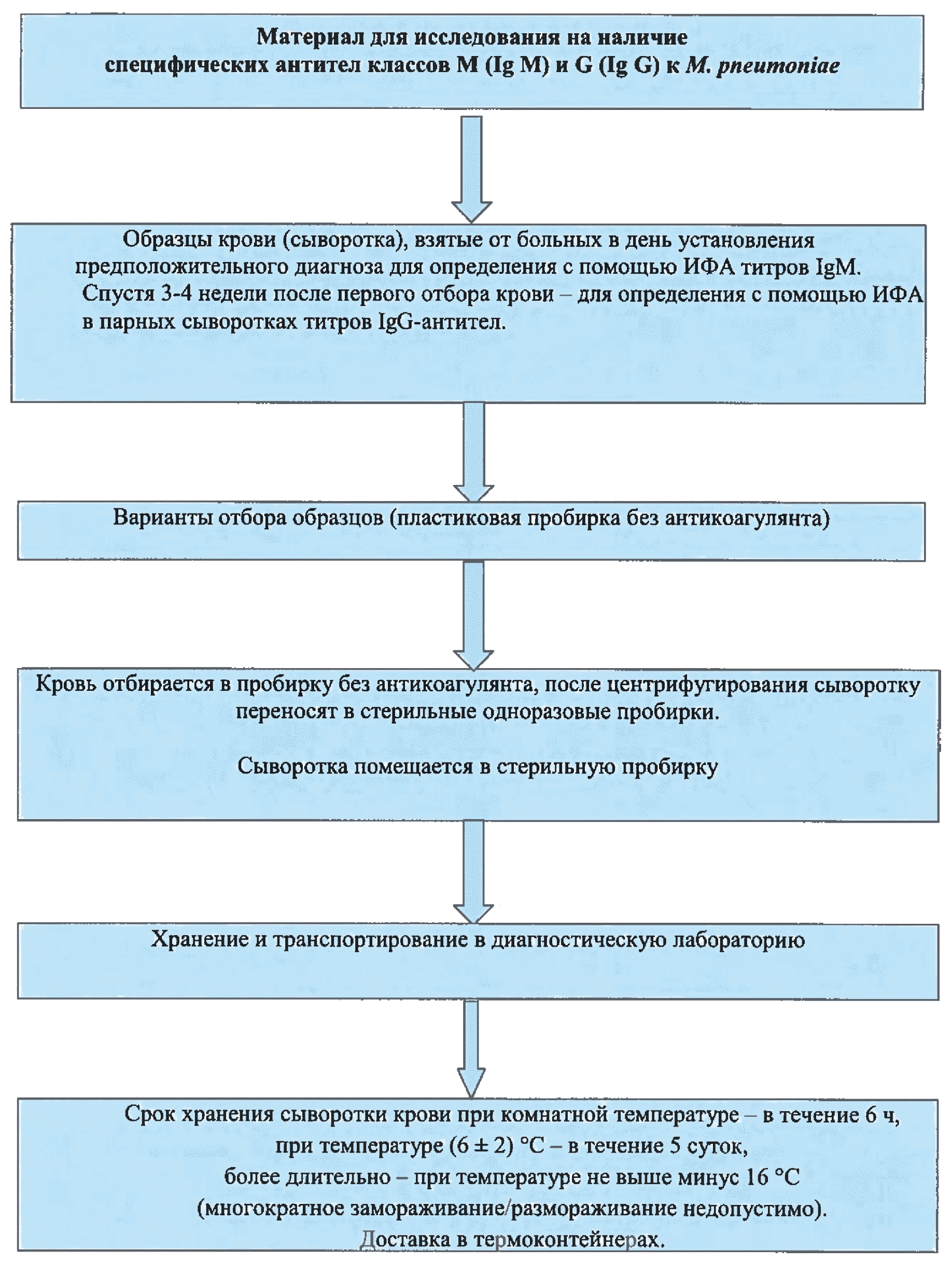
Рис. 4. Отбор, хранение и транспортировка материала для исследования на наличие специфических антител классов М (Ig М) и G (Ig G) к М. pneumoniae
IV. Требования безопасности
4.1. Исследования биологического (клинического) материала проводят в соответствии с санитарно-эпидемиологическими требованиями10.
4.2. Утилизация исходных субстратов и продуктов ПЦР исследования осуществляется в соответствии с санитарно-эпидемиологическими требованиями11.
|
Руководитель Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека, Главный государственный санитарный врач Российской Федерации |
А.Ю. Попова |
Приложение
к МР 4.2.0339 -23
Примеры питательных сред и растворов, применяемых при транспортировании биоматериала для лабораторной диагностики респираторных микоплазмозов
1. Для сбора и транспортирования клинического материала рекомендуется использование забуференного физиологического раствора, или специальных транспортных сред для микоплазм (М4, М5, М6), транспортной среды для вирусов (VTM) без гентамицина, жидких универсальных транспортных сред без гентамицина с феноловым красным (UTM), сахарозо-фосфатной транспортной среды для хламидий и гонококков (2-SP) и бульонов для культивирования микоплазм (среда SP-4, среда Фрея, PPLO бульон, модифицированная среда Фриса)12. Ниже приведены прописи некоторых из них..
1) Забуференный физиологический раствор (калий - натрий фосфатный буфер).
| Состав на 1 л: | ||
|---|---|---|
| Натрий хлористый | 8,7 г | |
| Натрий фосфорнокислый двузамещенный | 1,5 г | |
| Калий фосфорнокислый однозамещенный | 0,2 г |
Приготовление забуференного физиологического раствора. Растворить компоненты в дистиллированной или деионизированной воде и довести объем до 1,0 л. Установить значение pH в диапазоне от 7,4 до 7,5 с помощью растворов соляной кислоты или едкого натра. Стерилизовать автоклавированием при температуре 121°С в течение 20 мин.
2) Транспортная среда для вирусов (VTM) без гентамицина.
| Состав на 512 мл: | ||
|---|---|---|
| Раствор солей Хэнкса с ионами кальция и магния | 500 мл | |
| Сыворотка эмбриональная бычья | 10 мл | |
| Раствор амфотерицина В | 2 мл |
Приготовление транспортной среды. Сыворотку эмбриональную бычью инактивируют прогреванием на водяной бане при температуре (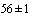 )°С в течение 30 мин. Растворяют 10 мг амфотерицина В в 20 мл дистиллированной или деионизованной воды и стерилизуют через мембранный фильтр с размером пор 0,22 или 0,45 мкм. В асептических условиях добавляют 10 мл инактивированной сыворотки эмбриональной бычьей и 2 мл раствора амфотерицина В в 500 мл стерильного раствора солей Хэнкса и перемешивают взбалтыванием. Допускается хранение разлитых по пробиркам вышеперечисленных транспортных сред, замороженных при минус 20°С, в течение месяца.
)°С в течение 30 мин. Растворяют 10 мг амфотерицина В в 20 мл дистиллированной или деионизованной воды и стерилизуют через мембранный фильтр с размером пор 0,22 или 0,45 мкм. В асептических условиях добавляют 10 мл инактивированной сыворотки эмбриональной бычьей и 2 мл раствора амфотерицина В в 500 мл стерильного раствора солей Хэнкса и перемешивают взбалтыванием. Допускается хранение разлитых по пробиркам вышеперечисленных транспортных сред, замороженных при минус 20°С, в течение месяца.
3) Среда 2-SP (2-sucrose-phosphate based transport medium).
| Состав на 1 л: | ||
|---|---|---|
| Сахароза | 68,4 г (0,2 моль/л) | |
| Калий фосфорнокислый двузамещенный трехводный | 3,3 г (0,0146 моль/л) | |
| Калий фосфорнокислый однозамещенный | 7,3 г (0,054 моль/л) | |
| Сыворотка эмбриональная бычья | 100 мл | |
| Раствор амфотерицина В | 2 мл | |
| Вода дистиллированная или деионизованная | до 900 мл |
Приготовление транспортной среды. Сыворотку эмбриональную бычью инактивируют прогреванием на водяной бане при температуре (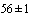 )°С в течение 30 мин. Растворяют 10 мг амфотерицина В в 20 мл дистиллированной или деионизованной воды и стерилизуют через мембранный фильтр с размером пор 0,22 или 0,45 мкм. В 800 мл дистиллированной или деионизованной воды растворяют 3,3 г К2НРО4
)°С в течение 30 мин. Растворяют 10 мг амфотерицина В в 20 мл дистиллированной или деионизованной воды и стерилизуют через мембранный фильтр с размером пор 0,22 или 0,45 мкм. В 800 мл дистиллированной или деионизованной воды растворяют 3,3 г К2НРО4 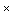 3Н2О, 7,3 г КН2РО4, 68,4 г сахарозы. Доводят раствор дистиллированной или деионизованной водой до 900 мл и и стерилизуют автоклавированием при температуре 112°С в течение 20 мин. В асептических условиях в полученный стерильный раствор добавляют 100 мл инактивированной сыворотки эмбриональной бычьей и 2 мл раствора амфотерицина В. Перед применением транспортную среду разливают по 3 мл в пробирки, предназначенные для отбора образцов.
3Н2О, 7,3 г КН2РО4, 68,4 г сахарозы. Доводят раствор дистиллированной или деионизованной водой до 900 мл и и стерилизуют автоклавированием при температуре 112°С в течение 20 мин. В асептических условиях в полученный стерильный раствор добавляют 100 мл инактивированной сыворотки эмбриональной бычьей и 2 мл раствора амфотерицина В. Перед применением транспортную среду разливают по 3 мл в пробирки, предназначенные для отбора образцов.
Допускается хранение разлитых по пробиркам вышеперечисленных транспортных сред, замороженных при минус 20°С, в течение месяца.
4) Среда SP-4.
| Состав на 1 л: | ||
|---|---|---|
| Базовая среда | 615.0 мл | |
| Сыворотка эмбриональная бычья (инактивированная при 56°С 1 ч) | 170,0 мл | |
| CMRL 1066, 10Х с глутамином | 50,0 мл | |
| Раствор свежего дрожжевого экстракта | 35.0 мл | |
| Феноловый красный (0,1% раствор) | 20.0 мл | |
| Раствор пенициллина | 10.0 мл | |
| Раствор амфотерицина В | 2 мл | |
| Раствор полимиксина В | 5 мл | |
| Базовая среда, состав на 615,0 мл: | ||
| Панкреатический гидролизат казеина | 11,2 г | |
| Панкреатический гидролизат желатина | 5,3 г | |
| Глюкоза | 5,0 г | |
| NaCI | 0,875 г | |
| Говяжий экстракт | 0,525 г | |
| Дрожжевой экстракт | 0,525 г | |
| Настой говяжьего сердца, сухой | 0,35 г |
Приготовление базовой среды. Добавляют компоненты в дистиллированную или деионизированную воду, доводят объем до 615,0 мл и тщательно перемешивают. Устанавливают значение pH 7,5. Стерилизуют автоклавированием при температуре 121°С в течение 15 мин. Стерильную базовую среду охлаждают до температуры (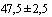 )°С.
)°С.
Приготовление раствора свежего дрожжевого экстракта: 100 г пекарских дрожжей размельчают и добавляют в 200,0 мл дистиллированной или деионизированной воды. Ставят на водяную баню и доводят температуру до 80°С. Прогревают в течение 10 минут, после чего, центрифугируют и отбирают супернатант. Супернатант стерилизуют через фильтр с размером пор 0,22 мкм и разливают в стерильные флаконы. Хранят при температуре 6 - 8°С не более 14 дней, при минус 16 - 20°С не более 3-х месяцев.
Приготовление среды. Сыворотку эмбриональную бычью инактивируют прогреванием на водяной бане при температуре (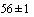 )°С в течение 1 ч. Растворяют 1 000 000 Ед пенициллина в 10 мл дистиллированной или деионизованной воды и стерилизуют через мембранный фильтр с размером пор 0,22 мкм. Растворяют 10 мг амфотерицина В в 20 мл дистиллированной или деионизованной воды и стерилизуют через мембранный фильтр с размером пор 0,22 мкм. Растворяют 100 мг полимиксина В в 10 мл дистиллированной или деионизованной воды и стерилизуют через мембранный фильтр с размером пор 0,22 мкм. К 615,0 мл стерильной охлажденной до температуры (
)°С в течение 1 ч. Растворяют 1 000 000 Ед пенициллина в 10 мл дистиллированной или деионизованной воды и стерилизуют через мембранный фильтр с размером пор 0,22 мкм. Растворяют 10 мг амфотерицина В в 20 мл дистиллированной или деионизованной воды и стерилизуют через мембранный фильтр с размером пор 0,22 мкм. Растворяют 100 мг полимиксина В в 10 мл дистиллированной или деионизованной воды и стерилизуют через мембранный фильтр с размером пор 0,22 мкм. К 615,0 мл стерильной охлажденной до температуры (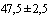 )°С базовой среде в асептических условиях добавляют 170,0 мл стерильной инактивированной сыворотки эмбриональной бычьей, 50,0 мл стерильного CMRL 1066 10Х с глутамином, 35,0 мл стерильного раствора свежего дрожжевого экстракта, 20,0 мл раствора фенолового красного, 10,0 мл стерильного раствора пенициллина. 2 мл стерильного раствора амфотерицина В и 5 мл стерильного раствора полимиксина В. Тщательно перемешивают и в асептических условиях разливают в стерильные пробирки.
)°С базовой среде в асептических условиях добавляют 170,0 мл стерильной инактивированной сыворотки эмбриональной бычьей, 50,0 мл стерильного CMRL 1066 10Х с глутамином, 35,0 мл стерильного раствора свежего дрожжевого экстракта, 20,0 мл раствора фенолового красного, 10,0 мл стерильного раствора пенициллина. 2 мл стерильного раствора амфотерицина В и 5 мл стерильного раствора полимиксина В. Тщательно перемешивают и в асептических условиях разливают в стерильные пробирки.
Нормативные и методические документы
1. Федеральный закон от 30.03.1999 № 52-ФЗ «О санитарно-эпидемиологическом благополучии населения».
2. СанПиН 3.3686-21 «Санитарно-эпидемиологические требования по профилактике инфекционных болезней».
3. СанПиН 2.1.3684-21 «Санитарно-эпидемиологические требования к содержанию территорий городских и сельских поселений, к водным объектам, питьевой воде и питьевому водоснабжению населения, атмосферному воздуху, почвам, жилым помещениям, эксплуатации производственных, общественных помещений, организации и проведению санитарно-противоэпидемических (профилактических) мероприятий».
4. МР 3.1.0222-20 «Молекулярная диагностика инфекций, вызванных бактериями рода Mycoplasma, у детей».
5. МУ 4.2.2039-05 «Техника сбора и транспортирования биоматериалов в микробиологические лаборатории».
6. МУ 1.3.2569-09 «Организация работы лабораторий, использующих методы амплификации нуклеиновых кислот при работе с материалом, содержащим микроорганизмы I-IV групп патогенности».
7. МУ 3.1.2.3047-13 «Эпидемиологический надзор за внебольничными пневмониями».
8. МУК 4.2.3115-13 «Лабораторная диагностика внебольничных пневмоний».
9. МУ 1.3.2569-09 «Организация работы лабораторий, использующих методы амплификации нуклеиновых кислот при работе с материалом, содержащим микроорганизмы I-IV групп патогенности».
10. Клинические рекомендации. Внебольничная пневмония у взрослых.
11. Клинические рекомендации. Пневмония (внебольничная). Возрастная категория: Дети.
Библиографические ссылки
1. Внебольничная пневмония у взрослых: практические рекомендации по диагностике, лечению и профилактике: Пособие для врачей /А. Г. Чучалин, с соавт. М., - 2010. - 106 с.
2. Чулков B.C., Минина Е.Е., Медведева JI.B. Использование в клинической практике метода индуцированной мокроты у пациентов с бронхиальной астмой. Acta biomedica scientifica. 2022; Т. 7(5-2). - С.42-55.
3. Киличева Т.А. Микоплазменные пневмонии/Т.А. Киличева, Бокматова, М.М. Алимова//Актуальные научные исследования современном мире. - 2017. - № 12(32). С.26-32.
4. Сперанская Е.В. Роль бактерий родов Mycoplasma и Ureaplasma в развитии воспалительных заболеваний органов дыхания у детей Е.В. Сперанская, B.Н. Мазепа, Н.Ф. Бруснигина и др. //Медицинский альманах. 2011. - № 4(17). - C. 49 - 50.
5. Atlas R. М., Snyder J. W. Handbook of media for clinical and public health microbiology. - CRC Press. - 2013. - 578 p.
6. Waites, K.B. Mycoplasma pneumoniae from the respiratory tract and beyond / K.B.Waites, L. Xiao, Y. Liu, M.F. Balish, T.P. Atkinson // Clin. Microbiol. Rev. - 2017.-V. 30.-P. 747 809.
7. Vervloet L.A. Infection by Mycoplasma pneumoniae and its importance as an etiological agent in childhood community-acquired pneumonias/ L.A. Vervloet, C. Marguet, P.A. Camargos // Braz. J. Infect. Dis. Waites K.B., Xiao L., Liu Y., Balish M.F., Atkinson T.P. - 2007. Vol. 11, N. 5. P. 507 - 514.
8. Кокорева С.П. Микоплазменная пневмония и факторы риска её развития при вспышке Респираторного микоплазмоза в детском коллективе/ С.П. Кокорева, О.А. Разуваева// Вопросы практической педиатрии. Waites К.В., Xiao L., Liu Y., Balish M.F., Atkinson T.P. 2016. Т. 11, № . 2. - C.65 - 70.
9. Царькова C.A. Характеристика микоплазменной пневмонии у детей и анализ качества антимикробной терапии / С.А. Царькова, Д.Е. Костенко, О.А. Онищенко // Вестник Уральского государственного медицинского университета. - 2019. - № 3. С.108 - 113.
------------------------------
1 МУК 4.2.3115-13 «Лабораторная диагностика внебольничных пневмоний», утвержденные руководителем Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека, Главным государственным санитарным врачом Российской Федерации 21.10.2013 (далее - МУК 4.2.3115-13); Клинические рекомендации. Внебольничная пневмония у взрослых, утвержденные Минздравом России 25.08.2021; Клинические рекомендации. Пневмония (внебольничная). Возрастная категория: Дети, утвержденные Минздравом России 18.01.2022 (далее Клинические рекомендации. Пневмония (внебольничная)).
2 Примечание: при микробиологическом выделении культур М. pneumoniae и других микоплазм исключительно важное значение имеют соблюдение правил отбора, хранения и транспортирования образцов материала для диагностики РМ.
3 Глава IV СанПиН 3.3686-21 «Санитарно-эпидемиологические требования по профилактике инфекционных болезней», утвержденных постановлением Главного государственного санитарного врача Российской Федерации от 28.01.2021 № 4 (зарегистрировано в Минюсте России 15.02.2021, регистрационный № 62500), с изменениями, внесенными постановлением Главного государственного санитарного врача Российской Федерации от 11.02.2022 № 5 (зарегистрировано Минюстом России 01.03.2022, регистрационный № 67587); от 25.05.2022 № 16 (зарегистрировано Минюстом России 21.06.2022, регистрационный № 68934) (далее - СанПиН 3.3686-21).
4 Примечание: не допускается повторных циклов оттаивания - замораживания.
5 Примечание: не рекомендуется использование транспортных сред, содержащих гентамицин или другой аминогликозид, поскольку они могут подавлять рост микоплазм.
6 Примечание: допускается использование реактивов и вспомогательного оборудования с аналогичными или лучшими характеристиками.
7 Глава IV СанПиН 3.3686-21.
8 МУК 4.2.3115-13.
9 МУК 4.2.3115-13; Клинические рекомендации. Пневмония (внебольничная).
10 Глава IV СанПиН 3.3686-21.
11 Глава X СанПиН 2.1.3684-21 «Санитарно-эпидемиологические требования к содержанию территорий городских и сельских поселений, к водным объектам, питьевой воде и питьевому водоснабжению населения, атмосферному воздуху, почвам, жилым помещениям, эксплуатации производственных, общественных помещений, организации и проведению санитарнопротивоэпидемических (профилактических) мероприятий», утвержденных постановлением Главного государственного санитарного врача Российской Федерации от 28.01.2021 № 3 (зарегистрировано Минюстом России 29.01.2021, регистрационный № 62297), с изменениями, внесенными постановлением Главного государственного санитарного врача Российской Федерации от 26.06.2021 № 16 (зарегистрировано Минюстом России 07.07.2021, регистрационный № 64146); от 14.12.2021 № 37 (зарегистрировано Минюстом России 30.12.2021, регистрационный № 66692); от 14.02.2022 № 6 (зарегистрировано Минюстом России 17.02.2022, регистрационный № 67331).
12 Примечание: допускается использование питательных сред с аналогичными или лучшими характеристиками.
Обзор документа
Представленные рекомендации описывают алгоритм отбора, хранения и транспортирования биоматериала от больных с симптомами поражения верхних и нижних дыхательных путей, переболевших или бессимптомных бактерионосителей с целью лабораторной диагностики респираторного микоплазмоза. Определены виды биоматериала.



(1).jpg)


