Об актуальных изменениях в КС узнаете, став участником программы, разработанной совместно с АО ''СБЕР А". Слушателям, успешно освоившим программу, выдаются удостоверения установленного образца.
(1).jpg)
Программа разработана совместно с АО ''СБЕР А". Слушателям, успешно освоившим программу, выдаются удостоверения установленного образца.

Коллегия Евразийской экономической комиссии в соответствии с пунктом 3 статьи 3 и статьей 7 Соглашения о единых принципах и правилах обращения лекарственных средств в рамках Евразийского экономического союза от 23 декабря 2014 года, а также в целях обеспечения применения уполномоченными органами (экспертными организациями) государств - членов Евразийского экономического союза единых подходов при приеме документов, входящих в состав модуля 1 регистрационного досье лекарственного препарата, в государствах признания в рамках процедур регистрации, подтверждения регистрации и внесения изменений в регистрационное досье лекарственного препарата согласно Правилам регистрации и экспертизы лекарственных средств для медицинского применения, утвержденным Решением Совета Евразийской экономической комиссии от 3 ноября 2016 г. № 78,
рекомендует государствам - членам Евразийского экономического союза по истечении 30 календарных дней с даты опубликования настоящей Рекомендации на официальном сайте Евразийского экономического союза при предоставлении заявителями документов, входящих в состав модуля 1 регистрационного досье лекарственного препарата, в форме электронного общего технического документа в рамках процедур регистрации, подтверждения регистрации и внесения изменений в регистрационное досье лекарственного препарата применять Руководство согласно приложению.
|
Председатель Коллегии Евразийской экономической комиссии |
М. Мясникович |
Приложение
к Рекомендации Коллегии
Евразийской экономической комиссии
от 5 сентября 2023 г. № 23
1. Настоящее Руководство содержит рекомендации по представлению заявителями документов модуля 1 регистрационного досье лекарственного препарата в форме электронного общего технического документа (далее - эОТД) в уполномоченный орган (экспертную организацию) государства признания в соответствии с Правилами регистрации и экспертизы лекарственных средств для медицинского применения, утвержденными Решением Совета Евразийской экономической комиссии от 3 ноября 2016 г. № 78 (далее - Правила регистрации и экспертизы).
2. Заявитель в рамках процедур, предусмотренных разделами V.II и VI Правил регистрации и экспертизы, а именно при регистрации и экспертизе лекарственного препарата по процедуре взаимного признания в государстве признания и по децентрализаванной процедуре, представляет в уполномоченный орган (экспертную организацию) государства признания документы и данные (в том числе, документы, специфичные для государств - членов Евразийского экономического союза (далее - государства-члены, Союз)) модуля 1 эОТД в электронном виде (далее - электронный вид) или модуля 1 эОТД в виде электронного документа (далее - электронный документ), подготовленного в соответствии с требованиями законодательства государства-члена к электронным документам.
При подаче заявления о регистрации и экспертизе лекарственного препарата в рамках процедуры взаимного признания в государстве признания заявитель представляет в уполномоченный орган (экспертную организацию) государства признания документы, модуля 1 регистрационного досье специфичные для государств-членов на электронном носителе или посредством загрузки через личный кабинет в электронном виде или в виде электронных документов (в том числе актуализированных документов, относящихся исключительно к государству признания). В сопроводительном письме заявитель указывает сведения о всех внесенных в регистрационное досье лекарственного препарата (далее - регистрационное досье) изменениях в случае, если они были инициированы до даты подачи заявления на регистрацию лекарственного препарата в государства признания (с указанием номеров заявлений и приложением копий решений (заключений) уполномоченного органа референтного государства).
3. В соответствии с положениями приложения № 5 к Правилам регистрации и экспертизы, общий технический документ и эОТД состоят из 5 модулей. Модуль 1 является специфичным для государств-членов. Модули 2-5 являются общими для всех государств-членов.
4. Не все документы модуля 1 могут быть специфичными для государств-членов.
5. В государство признания обязательно представляются в составе модуля 1 только документы, специфичные для государств-членов в электронном виде или в виде электронного документа.
В соответствии с положениями актов органов Союза в сфере обращения лекарственных средств к специфичным для государств-членов документам относятся:
| Код структурного элемента | Наименование документа (структурного элемента эОТД) | Примечание о необходимости представления документа в форме эОТД | Код вида документа |
|---|---|---|---|
| 1 | административная информация | ||
| 1.0 | сопроводительное письмо | представление обязательно | 01001 |
| 1.2.1 | заявление о регистрации лекарственного препарата (приведении регистрационного досье лекарственного препарата в соответствие с требованиями Союза) | представление обязательно | 01002 |
| 1.2.2 | документы, подтверждающие оплату экспертных работ и (или) сбора (пошлины) за регистрацию в соответствии с законодательством государства-члена, осуществляющего регистрацию | представление обязательно | 01005 |
| 1.2.5 | заключение (рекомендация) уполномоченного органа (экспертной организации) государства-члена по итогам предварительного научного консультирования относительно данного лекарственного препарата в государстве-члене | допускается представление при наличии и в случае, если отсутствует в регистрационном досье, представленном заявителем в референтное государство | 01016 |
| 1.2.6 | рекомендация Экспертного комитета по лекарственным средствам по итогам предварительного научного консультирования относительно данного лекарственного препарата | допускается представление при наличии и в случае, если она отсутствует в регистрационном досье, представленном заявителем в референтное государство | 01011 |
| 01012 | |||
| 1.3.1 | проекты общей характеристики лекарственного препарата, инструкции по медицинскому применению (листка-вкладыша) на русском языке | допускается представление только в случаях, когда необходимо представление на языке государства-члена1 или в связи с наличием другого торгового наименования или другого представителя держателя регистрационного удостоверения в государстве признания. Согласно Правилам регистрации и экспертизы по итогам процедуры признания в государстве признания заявителю выдают инструкцию по медицинскому применению лекарственного препарата, общую характеристику лекарственного препарата на языке государства-члена | 02001 |
| 02002 | |||
| 1.3.2 | макеты первичной (внутренней) и вторичной (потребительской), промежуточной упаковок на русском языке | допускается представление только в случаях, когда необходимо представление на языке государства-члена2 или в связи с наличием другого торгового наименования или другого представителя держателя регистрационного удостоверения в государстве признания Согласно Правилам регистрации и экспертизы по итогам процедуры в государстве признания выдают держателю регистрационного удостоверения макеты первичной (внутренней) и вторичной (потребительской), промежуточной упаковок на языке государства-члена (при необходимости) | 02003 |
| 02004 | |||
| 02005 | |||
| 02006 | |||
| 02007 | |||
| 02008 | |||
| 1.5.7 | проект нормативного документа по качеству лекарственного препарата, подготовленный в соответствии с Руководством по составлению нормативного документа по качеству лекарственного препарата, утвержденным Решением Коллегии Евразийской экономической комиссии от 7 сентября 2018 г. № 151 | представляется копия утвержденного референтным государством нормативного документа по качеству лекарственного препарата для согласования | 13028 |
| 1.8.1 | письмо держателя регистрационного удостоверения о дополнительном торговом наименовании лекарственного препарата | допускается представление только в случае, если торговое наименование лекарственного препарата в государстве признания отличается от торгового наименования, лекарственного препарата, утвержденного референтным государством | 01015 |
| 1.10.1 | мастер-файл системы фармаконадзора держателя регистрационного удостоверения в соответствии с требованиями Правил надлежащей практики фармаконадзора Евразийского экономического союза, утвержденных Решением Совета Евразийской экономической комиссии от 3 ноября 2016 г. № 87, или краткая характеристика системы фармаконадзора держателя регистрационного удостоверения | допускается представление при наличии другого представителя держателя регистрационного удостоверения в государстве признания | 07001 |
| 07002 | |||
| 1.10.2 | письменное подтверждение того, что держатель регистрационного удостоверения имеет в своем распоряжении уполномоченное лицо, ответственное за фармаконадзор на территории государства-члена | допускается представление при наличии другого представителя держателя регистрационного удостоверения в государстве признания | 07003 |
| 1.10.3 | план управления рисками на лекарственный препарат, заявляемый на регистрацию в соответствии с требованиями Правил надлежащей практики фармаконадзора Евразийского экономического союза, утвержденных Решением Совета Евразийской экономической комиссии от 3 ноября 2016 г. № 87 | допускается представление проекта для утверждения при наличии другого представителя держателя регистрационного удостоверения в государстве признания или при наличии утвержденного в рамках текущей процедуры утверждаемого референтным государством плана управления рисками - его представление необходимо для согласования государством признания | 07004 |
| 1.10.4 | документы, заверенные надлежащим образом, подтверждающие наличие взаимодействия, обеспечивающего надлежащее выполнение несколькими юридическими лицами всех обязанностей держателя регистрационного удостоверения | представляются при необходимости | 07005 |
| 1.11 | копии документов, подтверждающих регистрацию товарного знака | допускается представление только в случаях, когда торговое наименование лекарственного препарата в государстве признания отличается от торгового наименования лекарственного препарата, утвержденного референтным государством | 08001 |
------------------------------
1 В этом случае проекты общей характеристики лекарственного препарата и инструкции по медицинскому применению лекарственного препарата представляют собой перевод текста утвержденных референтным государством общей характеристики лекарственного препарата и инструкции по медицинскому применению лекарственного препарата.
2 В этом случае макеты упаковок лекарственного препарата представляют собой перевод утвержденных референтным государством макетов упаковок лекарственного препарата.
------------------------------
6. Заявителем могут быть представлены в уполномоченный орган (экспертную организацию) государства признания другие документы, в том числе по запросу или согласованию с уполномоченным органом (экспертной организацией) государства признания дополнительные документы модуля 1, не указанные в пункте 5 настоящего Руководства документы с условием обоснования их специфичности для государства-члена.
7. Уполномоченные органы (экспертные организации) государств-членов вправе размещать на своих официальных сайтах в информационно-телекоммуникационной сети Интернет дополнительные рекомендации заявителям в части представления разъяснений и (или) в целях обеспечения соблюдения заявителями специфичных требований государств-членов в случае, если они не противоречат положениям настоящего Руководства и актов органов Союза в сфере обращения лекарственных средств.
8. В целях соблюдения целостности, неизменности, актуальности, достоверности и версионности эОТД на протяжении его "жизненного цикла", когда заявитель представляет первичные версии (последовательности) эОТД в уполномоченные органы (экспертные организации) государств-членов, а затем последовательно или параллельно вносит изменения в них, модуль 1 для разных государств-членов рассматривается в качестве разных экземпляров модуля 1, изолированных друг от друга (как показано на рисунке), в которых допускается представление различного набора документов, специфичных для государств-членов с учетом их статуса (референтное государство или государство признания).
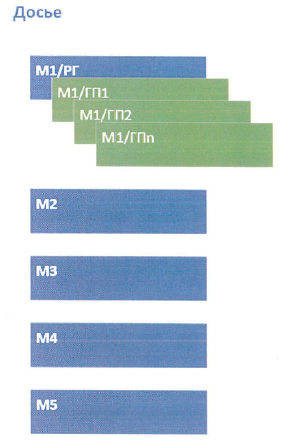
Синий цвет - модули регистрационного досье, представляемые в уполномоченный орган (экспертную организацию) референтного государства.
Зеленый цвет - модули регистрационного досье, представляемые в уполномоченный орган (экспертную организацию) государства признания
9. В качестве фактора, обеспечивающего изоляцию модулей друг от друга, используется атрибут csdo:UnifiedCountryCode, являющийся обязательным в структуре электронного документа R.022, а также не допускающий множественности значений. Структура документа в электронном виде "Сведения регистрационного дела или регистрационного досье лекарственного препарата" (R.022) предназначена для представления в электронном виде документов регистрационного дела или регистрационного досье лекарственного препарата в соответствии с приложениями № 4 и № 5 к Правилам регистрации и экспертизы и Требованиями к электронному виду заявлений и документов регистрационного досье, представляемых при осуществлении регистрации и экспертизы лекарственных препаратов для медицинского применения, утвержденными Решением Коллегии Евразийской экономической комиссии от 30 июня 2017 г. № 79 (далее - Требования). Таким образом, один документ R.022 (в XML-формате) не может содержать одновременно документы для разных государств-членов.
10. Операции, выполняемые над документами эОТД в структуре R.022, могут быть применены только к документам в рамках государства, указанного в атрибуте csdo:UnifiedCountryCode. Указанное ограничение позволяет гарантировать изоляцию модулей разных государств-членов на протяжении всего "жизненного цикла" регистрационного досье лекарственного препарата.
11. Заявители принимают во внимание ограничение, накладываемое правилом формирования номеров последовательности регистрационного досье лекарственного препарата в составе эОТД. Каждая новая подача заявления на выполнение процедур, связанных с регистрацией, сопровождается представлением версии эОТД регистрационного досье лекарственного препарата имеющей порядковый номер больше предыдущих номеров в каждом из уполномоченных органов (экспертных организаций) государств-членов. При этом допускается осуществлять пропуск номеров, а также использовать один и тот же номер для подачи в разные государства признания (параллельная подача). При этом номер последовательности подачи в государстве признания не должен совпадать с номером последовательности в референтном государстве.
12. Первичная версия (последовательность) модуля 1 регистрационного досье для уполномоченного органа (экспертной организации) государства признания содержит только те документы, которые являются специфичными для уполномоченных органов (экспертных организаций) государства признания, поскольку государство признания имеет доступ к документам модуля 1 референтного государства.
Примеры подачи заявления и регистрационного досье лекарственного препарата в уполномоченные органы (экспертные организации) одного референтного государства и двух государств признания по процедуре взаимного признания и по децентрализованной процедуре, приводятся в приложении.
Приложение
к Руководству по представлению
документов, входящих в состав
модуля 1 регистрационного досье
лекарственного препарата, в форме
электронного общего технического
документа в уполномоченные
органы (экспертные организации)
государств признания
Таблица 1
| Государства-члены | Республика Казахстан (KZ) | Российская Федерация (RU) | Республика Армения (AM) | Российская Федерация (RU) | KZ RU AM | Республика Армения (AM) | |||
|---|---|---|---|---|---|---|---|---|---|
| Номер версии (подачи) | 0000 | 0001 | 0002 | 0003 | 0004 | 0005 | 0006 | 0007 (KZ) 0008 (RU, AM) | 0009 |
| Описание | Первоначальная подача в РГ | Ответ на запрос № 1 РГ (после оценки ответа версия, одобренная РГ) | Ответ на запрос № 2 РГ (после оценки ответа версия, одобренная РГ) | Подача в ГП 1 | Подача в ГП2 | Ответ на запрос ГП2 | Ответ на запрос ГП 1 | Внесение значимого изменения II типа, затрагивающего общую характеристику лекарственного препарата | Внесение в ГП 2 незначимого изменения IA типа, затрагивающего макеты на языке государства-члена |
| Модуль / государство | Допустимые операции (hcsdo:OperationAtribute) | ||||||||
| Номер версии (подачи) | 0000 | 0001 | 0002 | 0003 | 0004 | 0005 | 0006 | 0007 (KZ) 0008 (RU, AM) | 0009 |
| M1 / KZ | только new | любые | любые | любые | |||||
| M1 / RU | только new | любые | любые | ||||||
| M1 / AM | только new | любые | любые | любые | |||||
| M1 / BY | |||||||||
| M1 / KG | |||||||||
| M2 / KZ | только new | любые | любые | любые | |||||
| M3 / KZ | только new | любые | любые | ||||||
| M4 / KZ | только new | любые | любые | ||||||
| M5 / KZ | только new | любые | любые | ||||||
| Количество XML R.022 | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 3 | 1 |
| Состав XML R.022 | UnifiedCountryCode=KZ SubmissionSequence=0000 | UnifiedCountryCode=KZ SubmissionSequence=0001 | UnifiedCountryCode=KZ SubmissionSequence=0002 | UnifiedCountryCode=RU SubmissionSequence=0003 | UnifiedCountryCode=AM SubmissionSequence=0004 | UnifiedCountryCode=AM SubmissionSequence=0005 | UnifiedCountryCode=RU SubmissionSequence=0006 | UnifiedCountryCode=KZ SubmissionSequence=0007 UnifiedCountryCode=RU SubmissionSequence=0007 UnifiedCountiyCode=AM SubmissionSequence=0007 | UnifiedCountryCode=AM SubmissionSequence=0008 |
Примечание. Сокращения, используемые в настоящем примере, означают следующее:
"РГ" - референтное государство;
"ГП" - государство признания.
В данном примере в качестве референтного государства заявителем указана Республика Казахстан.
После одобрения заявление одновременно подается в уполномоченные органы (экспертные организации) государств признания - Российскую Федерацию и Республику Армения.
Ответ на запрос уполномоченного органа (экспертной организации) Республики Армения заявителем предоставлен ранее ответа на запрос уполномоченного органа (экспертной организации) Российской Федерации.
В целях соблюдения Требований к электронному виду заявлений и документов регистрационного досье, представляемых при осуществлении регистрации и экспертизы лекарственных препаратов для медицинского применения, утвержденных Решением Коллегии Евразийской экономической комиссии от 30 июня 2017 г. № 79 указание сведений о каждом представлении регистрационного досье лекарственного препарата (подаче, версии (последовательности предоставления регистрационного досье: (SubmissionSequence)) в виде 4 арабских цифр, начиная с 0000, следует выполнять с учетом ограничения, указанного в пункте 10 настоящего Руководства.
В соответствии с приложением № 19 к Правилам регистрации и экспертизы при внесении значимых изменений II типа заявитель одновременно представляет всем соответствующим органам (экспертным организациям) заявление на внесение изменений согласно приложению № 2 к указанным Правилам на бумажном носителе или в виде электронного документа, подписанного электронной подписью, документы, подтверждающие оплату сбора (пошлины) за внесение изменений в случаях и порядке, предусмотренных законодательством государств-членов. При этом заявитель представляет в уполномоченный орган (экспертную организацию) референтного государства регистрационное досье лекарственного препарата на изменение (уведомление), содержащее элементы, перечисленные в Дополнении IV приложения № 19 к Правилам регистрации и экспертизы. При необходимости и по согласованию с экспертной организацией заявитель представляет в уполномоченный орган (экспертную организацию) референтного государства образцы лекарственных препаратов, стандартные образцы активных фармацевтических субстанций и родственных примесей, специфические реагенты и другие материалы, необходимые для проведения лабораторных испытаний.
С учетом необходимости одновременного представления указанного заявления в уполномоченные органы (экспертные организации) нескольких государств признания, заявитель вправе представить модуль 1 эОТД в виде версии (последовательности) модуля 1 для государства признания с одним порядковым номером в соответствии с таблицей 2.
Таблица 2
| Государства-члены | KZ RU AM |
|---|---|
| Номер версии (подачи) | 0007 |
| Описание | внесение значимого изменения II типа, затрагивающего общую характеристику лекарственного препарата |
| Модуль / государство | допустимые операции (hcsdo: OperationAtribute) |
| M1 / KZ | любые |
| M1 / RU | любые |
| Номер версии (подачи) | 0007 |
| M1 / АМ | любые |
| M1 / BY | |
| M1 / KG | |
| M2 / KZ | любые |
| M3 / KZ | |
| M4 / KZ | |
| M5 / KZ | |
| Количество XML R.022 | 3 |
| Состав XML R.022 | UnifiedCountryCode=KZ SubmissionSequence=0007 UnifiedCountryCode=RU SubmissionSequence=0007 UnifiedCountryCode=AM SubmissionSequence=0007 |
Вместе с тем при одновременной подаче заявления рекомендуется использовать порядковые номера версии (последовательности) модуля 1 для государства признания и представлять этот модуль в соответствии с таблицей 3.
Таблица 3
| Государства-члены | KZ | RU | AM |
|---|---|---|---|
| Номер версии (подачи) | 0007 | 0008 | 0009 |
| Описание | внесение значимого изменения II типа, затрагивающего общую характеристику лекарственного препарата | ||
| Модуль / государство | допустимые операции (hcsdo:OperationAtribute) | ||
| M1 / KZ | любые | ||
| M1 / RU | любые | ||
| M1 / AM | любые | ||
| M1 / BY | |||
| 7M1 / KG | |||
| M2 / KZ | любые | ||
| M3 / KZ | |||
| M4 / KZ | |||
| M5 / KZ | |||
| Количество XML R.022 | 1 | 1 | 1 |
| Состав | UnifiedCountryCode= KZ | UnifiedCountryCode= RU | UnifiedCountryCode= AM |
| XML R.022 | Submissions Sequence= 0007 | Submissions Sequence= 0008 | SubmissionSequence= 0009 |
Следует также учитывать рекомендации, указанные в пунктах 2 - 4 настоящего Руководства. Так, в рамках процедуры, описанной в примере для Республики Армения, в эОТД представляются документы в соответствии с таблицей 4.
Таблица 4
| Код структурного элемента | Наименование документа (структурного элемента в эОТД) | Примечание о необходимости представления документа в эОТД | Код вида документа |
|---|---|---|---|
| 1 | административная информация | ||
| 1.0 | сопроводительное письмо | представление обязательно | 01001 |
| 1.2.1 | заявление о регистрации лекарственного препарата (приведении регистрационного досье лекарственного препарата в соответствие с требованиями Союза) | представление обязательно | 01002 |
| 1.2.2 | документ, подтверждающий оплату экспертных работ и (или) сбора (пошлины) за регистрацию в соответствии с законодательством государства-члена | представление обязательно | 01005 |
| 1.3.1 | проекты общей характеристики лекарственного препарата, инструкции по медицинскому применению (листка-вкладыша) на русском языке | допускается только в случае если необходимо представление на языке государства-члена (в виде перевода) с учетом внесенных изменений | 02001 |
Таблица 1
| Государства-члены | Республика Казахстан (KZ) | Российская Федерация (RU) | Республика Армения (AM) | Республика Казахстан (KZ) | Российская Федерация (RU) | Республика Армения (AM) | KZ RU AM | Республика Армения (AM) |
|---|---|---|---|---|---|---|---|---|
| Номер версии (подачи) | 0000 | 0001 | 0002 | 0003 | 0004 | 0005 | 0006 (KZ) 0007 (RU, AM) | 0008 |
| Описание | Первоначальная подача в РГ | Подача в ГП 1 | Подача в ГП2 | Ответ на запрос РГ | Подача в ГП 1 документов, которые требуют корректировки при ответе на запрос РГ (при необходимости) | Подача в ГП 2 документов, которые требуют корректировки при ответе на запрос РГ (при необходимости) | Внесение значимого изменения II типа, затрагивающего общую характеристику лекарственного препарата | Внесение незначимого изменения IA типа в ГП 2, затрагивающего макеты на языке государства-члена |
| Модуль / государство | Допустимые операции (hcsdo:OperationAtribute) | |||||||
| M1 / KZ | только new | любые | любые | |||||
| M1 /RU | только new | любые | любые | |||||
| M1 / AM | только new | любые | любые | любые | ||||
| M1 / BY | ||||||||
| M1 / KG | ||||||||
| M2 / KZ | только new | любые | любые | |||||
| M3 / KZ | только new | любые | ||||||
| M4 / KZ | только new | любые | ||||||
| M5/KZ | только new | любые | ||||||
| Количество XML R.022 | 1 | 1 | 1 | 1 | 1 | 1 | 3 | 1 |
| Состав XML R.022 | UnifiedCountryCode=KZ SubmissionSequence=0000 | UnifiedCountryCode=RU SubmissionSequence=0001 | UnifiedCountryCode=AM SubmissionSequence=0002 | UnifiedCountryCode=KZ SubmissionSequence=0003 | UnifiedCountryCode=RU SubmissionSequence=0004 | UnifiedCountryCode=AM SubmissionSequence=0005 | UnifiedCountryCode=KZ SubmissionSequence=0006 UnifiedCountryCode=RU SubmissionSequence=0006 UnifiedCountryCode=AM SubmissionSequence=0006 | UnifiedCountryCode=AM SubmissionSequence=0007 |
Примечание. Сокращения, используемые в настоящем примере, означают следующее:
"РГ" - референтное государство;
"ГП" - государство при
В данном примере в качестве референтного государства заявителем указаны:
в качестве референтного государства - Республика Казахстан;
в качестве государств признания - Республика Армения и Российская Федерация.
В целях соблюдения Требований к электронному виду заявлений и документов регистрационного досье, представляемых при осуществлении регистрации и экспертизы лекарственных препаратов для медицинского применения указание сведений о каждом представлении регистрационного досье лекарственного препарата (подаче, версии (последовательности предоставления регистрационного досье: (SubmissionSequence)) в виде 4 арабских цифр, начиная с 0000, следует выполнять с учетом ограничения, предусмотренного пунктом 10 настоящего Руководства.
В соответствии с положениями пункта 94 Правил регистрации и экспертизы общий запрос от экспертных организаций государств признания формируется референтным государством.
Вместе с тем следует учитывать, что при ответе на указанный запрос может потребоваться корректировка документов, специфичных для государств признания.
В соответствии с приложением № 19 к Правилам регистрации и экспертизы при внесении значимых изменений II типа заявитель одновременно представляет всем соответствующим уполномоченным органам (экспертным организациям) заявление на внесение изменений согласно приложению № 2 к указанным Правилам на бумажном носителе или в виде электронного документа, подписанного электронной подписью, документы, подтверждающие оплату сбора (пошлины) за внесение изменений в случаях и порядке, предусмотренных законодательством государств-членов. При этом заявитель представляет в уполномоченный орган (экспертную организацию) референтного государства регистрационное досье лекарственного препарата на изменение (уведомление), содержащее элементы, перечисленные в Дополнении IV приложения № 19 к Правилам регистрации и экспертизы. При необходимости и по согласованию с экспертной организацией заявитель представляет в уполномоченный орган (экспертную организацию) референтного государства образцы лекарственных препаратов, стандартные образцы активных фармацевтических субстанций и родственных примесей, специфические реагенты и другие материалы, необходимые для проведения лабораторных испытаний.
С учетом необходимости одновременного представления указанного заявления в уполномоченные органы (экспертные организации) нескольких государств признания, заявитель вправе представить модуль 1 эОТД в виде версии (последовательности) модуля 1 для государства признания с одним порядковым номером в соответствии с таблицей 2.
Таблица 2
| Государства-члены | RU AM |
|---|---|
| Номер версии (подачи) | 0006 |
| Описание | внесение значимого изменения II типа, затрагивающего общую характеристику лекарственного препарата |
| Модуль / государство | допустимые операции (hcsdo:OperationAtribute) |
| M1 / KZ | любые |
| M1 / RU | любые |
| M1 / AM | любые |
| M1 / BY | |
| M1 / KG | |
| M2/KZ | любые |
| M3/KZ | |
| M4/KZ | |
| M5/KZ | |
| Количество XML R.022 | 3 |
| Состав XML R.022 | UnifiedCountryCode=KZ SubmissionSequence=0006 UnifiedCountryCode=RU Submissionequence=0006 UnifiedCountryCode=AM SubmissionSequence=0006 |
Вместе с тем при одновременной подаче заявления рекомендуется использовать порядковые номера версии (последовательности) модуля 1 регистрационного досье для государства признания и представлять этот модуль в соответствии с таблицей 3.
Таблица 3
| Государства-члены | KZ | RU | AM |
|---|---|---|---|
| Номер версии (подачи) | 0006 | 0007 | 0008 |
| Описание | внесение значимого изменения II типа, затрагивающего общую характеристику лекарственного препарата | ||
| Модуль / государство | допустимые операции (hcsdo:OperationAtribute) | ||
| M1 /KZ | любые | ||
| M1 / RU | любые | ||
| M1 / AM | любые | ||
| Ml / BY | |||
| Ml / KG | |||
| M2/KZ | любые | ||
| M3 / KZ | |||
| M4/KZ | |||
| M5/KZ | |||
| Количество XML R.022 | 1 | 1 | 1 |
| Состав XML R.022 | UnifiedCountryCode= KZ SubmissionSequence= 0007 | UnifiedCountryCode= RU SubmissionSequence= 0008 | UnifiedCountryCode= AM SubmissionSequence= 0009 |
Следует также учитывать рекомендации, указанные в пунктах 2 - 4 настоящего Руководства. Так в рамках процедуры, описанной в примере для Республики Армения, в эОТД представляются документы в соответствии с таблицей 4.
Таблица 4
| Код структурного элемента | Наименование документа (структурного элемента в эОТД) | Примечание о необходимости предоставления документа в эОТД | Код вида документа |
|---|---|---|---|
| 1 | административная информация | ||
| 1.0 | сопроводительное письмо | предоставление обязательно | 01001 |
| 1.2.1 | заявление о регистрации лекарственного препарата для медицинского применения (приведении регистрационного досье лекарственного препарата в соответствие с требованиями Союза) | представление обязательно | 01002 |
| 1.2.2 | документ, подтверждающий оплату экспертных работ и (или) сбора (пошлины) за регистрацию в соответствии с законодательством государства-члена | представление обязательно | 01005 |
| 1.3.1 | проекты общей характеристики лекарственного препарата, инструкции по медицинскому применению (листка-вкладыша) на русском языке | допускается только в случаях, если необходимо представление на языке государства-члена (в виде перевода) с учетом внесенных изменений | 02001 |
Коллегия ЕЭК рекомендовала Руководство по представлению документов, входящих в состав модуля 1 регистрационного досье лекарственного препарата, в форме электронного общего технического документа в уполномоченные органы (экспертные организации) государств признания.
В государство признания обязательно представляются в составе модуля 1 только документы, специфичные для государств ЕАЭС в электронном виде или в виде электронного документа.