Методические указания МУ 3.1.3844-23 "Эпидемический надзор, лабораторная диагностика и профилактика геморрагической лихорадки с почечным синдромом" (утв. Федеральной службой по надзору в сфере защиты прав потребителей и благополучия человека 27 января 2023 г.)
Методические указания МУ 3.1.3844-23
"Эпидемический надзор, лабораторная диагностика и профилактика геморрагической лихорадки с почечным синдромом"
(утв. Федеральной службой по надзору в сфере защиты прав потребителей и благополучия человека 27 января 2023 г.)
ББК 51.903.2+51.944.4
Э71
ISBN 978-5-7508-1986-7
Введены впервые
I. Область применения
1.1. Настоящие методические указания (далее - МУ) определяют порядок организации и обеспечения эпидемиологического надзора, лабораторной диагностики и профилактики геморрагической лихорадки с почечным синдромом (далее - ГЛПС) в соответствии с санитарно-эпидемиологическими требованиями 1, а также методическими документами 2.
------------------------------
1 Глава XIX СанПиН 3.3686-21 "Санитарно-эпидемиологические требования по профилактике инфекционных болезней", утвержденных постановлением Главного государственного санитарного врача Российской Федерации от 28.01.2021 N 4 (зарегистрировано Минюстом России 15.02.2021, регистрационный N 62500), с изменениями, внесенными постановлениями Главного государственного санитарного врача Российской Федерации от 11.02.2022 N 5 (зарегистрировано Минюстом России 01.03.2022, регистрационный N 67587); от 25.05.2022 N 16 (зарегистрировано Минюстом России 21.06.2022, регистрационный N 68934) (далее - СанПиН 3.3686-21).
2 МР 3.1.0211-20 "Отлов, учет и прогноз численности мелких млекопитающих и птиц в природных очагах инфекционных болезнен", утвержденные Руководителем Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека, Главным государственным санитарным врачом Российской Федерации 03.09.2020 (далее - MP 3.1.0211-20).
------------------------------
1.2. МУ предназначены для специалистов органов и организаций Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека, а также могут быть использованы специалистами медицинских, санаторно-профилактических, образовательных организаций; специалистами организаций, осуществляющих дезинфекционную деятельность.
II. Общие положения
2.1. Возбудители хантавирусных инфекционных болезней входят в область Riboviria, тип Negarnaviricota, подтип Polyploviricotina, класс Ellioviricetes, порядок Bunyavirales, семейство Hantaviridae, подсемейство Maminantavirinae, род Orthohantavirus. К настоящему времени международным таксономическим комитетом зарегистрировано 38 ортохантавирусов, включая непатогенные для человека 3. Хантавирусы относятся ко II группе патогенности (опасности) по классификации патогенности, действующей на территории Российской Федерации 4.
------------------------------
3 Классификация международного таксономического комитета: Virus Taxonomy: 2018b Release.
4 Приложение 1 СанПиН 3.3686-21.
------------------------------
У людей описаны две клинические формы болезни, вызванной хантавирусами:
- ГЛПС, возбудителями которой являются вирусы Puumala orthohantavirus, Dobrava - Belgrade orthohantavirus (вирусы Саарема, Куркино, Сочи, Добрава), Hantaan orthohantavirus (вирусы Хантаан и Амур), Seoul orthohantavirus (вирус Сеул);
- хантавирусный (кардио-) пульмональный синдром, впервые описан в США в 1993 г., вызывается хантавирусами Andes orthohantavirus (вирусы Андес, Бермеджо, Каштелу-дос-Соньюс, Лечигуанас, Масиэль, Оран, Пергамино, Тунари), Bayou orthohantavirus (вирусы Байу, Луизиана, Катакамас), Black Creek Canal orthohantavirus, Cano Delgadito orthohantavirus, Choclo orthohanlavirus, Laguna Negra orthohantavirus (вирусы Лагуна Негро, Марина, Рио Маморе), Sin Nombre orthohantavirus (вирусы Син-Номбр, Блю Ривер, Мононгахела, Нью-Йорк) 3.
------------------------------
3 Классификация международного таксономического комитета: Virus Taxonomy: 2018b Release.
------------------------------
На территории Российской Федерации регистрируется только первая клиническая форма.
ГЛПС - острое вирусное природно-очаговое заболевание зоонозной природы, характеризующееся системным поражением мелких сосудов, геморрагическим диатезом, гемодинамическими расстройствами и своеобразным поражением почек по типу острого интерстициального нефрита с развитием острой почечной недостаточности. Больной человек является тупиком инфекции, передача возбудителя от человека к человеку не происходит.
Вирионы хантавирусов имеют сферическую форму, диаметр 90 - 11.0 нм. Геном образован одноцепочечной молекулой РНК негативной полярности, состоящей из трех (L, М и S) сегментов. Концы сегментов комплементарны, поэтому в составе нуклеокапсида РНК находится в кольцевой, нековалентнозамкнутой форме. Нуклеокапсид образован гликопротеином, ассоциированным с РНК (N-белок), также в нуклеокапсид включено несколько копий L-белка (транскриптазы). Снаружи нуклеокапсид покрыт двухслойным липидным суперкапсидом, имеющем "шипики", образованные поверхностными гликопротеинами Gn (прежнее название G1) и Gc (прежнее название G2), обладающими гемагглютинирутощей активностью. Репликативный цикл вирусов осуществляется в цитоплазме клетки.
Хантавирусы относительно устойчивы во внешней среде при температуре от 0 °C до плюс 20 °C, хорошо хранятся при температуре ниже минус 20 °C. В сыворотке крови больных людей сохраняются при плюс 4 °C свыше 4 суток. Чувствительны к температуре выше плюс 37 °C, при температуре плюс 56 °C инактивируются в течение 30 мин. Вирусы кислотолабилы - полностью инактивируются при pH ниже 5,0. Чувствительны к эфиру, хлороформу, ацетону, бензолу, ультрафиолетовым лучам.
III. Современные эпидемиологические особенности ГЛПС
3.1. Резервуарными хозяевами патогенных для человека хантавирусов являются грызуны из семейств мышиные (Muridae) и хомяковые (Cricetidae). Список млекопитающих Российской Федерации в соответствии с современной классификацией представлен в приложении 1 к настоящим МУ.
На территории европейской части Российской Федерации ГЛПС вызывают вирусы: Пуумала и два геноварианта вируса Добрава-Белград - вирусы Куркино и Сочи, Природными резервуарами для вируса Пуумала является рыжая полёвка (Myodes glareolus), для вируса Куркино - полевая мышь (Apodemus agrarius), для вируса Сочи - кавказская мышь (Sylvaemus ponticus).
В дальневосточных регионах Российской Федерации ГЛПС вызывают вирусы Хантаан, Амур и Сеул. Природными резервуарами для вируса Хантаан является полевая мышь (Apodemus agrarius), для вируса Амур - восточноазиатская мышь (Apodemus peninsulae), для вируса Сеул - серая крыса (Rattus norvegicus) 5.
------------------------------
5 П. 1572 главы XIX СанПиН 3.3686-21.
------------------------------
На территории Российской Федерации кроме шести патогенных циркулируют пять непатогенных или условно патогенных для человека хантавирусов - Тула, Адлер, Хабаровск, Хоккайдо и Топографов. Основными носителями хантавируса Тула и его геноварианта Адлер в Европейской части Российской Федерации являются обыкновенная (Microtus arvalis), восточноевропейская (Microtus rossiaemeridionalis) и кустарниковая (Microtus majori) полёвки. В Западной Сибири хантавирус Тула ассоциирован с узкочерепной полевкой (Lasiopodomys gregalis) и степной пеструшкой (Lagurus lagunis). На Дальнем Востоке хантавирус - Хабаровск и Хоккайдо ассоциированы с восточной (большой) и красно-серой полёвками (Alexandromys fortis u Craseomys rufocanus). Хантавирус Топографов в субарктике азиатской части Российской Федерации выделен от сибирского лемминга (Lemmus sibiricus).
Помимо грызунов, хантавирусы обнаруживаются у насекомоядных. На территории Западной Сибири у бурозубок рода Sorex выявлены хантавирусы Спвис (Sorex araneus, Sorex tundrensis, Sorex daphaenodon), Артыбаш (Sorex caecutiens), Кенкеме (Sorex roboratus), Якеши (Sorex isodon, Sorex ungiuculatus), Алтай (Sorex araneus), Лена (Sorex caecutiens). Эпидемиологическая значимость этих вирусов к настоящему времени не установлена.
Некоторые другие виды грызунов, широко распространенные на очаговой территории, в частности красная полёвка (Myodes rutilus), домовая (Mus musculus) и малая лесная мыши (Sylvaemus uralensis), не являются резервуарными хозяевами известных к настоящему времени хантавирусов. В период активизации природных очагов они могут инфицироваться в результате спиловера (переброса) хантавирусов от их основных природных хозяев. При этом такие виды мелких млекопитающих оказываются лишь случайными носителями вируса и тупиком инфекции, подобно человеку. Они не играют какой-либо эпидемиологической значимости, подтверждением чего является отсутствие повышения уровня заболеваемости ГЛПС даже при резком увеличении массовых видов грызунов, кроме резервуарных хозяев - основных источников заражения людей.
Активность очагов различных хантавирусов и их пространственное распределение тесно связаны с особенностями биологии и динамики популяций основных хозяев. В тех случаях, когда места обитания резервуарных хозяев перекрываются, на одной территорий могут сосуществовать паразитарные системы двух или более патогенных и/или непатогенных хантавирусов. В европейской лесостепи это вирусы Куркино, Тула и/или Пуумала, в Западной Сибири - Пуумала и Куркино, а на Дальнем Востоке - Амур, Хоккайдо и/или Хантаан и Хабаровск. Вероятно, такие очаги, как сочетанные, функционируют автономно и часто имеют асинхронную динамику, то есть их общую территорию нельзя трактовать как единый полигостальный очаг.
3.2. Общие черты, присущие хантавирусным зоонозам:
- ГЛПС - нетрансмиссивный зооноз, вирус циркулирует без участия членистоногих переносчиков;
- наличие у каждого хантавируса или его геноварианта, как правило, одного резервуарного хозяина, связанного с ним эволюционно, способного поддерживать очаги. Следствием этого является отсутствие очагов данного вируса за пределами ареала основного хозяина, который служит источником инфекции в природных очагах и отвечает за заражения людей на всех фазах эпизоотического цикла и на всем протяжении ареала данного вируса;
- бессимптомное течение инфекции - латентная (инаппарантная) форма инфекции в организме спонтанно инфицированных вирусоносителей, не влияющая на их жизнедеятельность (рост, размножение, подвижность, продолжительность жизни) и, соответственно, на численность и половозрастную структуру популяций;
- персистирующая инфекция с короткими периодами активного вирусоносительства - пожизненное (до 15 месяцев) сохранение вируса в организме резервуарного хозяина с активизацией размножения и выделения вируса во внешнюю среду с экскретами (слюной, мочой, калом), чаще всего в первый месяц после заражения;
- аэрогенный механизм передачи вируса - горизонтальная (эстафетная) передача возбудителя в популяции хозяина, происходящая преимущественно воздушно-пылевым путем;
- возможность длительного сохранения инфекционного вируса во внешней среде, что обеспечивает его эстафетную передачу в популяции хозяина и возможность заражения животных и людей без непосредственного контакта с вирусоносителями при достаточной концентрации возбудителя во внешней среде.
3.3. ГЛПС регистрируется на Евразийском континенте в пределах ареала резервуарных хозяев ее возбудителей. В Евразии нозоареал ГЛПС представлен двумя изолированными друг от друга территориями - европейской (страны Восточной и Центральной Европы, скандинавские и прибалтийские страны: Сербия, Хорватия, Словения, Македония, Черногория, Босния и Герцеговина, Болгария, Греция, Турция, Чехия, Словакия, Австрия, Бельгия, Германия, Франция, Швеция, Норвегия, Финляндия, Эстония, Литва, Латвия, в Российской Федерации территория от западных границ до р. Иртыш на востоке) и дальневосточной (Приморье, Хабаровский край, Амурская область, за рубежом - Китай, страны юго-восточной Азии).
3.4. В Российской Федерации около 97 % от общего количества ежегодно регистрируемых случаев ГЛПС приходится на европейскую часть страны и 3 % - на азиатскую. Распространение ГЛПС ограничивается тремя крупными ландшафтно-климатическими зонами, расположенными в Европейском регионе, на Западно-Сибирской равнине (частично) и на Дальнем Востоке Российской Федерации, в основном в лесных биотопах.
В европейской части Российской Федерации более 98 % случаев ГЛПС этиологически обусловлены вирусом Пуумала. Менее 3 % случаев ГЛПС вызваны вирусом Куркино в лесостепной зоне Центрального Черноземья и вирусом Сочи в Причерноморье. Наиболее активная очаговая территория в европейской части расположена в оптимуме ареала основного хозяина вируса Пуумала - рыжей полёвки - в широколиственных и хвойно-широколиственных лесах Среднего Поволжья и Приуралья. Почти 90 % всех регистрируемых в Российской Федерации случаев ГЛПС приходится на Приволжский федеральный округ. Ежегодная заболеваемость здесь достигает в среднем 15 на 100 тыс. населения;
Для Западной Сибири характерна спорадическая заболеваемость в пределах лесной ландшафтной зоны (подтайги и южной подзоны тайги Тюменской и Омской областей), обусловленная вирусами Пуумала и Куркино.
Ежегодная заболеваемость ГЛПС на Дальнем Востоке Российской Федерации составляет в среднем 2 на 100 тыс. населения и регистрируется, в основном, среди жителей Приморского и Хабаровского краев, Амурской области и Еврейской АО. Возбудителями инфекции являются вирусы: Хантаан, Амур и Сеул.
3.5. Основные механизмы передачи инфекции определены санитарно-эпидемиологическими требованиями 6.
------------------------------
6 П. 1573 главы XIX СанПиН 3.3686-21.
------------------------------
3.6. Человек эпидемической опасности не представляет, передача возбудителя от человека к человеку не происходит.
3.7. Инкубационный период - от 4 до 49 дней (в среднем 2 - 3 недели) 7. Болезнь характеризуется циклическим течением и многообразием клинических вариантов от абортивных лихорадочных форм до тяжелых форм с выраженными гемодинамическими нарушениями и геморрагическим синдромом, почечной, а в тяжелейших случаях полиорганной недостаточностью.
------------------------------
7 П. 1574 главы XIX СанПиН 3.3686-21.
------------------------------
В клиническом течении классического варианта ГЛПС выделяют пять периодов развития заболевания: инкубационный, лихорадочный (начальный, общетоксический), продолжающийся в среднем от 3 до 7 дней; олигурический (в среднем 6 - 12 дней), полиурический (в среднем 6 - 14 дней), период реконвалесценции (ранний - до 2 мес. и поздний - до 2 - 3 лет).
ГЛПС характеризуется развитием универсального капилляротоксикоза с преимущественным поражением микрососудов почек, легких, печени, головного мозга. Клинические проявления патологии этих органов, выявляемые с различной частотой, свидетельствуют о том, что для разных хантавирусов характерно идентичное развитие патологии органов, проявляющееся в разной пропорции. Вирусемия и развитие системного ДВС-синдрома обусловливают вовлечение в патологический процесс различных органов и тканей. Индивидуальные особенности иммунного ответа при ГЛПС связаны, с HLA-системой и lR-генами. Выявлена ассоциация полиморфных вариантов генов цитокинов с предрасположенностью к заболеванию и характером течения ГЛПС. Развитие патогенеза ГЛПС определяется сочетанием вирусной инициации заболевания с иммунным ответом макроорганизма.
В клинической картине заболевания выделяют 6 - 7 основных клинико-патогенетических синдромов:
1) общетоксический;
2) гемодинамический (центральные и микроциркуляторные нарушения);
3) почечный;
4) геморрагический;
5) абдоминальный;
6) нейроэндокринный;
7) респираторный синдром.
3.8. Перенесенная инфекция оставляет стойкий пожизненный типоспецифический иммунитет.
3.9. Уровень заболеваемости ГЛПС колеблется по годам и находится в прямо пропорциональной зависимости от эпизоотической активности очагов и числа контактов отдельных людей или коллективов с природными очагами.
3.10. Заболеваемость ГЛПС регистрируется на территории Российской Федерации в течение всего года. Максимальное количество заболевших регистрируется в сезоны наибольшей эпизоотической активности очагов разного типа. Сезонная динамика заболеваемости, связанная с хантавирусами Пуумала - летне-осенняя, Амур - весенне-летняя, Сеул - весенняя, а в очагах Куркино и Хантаан - осенне-зимняя. На территории лесной зоны Западной Сибири (Омская и Тюменская области) спорадические случаи заболевания ГЛПС, ассоциированные с хантавирусом. Куркино, регистрируются в весенне-летний период, Пуумала - в поздний осенний период, что связано с сезонными изменениями в поведении основных хозяев инфекции - полевой мыши и рыжей полёвки соответственно.
Вспышечная заболеваемость в летний период, вызванная вирусом Пуумала, возможна в объектах, примыкающих или стоящих на территории леса. С наступлением холодов вспышки, как правило, провоцируются интенсивным вселением хозяина этого вируса - рыжей полёвки - в строения (жилые дома, надворные постройки, сельскохозяйственные помещения, транспортные объекты). Зимние вспышки особенно характерны для очагов циркуляции вирусов Куркино и Хантаан. Хозяином этих вирусов является полевая мышь, которая активно мигрирует в населенные пункты, а также концентрируется в стогах и ометах в холодное время года.
3.11. Для территорий с высокой эпидемической активностью многолетняя динамика заболеваемости характеризуется периодичностью. Подъемы совпадают с ростом эпизоотической активности в популяциях носителей возбудителей ГЛПС и, как правило, повторяются в очагах циркуляции вирусов Пуумала и Амур каждые 2 - 4 года; в очагах циркуляции вирусов Куркино и Сочи, Хантаан и Сеул периодичность менее выражена.
3.12. Среди людей, заразившихся вирусами Пуумала и Сеул, преобладают городские жители, а вирусами Куркино, Амур и Хантаан - сельские жители.
3.13. Восприимчивость к ГЛПС всеобщая. Заболевают чаще мужчины (70 - 90 % больных) наиболее активного возраста (от 16 до 50 лет), преимущественно рабочие промышленных предприятий, водители, трактористы, работники сельского хозяйства. Заболеваемость регистрируется реже у детей (3 - 5 %), женщин и лиц пожилого возраста вследствие меньшего контакта с природной средой и, вероятно, иммуногенетическими особенностями.
3.14. Заражения людей в природных очагах, где циркулируют вирусы Пуумала и Амур, происходят в основном на садово-дачных участках, при кратковременном посещении леса с различными целями (туризм, охота, рыбная ловля, сбор грибов и ягод), а также среди лиц, работа которых связана с длительным пребыванием на территории природного очага (например, вырубка леса, геолого-разведывательные, строительные, дорожные работы, строительство нефте- и газопроводов). В очагах распространения хантавирусов Куркияо и Хантаан заражения чаще происходят в бытовых условиях среди сельских жителей, во время выполнения сельскохозяйственных работ, связанных с уходом за животными, при погрузке, транспортировке и раздаче сена, соломы; фуража. Заражение людей хантавирусом Сеул происходит в условиях города и связано с жизнедеятельностью серой крысы - резервуарного хозяина этого вируса.
IV. Эпидемиологический надзор за ГЛПС
4.1. Эпидемиологический надзор за ГЛПС включает сбор и анализ эпидемических данных, оценку эпидемической и эпизоотической ситуации, проведение районирования территории, прогнозирование обстановки (приложение 2 к настоящим МУ) и контроль эффективности проводимых мероприятий 8.
------------------------------
8 П. 1600 главы XIX СанПиН 3.3686-21.
------------------------------
4.2. Эпизоотологический мониторинг - один из основных компонентов эпидемиологического надзора за ГЛПС. Включает регулярное наблюдение за факторами абиотической и биотической среды, определяющими эпидемические риски 9, в объемах, предусмотренных методическими документами 10. При осуществлении эпизоотологического мониторинга решаются следующие задачи:
------------------------------
9 MP 3.1.0211-20.
10 МР 3.1.7.0250-21 "Тактика и объемы зоологических работ в природных очагах инфекционных болезней"; утвержденные руководителем Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека, Главным государственным санитарным врачом Российской Федерации 20.05.2021 (далее - МР 3.1.7.0250-21).
------------------------------
- оценка влияния погодных (метеорологических) и фенологических явлений на активность очагов;
- проведение эпизоотологического обследования стационарных участков кратностью не менее 4 раз в год (один раз в каждый сезон);
- анализ эпизоотологических данных, полученных при обследовании природных очагов ГЛПС: наблюдение за структурой населения, динамикой численности, генеративным состоянием и уровнем инфицированности мелких млекопитающих в различных стациях, включая основных резервуарных хозяев хантавирусов на эндемичных территориях;
- определение границ, дифференциация и инвентаризация природных очагов ГЛПС на отдельных участках территории;
- прогнозирование эпизоотической активности очагов, оценка риска заражения людей ГЛПС;
- обоснование объемов и сроков проведения эпизоотологического обследования (приложение 3 к настоящим МУ) и профилактических мероприятий.
4.3. Сбор и анализ эпидемиологических данных при обследовании очагов ГЛПС проводится в соответствии с пп. 4.3.1 - 4.3.8.
4.3.1. Сбор эпидемиологических данных проводится под руководством врача-эпидемиолога с участием зоологов, осуществляющих эпизоотологический мониторинг в очагах ГЛПС. Необходимо собирать, накапливать, систематизировать, обрабатывать и анализировать данные о численности населения, характере его деятельности и пребывании на энзоотичных территориях, сезонных перемещениях, местах заражений и числе случаев заболеваний. В качестве методов рекомендуются объезды территорий, анкетирование населения, изучение эпидемиологического анамнеза больных, историй болезней, официальных докладов и отчетов по вопросам эпидемиологии, экологии, биологической безопасности.
4.3.2. На энзоотичной по ГЛПС территории обеспечивается постоянное слежение за заболеваемостью людей ГЛПС, ее территориальным распространением (по административным территориям, ландшафтно-географическим зонам) и заболеваемостью отдельных групп населения (городское, сельское, по возрастным и профессиональным группам, сезонность заболеваний, условия заражения) с целью выявления основных факторов и категорий эпидемиологического риска (время, место, контингенты) инфицирования ГЛПС.
4.3.3. На основании данных о заболеваемости населения ГЛПС проводят анализ структуры, сезонных особенностей эпидемических проявлений, клинических признаков заболевания, основных механизмов инфицирования людей, определяют факторы, территории, время и контингенты с высоким риском заболеваний. По результатам наблюдений и анализа данных осуществляют оценку административных территорий по уровню эпидемической опасности, в результате которой составляют картосхему (картограмму) эпидемиологического районирования изучаемого региона по ГЛПС.
4.3.4. Проводится постоянный контроль за активным выявлением медицинскими организациями заболевших ГЛПС из числа больных с диагнозами, не исключающими данное заболевание, своевременной госпитализацией таких больных, обратившихся за медицинской помощью, лабораторным обследованием на ГЛПС.
4.3.5. Обеспечивается проведение серологического мониторинга и изучение иммунологической структуры населения к ГЛПС.
4.3.6. Осуществляется контроль за санитарной очисткой, своевременностью, качеством и полнотой дератизационных мероприятий в городах, сельских поселениях, садово-дачных кооперативах, на предприятиях, в оздоровительных учреждениях и на других объектах, расположенных на эндемичных по ГЛПС территориях.
4.3.7. Проводится учет контингентов, профессионально связанных с риском заражения ГЛПС при выполнении работ на территории природных очагов ГЛПС.
4.3.8. Оценивается качество, своевременность, полнота и эффективность, осуществляемых профилактических и противоэпидемических мероприятий (соблюдение санитарно-гигиенических условий работы и проживания, своевременное проведение дератизационных, дезинфекционных профилактических мероприятий).
4.4. Эпидемиологический мониторинг за ГЛПС основывается на результатах эпидемиологической, клинической, лабораторной диагностики и эпидемиологического районирования энзоотичной территории.
4.4.1. Эпидемиологическая диагностика ГЛПС включает в себя эпидемиологический анализ, который подразделяется на ретроспективный и оперативный и проводится в соответствии с санитарно-эпидемиологическими требованиями 11.
------------------------------
11 П. 1601, 1602 главы XIX СанПиН 3.3686-21.
------------------------------
4.4.2. Эпидемиологическое районирование энзоотичной по ГЛПС территории проводится по уровню риска заражения людей или величине показателя потенциальной эпидемической опасности территории с учетом результатов эпизоотологического мониторинга.
V. Оценка эпидемической ситуации в очагах ГЛПС
5.1. Оценку эпидемической обстановки в очагах ГЛПС проводят на основании результатов эпизоотолого-эпидемиологического анализа ситуации на конкретной территории и эпидемиологического районирования очагов ГЛПС по уровню потенциальной эпидемической опасности, необходимых для разработки адекватных санитарно-противоэпидемических (профилактических) мероприятий и принятия рациональных управленческих решений.
5.2. По местам и условию заражения людей возбудителем ГЛПС выделяют 5 эпидемиологических типов заражения:
- лесной. Заражение происходит при кратковременном пребывании на отдыхе в лесу (прогулки, туристические походы, сбор ягод и грибов, рыбная ловля, охота и т.п.) преимущественно в летнее или осеннее время. Заболевания, как правило, носят спорадический характер. Возможны групповые заражения при ночевках в палатках, лесных сторожках, шалашах;
- производственный. Инфицирование людей возможно на промышленных предприятиях, заселенных грызунами, как правило, расположенных вблизи леса. Возможны заражения при заготовке древесины, проведении различных работ на территории природных очагов ГЛПС (например, строительство, расчистка леса, прокладка дорог, нефте- и газодобыча);
- сельскохозяйственный. Заражения связаны с сельскохозяйственными работами (стогометание, перевозка сена, соломы, обработка полей и насаждений, сбор урожая, выпас скота, работа на пасеках). В зимний период заражения происходят при разборке и перевозке стогов сена и соломы, кормлении животных. Заболевания регистрируются также среди пастухов, пчеловодов, работников животноводческих ферм, складов и зернохранилищ и у лиц, занятых разборкой картофельных и свекольных буртов;
- садово-дачный. Заражения происходят при работах в садах, огородах и на дачах, расположенных около леса. В зимний период лесные грызуны, и в том числе рыжая полёвка, интенсивно заселяют дачные постройки. Заражение людей начинается весной при уборке помещений и работах на садовых участках. Массовое освоение территорий с природными очагами под садово-дачные участки вблизи, населенных пунктов привело к возникновению весенне-летних вспышек ГЛПС. Спорадические заболевания возможны там и в осенне-зимний период;
- бытовой. Заражение происходит по месту жительства в домах в большинстве случаев расположенных рядом с лесом или вблизи лесопарковых массивов населенных пунктов. Бытовой тип характеризуется осенне-зимней сезонностью. Это обусловлено осенней миграцией основных хозяев патогенных хантавирусов в постройки человека. Заражения возможны и в другое время года. Могут возникать семейные, групповые заболевания.
5.3. По ландшафтно-географическим особенностям, составу элементов и функциональным связям различают зональные типы очагов: лесные, лесостепные, пригородно-поселковые, городские. Выделяют смешанные пригородно-лесные и садово-лесные, а также антропоургические очаги (бытовые, производственные и лесопарковые). Очаги одного типа обладают однородной структурой и условиями существования паразитарных систем. Они связаны с определенными биоценозами, имеют сходную динамику численности эпидемически опасных видов грызунов и т.д. Интразональные варианты очагов позволяют рассматривать тип очага в связи с хозяйственными факторами ландшафта и определяют его эпидемиологическое своеобразие.
5.4. Эпидемическая опасность очагов ГЛПС определяется в первую очередь интенсивностью и характером контактов населения с ними. Риск заражения населения повышается по следующим причинам:
- отсутствие, неточная или запоздалая информация о подъеме ("вспышке") численности основных носителей хантавирусов;
- увеличение интенсивности контактов населения с природными очагами ГЛПС;
- изменение характера (бытового, сельскохозяйственного и промышленного). эксплуатации очаговой территории;
- расширение энзоотичной территории природных очагов;
- сезонное и (или) связанное с динамикой увеличения численности повышение интенсивности инфицирования хозяев патогенных хантавирусов, повышение плотности населения мелких млекопитающих - носителей патогенных хантавирусов на территории природных очагов, миграция грызунов, включая инфицированных особей, в строения в холодный период года;
- недостаточный объем неспецифических профилактических мероприятий и мероприятий по очистке лесов от сухостоя и валежника, образование свалок бытовых отходов в лесных и лесопарковых массивах городов или вблизи населенных пунктов;
- проведение родентицидных обработок в строениях без дератизации на придворовых территориях и в зеленых зонах населенных пунктов;
- отсутствие, недостаточный объем, несвоевременное или неадресное проведение родентицидных обработок в очагах ГЛПС.
VI. Выявление и наблюдение за больными в очагах ГЛПС
6.1. Выявление больных ГЛПС.
Диагностика ГЛПС проводится путем сбора анамнеза болезни, эпидемиологического анамнеза, клинического осмотра, лабораторных и специальных методов обследования и направлена на определение нозологической формы, тяжести состояния, выявление осложнений и показаний к лечению. При выявлении больного с подозрением на ГЛПС медицинская организация обязана представить экстренное извещение в территориальный орган исполнительной власти, уполномоченный осуществлять федеральный государственный санитарно-эпидемиологический надзор 12. Окончательный диагноз должен включать клиническую форму заболевания, тяжесть течения, осложнение и результаты лабораторных исследований. Каждый случай заболевания ГЛПС подлежит санитарно-эпидемиологическому расследованию. По результатам расследования заполняется карта эпидемиологического обследования очага инфекционного заболевания.
------------------------------
12 П. 1578 главы XIX СанПиН 3.3686-21.
------------------------------
6.2. Госпитализация больных проводится по клиническим показаниям 13.
------------------------------
13 П. 1578 главы XIX СанПиН 3.3686-21.
------------------------------
6.3. Диспансеризация реконвалесцентов ГЛПС осуществляется в поликлинике по месту жительства. При наличии жалоб на состояние здоровья первое диспансерное обследование проводится незамедлительно. При удовлетворительном самочувствии переболевших оно проводится в сроки от 1 до 3 месяцев после болезни. В последующем контрольные осмотры проводятся 1 раз в квартал в течение первого года и 2 раза в течение второго года после выписки. При отсутствии жалоб и изменений со стороны внутренних органов по истечении этого срока перенесшие ГЛПС снимаются с учета.
6.4. Мероприятия в отношении восприимчивых лиц в эпидемическом очаге осуществляются в соответствии с санитарно-эпидемиологическими требованиями 14.
------------------------------
14 П. 1577 главы XIX СанПиН 3.3686-21.
------------------------------
VII. Неспецифическая профилактика ГЛПС
7.1. Планирование и организация неспецифической профилактики осуществляется в соответствии с санитарно-эпидемиологическими требованиями 15 и методическими документами 16.
------------------------------
15 П. 1603 - 1614 главы XIX СанПиН 3.3686-21.
16 МУ 3.5.3.2949-11 "Борьба с грызунами в населенных пунктах, на железнодорожном, водном, воздушном транспорте", утвержденные руководителем Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека, Главным государственным санитарным врачом Российской Федерации 27.07.2011 (далее - МУ 3.5.3.2949-11); МР 3.5.3.0299-22 "Дератизационные мероприятия в зимний период в очагах геморрагической лихорадки с почечным синдромом (ГЛПС), утвержденные руководителем Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека, Главным государственным санитарным врачом Российской Федерации 20.09.2022 (далее - МР 3.5.3.0299-22).
------------------------------
В связи с отсутствием эффективных мер специфической профилактики ГЛПС на территории Российской Федерации, в целях предотвращения или снижения заболеваемости населения важное, а в ряде случаев первостепенное место отводится мероприятиям неспецифической профилактики. Их планирование и проведение осуществляют с учетом оперативной информации об эпизоотической и эпидемической ситуации, а также на основании прогнозирования тенденций их развития. Удовлетворительный профилактический эффект можно получить при осуществлении:
- регулярного эпизоотологического мониторинга с учетом, многолетних особенностей территорий, включая сезонные эпизоотолого-эпидемические осложнения в очагах различных типов;
- сбора и анализа эпидемиологических данных;
- санитарно-гигиенических и санитарно-технических мероприятий;
- своевременной подготовки медицинских работников по вопросам, диагностики, лечения и профилактики заболеваний населения в очагах ГЛПС;
- информационно разъяснительной работы с населением;
- качественных и проводимых в необходимом объеме дезинфекции и дератизации.
Оздоровление природных и антропоургических очагов ГЛПС осуществляется с учетом результатов анализа эпизоотической ситуации и проведением дератизационных и дезинфекционных мероприятий. Проведение систематических неспецифических профилактических, а также экстренных мероприятий в очагах ГЛПС включают в федеральные, региональные и областные целевые программы охраны здоровья и обеспечения санитарно-эпидемиологической безопасности населения. Дератизация и дезинфекция по эпидемиологическим показаниям осуществляются в соответствии с санитарно-эпидемиологическими требованиями 17 и методическими документами 18.
------------------------------
17 П. 586 главы V СанПиН 3.3686-21.
18 МУ 3.5.3.2949-11; МР 3.5.3.0299-22.
------------------------------
7.2. Санитарно-гигиенические и санитарно-технические мероприятия.
На основе анализа оперативных данных разрабатывают содержание санитарно-гигиенических мероприятий, осуществляют надзор за их проведением. на территории очагов ГЛПС. Эти мероприятия включают:
- санитарную уборку и очистку населенных пунктов и их окрестностей;
- регулярную влажную уборку жилых и производственных помещений;
- своевременный вывоз и утилизацию мусора;
- ликвидацию несанкционированных свалок бытовых отходов;
- обеспечение населения чистой питьевой водой;
- очистку водоемов в населенных пунктах и их окрестностях;
- соблюдение правил коммунальной и производственной гигиены.
Санитарно-технические мероприятия предусматривают проведение инженерно-строительных и ремонтных работ, устраняющих или снижающих риски заболеваний населения. Основными из них являются:
- снос ветхих строений и сооружений на территории населенных пунктов;
- ликвидацию зарослей бурьянистой, прибрежно-водной, кустарниковой растительности в населенных пунктах, их окрестностях и зонах рекреации;
- использование технологий и строительных материалов, не допускающих массового заселения и размножения грызунов;
- оборудование устройств и приспособлений, предотвращающих заселение, передвижение и размножение грызунов в населенных пунктах и их окрестностях;
- оборудование и ремонт мусоросборников и площадок для сбора мусора, территорий свалок коммунальных, пищевых и промышленных отходов;
- своевременный ремонт помещений, зданий и сооружений с целью обеспечения их грызунонепроницаемости;
- защита сельскохозяйственных угодий от зарастания древесной, кустарниковой и бурьянистой растительностью;
- санитарная рубка, очистка лесов и лесонасаждений в населенных пунктах и их окрестностях (приведение зеленых зон в лесопарковое состояние).
7.3. Родентицидные и дезинфекционные обработки.
Риски заражения людей наиболее высоки в сельских и городских населенных пунктах, примыкающих к зеленым зонам, поймам рек и берегам водоемов, на участках временного проживания контингентов военнослужащих, сельскохозяйственных рабочих, дорожников, строителей, поисковиков и др. в полевых условиях, а также в местах массового отдыха (зоны рекреации) населения. Выявление высокой численности и зараженности основных хозяев патогенных хантавирусов на территориях активных очагов ГЛПС, потенциально опасных в отношении заражения человека, служит показанием для проведения истребительных мероприятий в очаге или на объекте. На основании полученных результатов обследования с учетом конкретной эпизоотической и эпидемической обстановки, эпизоотологических и эпидемиологических прогнозов определяют содержание мероприятий, места их проведения, сроки, объемы, методы, способы и средства дератизации и дезинфекции.
Кратность (весна, лето, осень) и типы проведения мероприятий (профилактическая, экстренная, систематическая, выборочная, барьерная, поселковая и полевая дератизация, очаговая дезинфекция) определяют органы исполнительной власти, уполномоченные для осуществления федерального государственного санитарно-эпидемиологического контроля (надзора) 19, с учетом результатов оперативного и ретроспективного эпизоотолого-эпидемиологического мониторинга и краткосрочного прогноза изменения активности очагов ГЛПС.
------------------------------
19 П. 1605 главы ХIХ СанПиН 3.3686-21; постановление Правительства Российской Федерации от 30.06.2021 N 1100 "О федеральном государственном санитарно-эпидемиологическом контроле (надзоре)".
------------------------------
Для оздоровления очагов ГЛПС используются родентицидные и дезинфекционные средства, прошедшие государственную регистрацию и разрешенные для применения на территории Российской Федерации с соблюдением техники безопасности в соответствии с методическими документами 20 и инструкциями по применению.
------------------------------
20 МУ 3.5.3.2949-11.
------------------------------
Дезинфекция в очагах ГЛПС проводится в соответствии с приложением 4 к настоящим МУ.
7.4. Методы и средства контроля численности грызунов в очагах ГЛПС.
В структуре заблаговременных профилактических мероприятий в очагах ГЛПС большое место отводится проведению санитарно-гигиенических, санитарно-технических, агро- и лесотехнических мероприятий, направленных на ликвидацию среды обитания грызунов. Благоустройство и очистка территорий и объектов, своевременный вывоз отходов, уничтожение сорняков и рудеральных растений, ликвидация ветхих строений и сооружений, санитарная рубка в зеленых зонах населенных пунктов, глубокая вспашка земли и другие мероприятия лишают зверьков благоприятных мест для укрытия, питания и размножения. Благоустройство и очистка лесных массивов, примыкающих к населенным пунктам, садово-дачным кооперативам, проводится в радиусе до 200 метров, оздоровительным организациям - в радиусе до 500 метров.
Большое значение имеет обеспечение грызунонепроницаемости объектов. Строительно-технические меры (например, заделка отверстий вводов коммуникаций, высокий фундамент, бетонированные полы) позволяют ограничить проникновение зверьков в здания, препятствуют их расселению и доступу к пище.
В раде случаев для профилактики ГЛПС возможно использование физического метода - отлова зверьков с помощью орудий Лова. Такие работы проводят на изолированных или специальных объектах, на объектах, где запрещено использование химических средств. К физическим дератизационным средствам относят механические устройства, убивающие грызунов, или средства однократного отлова (например, клеевые ловушки) и многократного действия, ограничивающие передвижение грызунов (давилок "Геро", живоловки), а также отпугивающие устройства (ультразвуковые и электрические).
Вылов грызунов капканами и давилками в течение 5 - 7 дней, как правило, обеспечивает полное освобождение от них. При наличии объектов и территорий, заселенных грызунами на необработанных участках, освобожденные от грызунов места (ниши) быстро занимаются пришлыми зверьками. В этой связи целесообразно практиковать отлов на постоянных линиях (точках) орудий лова в течение длительного периода времени. Ловушки в этом случае помещают в контейнеры с крышкой, периодически проверяют и перезаряжают.
При возникновении эпидемических осложнений по ГЛПС используют химические методы борьбы с грызунами, направленные на полное уничтожение грызунов в населенных пунктах, или снижение численности основного носителя в природных биотопах до порогового уровня.
К химическим дератизационным средствам относятся родентициды в различных формах применения 21.
------------------------------
21 Руководство Р 4.2.3676-20 "Моголы лабораторных исследований и испытаний дезинфекционных средств для оценки их эффективности и безопасности", утвержденное руководителем федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека, Главным государственным санитарным врачом Российской Федерации 18.12.2020.
------------------------------
При выборе приемов и средств дератизации необходимо учитывать:
- свойства родентицидных средств (действующее вещество, его концентрацию, механизм действия препарата (острое или кумулятивное), форму и способ применения, токсичность для людей и животных, влияние на обрабатываемые объекты, окружающую среду);
- особенности экологии грызунов (вид, местообитание, активность, поведенческие реакции, время года, пищевая специализация, устойчивость к родентицидам);
- особенности очагов (тип, структура, функциональные связи, расположение);
- особенности санитарно-эпидемической обстановки (тип очага, численность населения, характер пребывания людей в очаге ГЛПС, число больных и др.).
Кратность, дислокация и объемы обработок определяются оперативной обстановкой - эпизоотической активностью и уровнем заболеваемости.
Систематическая дератизация предусматривает осуществление комплекса дератизационных мероприятий на территории очага и объектах населенного пункта, расположенных в зеленой зоне с периодичностью, необходимой для обеспечения эпидемиологического благополучия населения.
Выборочная дератизация предусматривает проведение дератизационных мероприятий на территории очага в местах концентрации грызунов - носителей патогенных хантавирусов на отдельных объектах и территориях, определенных по результатам оперативного обследования или имеющих эпидемиологическое значение.
Рекомендуется проведение поселковой дератизации в домах, расположенных в непосредственной близости от зеленых зон (лесополосы, рощи, скверы, парки), с предварительной или одновременной родентицидной обработкой поселений полевок и мышей в природных биотопах окрестностей населенного пункта.
Эффективность дератизации оценивают, сравнивая результаты обследования объектов или территории на присутствие хозяев патогенных хантавирусов до и после дератизации. Динамика изменения относительной численности этих видов грызунов в сторону уменьшения отражает эффективность обработок. Удовлетворительным результатом считают гибель 80 % и более зверьков, обитающих на обработанной территории. Снижение численности мелких млекопитающих, в первую очередь рыжей полёвки, до уровня единичных показателей попадания в давилки (в разные сезоны в разных очагах показатель может различаться) приводит к ликвидации эпизоотий и эпидемических проявлений в активных очагах.
В ряде случаев отсутствуют данные об исходной (предотработочной) численности грызунов. Для оценки технической эффективности дератизации проводят учеты численности на обработанном (опытном, дератизированном) участке и на соседнем необработанном (контрольном). Ее величину оценивают при сравнении процента попадания грызунов на опытном и контрольном участках.
7.5. Дезинфекционные обработки в очагах ГЛПС.
В задачи профилактической дезинфекции входит предупреждение заболеваний людей и недопущение распространения ГЛПС. Профилактическая дезинфекция включает обеззараживание питьевых источников и сточных вод, мест общего пользования, мусора и бытовых отходов, животного и растительного сырья, помещений, предметов, транспорта и одежды. Профилактическая дезинфекция осуществляется в местах массового скопления населения, в образовательных организациях, на предприятиях производства продуктов питания, в Торговых объектах и рынках, реализующих пищевую продукцию, в медицинских организациях, в помещениях складов, в местах общего пользования.
Очаговая дезинфекция состоит из текущей и заключительной, проводится с противоэпидемическими целями. Цель заключительной дезинфекции - полное освобождение инфекционного очага от возбудителя заболевания. Результаты дезинфекции считаются удовлетворительными при дезактивации или уничтожении возбудителей инфекций и ликвидации эпидемического очага ГЛПС.
При работе в очагах ГЛПС важное значение имеет выбор наиболее эффективных способов и средств дезинфекции. При этом руководствуются следующими критериями:
- площадь территории или объектов;
- количество больных;
- сезонные особенности заболевания;
- механизмы передачи и пути заражения;
- свойства обрабатываемых предметов и поверхностей;
- стабильность работах растворов при хранении и удобство при применении;
- степень токсического воздействия на людей;
- степень агрессивности по отношению к дезинфицируемым предметам и материалам;
- экономичность использования (стоимость, доступность, универсальность, сочетанное действие).
В ряде случаев в эпидемических очагах показано применение камерной дезинфекции для обеззараживания одежды, постельных и спальных принадлежностей.
Методы и средства дезинфекции в очагах ГЛПС приводятся в приложении 4 к настоящим МУ.
VIII. Профилактика заражений населения при посещении территорий, опасных в отношении инфицирования хантавирусами
8.1. Риск заражения людей патогенными хантавирусами - возбудителями ГЛПС находится в прямой зависимости от времени пребывания на территории природного очага. Среди профессиональных групп, которые посещают опасные (или потенциально опасные) по ГЛПС территории, можно выделить работников, находящихся достаточно длительное время в природных территориях (например, лесники, сельхозработники, военные в полевых лагерях, дети в лагерях отдыха, железнодорожники), и люди, контактирующие с очагами периодически (например, охотники, грибники, туристы, дачники, строители). При регистрации роста показателей заболеваемости ГЛПС рекомендуется введение ограничительных мер на Посещение лесных массивов с выявленными очагами ГЛПС с учетом результатов эпизоотологического мониторинга, включая показатели относительной численности и инфицированности хантавирусами мелких млекопитающих.
При выборе участка для размещения временного жилья для работников нефтегазодобывающей промышленности, геологов, дорожных строителей и других профессиональных контингентов, проводящих работы на территории природных очагов ГЛПС, следует руководствоваться рекомендациями территориальных органов исполнительной власти, уполномоченных осуществлять федеральный государственный санитарно-эпидемиологический надзор 22 на данной территории.
------------------------------
22 П. 1605 главы XIX СанПиН 3.3686-21.
------------------------------
Одна из основных рекомендаций по профилактике заболевания ГЛПС для населения, посещающего лес - максимально сократить срок пребывания в пределах потенциально опасных биотопов, а по возможности полностью исключить их посещение, особенно в сухую погоду. К признакам, отличающим подобные участки относятся: наличие в лесу густого подлеска, обилие сухостоя, валежника и сухой листвы, соседство свалок различного характера, общая захламленность территории.
Исходя из основных способов заражения возбудителями ГЛПС категорически противопоказано проводить сухую уборку без дезинфекционных" растворов и марлевых повязок (например, дачи, складские помещения), употреблять в пищу немытые фрукты и овощи. При сборе грибов исключать повреждённые экземпляры, не ворошить листву. Следует избегать сбора ягод и других дикоросов в местах высокого риска заражения ГЛПС. При отдыхе на природе рекомендуется располагаться на проветриваемых, подверженных инсоляции местах, использовать походную мебель (стол, стулья). Максимально ограничить контакт (особенно детей) с объектами окружающей среды. Организованный отдых рекомендуется проводить в специально отведенных местах, где, в частности, осуществляется плановая (в том числе комплексная) обработка от носителей и возбудителей ГЛПС.
IX. Лабораторная диагностика и индикация возбудителей ГЛПС
9.1. Лабораторные исследования материала от мелких млекопитающих - носителей хантавирусов.
9.1.1. Уровень инфицированности мелких млекопитающих свидетельствует о степени напряженности эпизоотического процесса - основного фактора, используемого для прогнозирования эпидемической ситуации и обусловливающего показания к проведению соответствующих противоэпидемических мероприятий в природных очагах ГЛПС. С этой целью исследуют материал от каждой особи отдельно. Объединение материала в пулы от нескольких особей нецелесообразно.
9.1.2. При мониторинговых исследованиях для оценки уровня иммунных особей в популяции мелких млекопитающих проводят выявление специфических антител к возбудителям ГЛПС в сыворотках крови диких и лабораторных животных.
9.1.3. При вскрытии животных под контролем опытного зоолога проводится определение возрастного и полового состава добытых особей, их репродуктивной активности, уточнение видовой принадлежности. Для проведения лабораторных исследований на хантавирусы от каждого зверька в стерильные одноразовые пробирки (по типу "Эппендорф") отдельно отбирают легкое, сердце, полоску фильтровальной бумаги, пропитанную кровью из грудной полости или сердца. Пробирки нумеруются согласно протоколу вскрытия. Хранение пробирок с целью использования проб для выделения возбудителя возможно в сосуде Дьюара (в жидком азоте), с целью исследования проб иммунологическими и молекулярно-биологическими методами - в морозилке (минус 20 °C) или в сумке - холодильнике с сухим льдом.
9.1.4. С целью предотвращения контаминации при вскрытии соблюдают правила асептики и антисептики (перед вскрытием протирают 96 %-м спиртом место разреза, надлежащим образом стерилизуют инструмент) 23.
------------------------------
23 МУК 4.2.2494-09 "Организация молекулярно-генетических исследований биологического материала из природных очагов геморрагической лихорадки с почечным синдромом", утвержденные Руководителем Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека, Главным государственным санитарным врачом Российской Федерации 01.04.2009.
------------------------------
9.1.5. Лабораторные исследования зоологического материала проводятся в соответствии с действующими нормативными документами.
Для выявления инфицированных животных используют ИФА (выявление антигенов хантавирусов), ОТ-ПЦР, РТ-ПЦР (детекция вирусной РНК в образцах ткани органов), выделение хантавирусов на чувствительной биологической модели.
9.2. Организация лабораторной диагностики и индикации возбудителей ГЛПС.
9.2.1. Лабораторная диагностика ГЛПС и индикация возбудителей ГЛПС выполняется в следующих случаях:
- проведение диагностических исследований биологического материала от людей с подозрением на заболевание ГЛПС, а также умерших лиц при подозрении на ГЛПС либо умерших от лихорадки неясного генеза на эндемичных по ГЛПС территориях;
- изучение иммунной прослойки выборочных групп населения, проживающего на изучаемой территории;
- исследование зоологического материала.
9.2.2. Отбор, упаковку, транспортировку биологического материала и лабораторные исследования на ГЛПС осуществляют в соответствии с санитарно-эпидемиологические требованиями 24, используют методы амплификации нуклеиновых кислот при работе с материалом, содержащим микроорганизмы I - IV групп патогенности. Способы взятия, условия хранения и транспортирования материала для лабораторной диагностики ГЛПС представлены в приложении 5 к настоящим МУ.
------------------------------
24 Глава IV СанПиН 3.3686-21.
------------------------------
9.2.3. Для лабораторной диагностики ГЛПС и индикации возбудителей ГЛПС используют иммунологические, молекулярно-биологические и вирусологические методы исследований 25.
------------------------------
25 П. 32 главы II СанПиН 3.3686-21.
------------------------------
Основными методами диагностики ГЛПС являются иммуноферментный анализ (далее - ИФА) и метод флуоресцирующих антител (далее - МФА). Реакция нейтрализации (РИ) применяется реже, лишь в условиях специализированной вирусологической лаборатории, ее применение ограничивается исследовательскими целями.
Для выявления РНК возбудителей ГЛПС в исследуемом материале используют ОТ-ПЦР, а также РТ-ПЦР. Для изучения нуклеотидных последовательностей проводят секвенирование.
Целью вирусологического исследования является изоляция и последующая идентификация возбудителей ГЛПС. Для выделения хантавирусов рекомендуется использовать перевиваемую линию клеток почек зеленой мартышки Vero E6.
9.2.4. Иммунологические (серологические) исследования по обнаружению в сыворотках крови (а также моче) людей антител к хантавирусам, тестирование клинического материала молекулярно-биологическими методами (без накопления возбудителя) проводятся в лабораториях, имеющих санитарно-эпидемиологическое заключение о возможности проведения работ с микроорганизмами III группы патогенности. Указанные виды исследований проводятся в боксированных помещениях, оборудованных системами приточной и вытяжной вентиляции," или боксах микробиологической безопасности II класса. Вирусологические исследования (с накоплением возбудителя) проводят в специализированных лабораториях, имеющих разрешение на работу с вирусами II группы патогенности, в том числе возбудителями ГЛПС 26.
------------------------------
26 Глава II СанПиН 3.3686-21.
------------------------------
9.2.5. Мониторинг, лабораторная диагностика и индикация возбудителей ГЛПС проводятся в рамках единой системы на территориальном, региональном и федеральном уровнях в соответствии с санитарно-эпидемиологические требованиями 27.
------------------------------
27 Глава XIX СанПиН 3.3686-21; приказ Роспотребнадзора от 01.12.2017 N 1116 "О совершенствовании системы мониторинга, лабораторной диагностики инфекционных и паразитарных болезней и индикации ПБА в Российской Федерации".
------------------------------
Для подтверждающих исследований, определения видовой принадлежности хантавируса и молекулярно-биологической характеристики возбудителя направляются:
- материал от больных, выявленных на территориях Российской Федерации, где ранее заболеваемость ГЛПС не регистрировалась;
- материал от больных ГЛПС в случаях вспышек заболевания (выборочно);
- секционный материал от умерших от ГЛПС;
- зоологический материал при первичном выявлении маркеров возбудителей ГЛПС на территории;
- зоологический материал, собранный в период вспышек заболевания (при необходимости);
- зоологический материал при неоднократном выявлении маркеров возбудителей ГЛПС в образцах от неосновных носителей хантавирусов.
9.3. Лабораторное исследование материала от людей.
9.3.1. Проводится для подтверждения (или исключения) клинического диагноза у больных, а также умерших лиц при подозрении на ГЛПС либо умерших от лихорадки неясного генеза на эндемичных по ГЛПС территориях. Совокупность клинических симптомов, данных эпидемиологического анамнеза и результатов лабораторного исследования позволяет поставить окончательный диагноз ГЛПС.
9.3.2. Материалом для исследования являются: кровь, сыворотка крови, плазма крови, моча, суспензии органов, взятых при аутопсии (почки, печень, легкие, селезенка).
9.3.3. Забор материала производят в стерильные одноразовые флаконы, пробирки, контейнеры стерильными инструментами (см. п. 9.2.2).
9.3.4. Отбор материала и его упаковку производят медицинские работники медицинских организаций (например, стационара, в который госпитализирован больной), а при патологоанатомическом исследовании трупов умерших - патологоанатомических отделений (бюро судебно-медицинской экспертизы).
9.3.5. Для выявления антител к возбудителям ГЛПС в сыворотке крови больных используют МФА, ИФА. С помощью этих методов могут быть выявлены либо суммарные специфические антитела, либо антитела классов М и G.
Подтверждение клинического диагноза ГЛПС проводят путем определения антител классов М и G к возбудителям этого заболевания с помощью ИФА. Определение IgM к хантавирусам позволяет проводить лабораторную диагностику ГЛПС начиная с 2 - 5-х суток после начала заболевания. Максимальная концентрация специфических IgM отмечается на 6 - 11-й день после появления первых симптомов болезни. Позднее тигры IgM начинают снижаться. К концу третьего месяца от начала заболевания IgM обычно не обнаруживаются. В редких случаях возможно выявление специфических IgM в течение 1 - 3 лет после перенесения ГЛПС.
При типичном течении ГЛПС IgG к хантавирусам достигают уровня, регистрируемого с помощью диагностических препаратов наиболее часто к 3 - 4-у дню заболевания. Значительное повышение тигров IgG отмечается на 2 - 3-й неделе заболевания и достигает максимума к 4-й неделе. Низкоавидные антитела класса G присутствуют до 1 - 2 месяцев после начала заболевания. Антитела класса G, выявляемые позднее, характеризуются как высокоавидные. Специфические IgG при ГЛПС могут быть обнаружены в течение многих лет после перенесения заболевания, возможно, пожизненно. Выявление антител этого класса указывает на контакт с хантавирусами (на текущую или перенесенную ранее инфекцию).
Сыворотки крови, взятые от больных в остром периоде заболевания, не могут быть использованы для определения видовой принадлежности хантавирусов, так как нейтрализующие антитела в этот период часто дают перекрестные реакции.
При анализе парных сывороток для получения результатов, адекватно отражающих изменение концентраций антител к хантавирусам в крови, необходимо использовать наборы реагентов одного предприятия - изготовителя.
Выявление IgM свидетельствует о наличии острой инфекции. Отсутствие IgM к хантавирусам в первой сыворотке не означает, что пациент не инфицирован возбудителем. Если кровь взята у больного в начале острого периода заболевания, IgM в сыворотке крови могут отсутствовать или присутствовать в концентрации, недостаточной для выявления используемыми диагностическими тест-системами. Отсутствие иммуноглобулинов класса G к хантавирусам в первой сыворотке не означает, что пациент не инфицирован хантавирусами, они могут отсутствовать в начал с острого периода заболевания. Диагностически значимым результатом является 4-кратное и более увеличение титра антител класса G в образцах парных сывороток. На ранних сроках болезни чувствительность метода ИФА может быть несколько ниже метода МФА.
При выявлении с помощью МФА суммарно IgM и IgG антител к хантавирусам в сыворотках крови людей диагностически значимым является регистрация 4-кратного и более нарастания их титра в парных сыворотках. Суммарные антитела к хантавирусам выявляют МФА в сыворотках крови больных ГЛПС начиная со 2 - 3-го дня болезни. С 1 по 4 день болезни антитела к вирусу Пуумала обнаруживаются в 92 % случаев, с 5 по 7 день - в 95,7 % случаев, с 8 дня - в 100 %.
Одновременное обнаружение хантавирусных антител МФА в крови и моче лихорадящих больных является достоверным диагностическим критерием острого периода хантавирусной инфекции и позволяет установить специфический диагноз на 3-й, 4-й, 5-й, 6-й день от начала заболевания в 85,7 %, 89,4 %, 93,1 % и 100 % случаев соответственно, не прибегая к исследованию антител в парных сыворотках крови.
Для повышения эффективности серодиагностики ГЛПС необходим, наиболее ранний забор первой сыворотки (желательно до 4 - 5-го дней болезни) при поступлении больного в стационар при обращении в поликлинику, повторный забор крови производят через 2 - 3 дня. При взятии первой сыворотки позже 8-го дня болезни нарастание титра антител может не выявляться.
При отсутствии антител в первом образце, но сохранении подозрения на ГЛПС рекомендуется провести забор второго образца крови у пациента через 2 - 3 дня после первого. Отсутствие выявления специфических антител спустя 8 - 9 дней после начала заболевания свидетельствует против хантавирусной этиологии болезни.
При обследовании больных с явными клиническими проявлениями ГЛПС и характерным эпидемиологический анамнезом в 1 - 2 % случаев антитела к возбудителям. ГЛПС не выявляются, что может свидетельствовать о наличии серонегативных форм заболевания, которые являются следствием тех или иных нарушений гуморального звена иммунитета у отдельных людей.
Определение антигенов хантавирусов в тканях человека (материалах аутопсии), а также в органах мелких млекопитающих проводят методом ИФА с использованием зарегистрированных в установленном порядке наборов реагентов.
9.3.6. Молекулярно-биологические методы (ОТ-ПЦР, РТ-ПЦР) применяются для выявления РНК возбудителей ГЛПС в крови (плазме, сыворотке крови), моче, суспензиях органов, взятых при аутопсии (почки, печень, легкие, селезенка). Для проведения ПЦР забор крови проводят в ранний период болезни (в период вирусемии) не позднее 5 дня от начала заболевания. Забор секционного материала необходимо произвести как можно быстрее после смерти больного. При наличии соответствующего оснащения проводят изучение нуклеотидных последовательностей к ДНК вируса методом секвенирования.
9.3.7. Вирусы - возбудители ГЛПС могут быть изолированы из крови, плазмы, сгустка крови, суспензий органов, взятых при аутопсии (почки, печень, легкие, селезенка). Кровь для вирусологического исследования забирают в ранний период болезни (до 5 дня от начала заболевания), то есть в период вирусемии. Забор секционного материала необходимо произвести как можно быстрее после смерти больного. Выделение и идентификация хантавирусов длительный, трудоемкий метод, требующий наличия условий специализированной лаборатории, в основном используется в научных целях для изучения циркулирующих на территории хантавирусов.
9.3.8. Оценка результатов лабораторных исследований клинического материала.
Клинический диагноз ГЛПС считают подтвержденным в следующих случаях:
- обнаружение с помощью МФА суммарных антител (IgM и IgG) к возбудителям ГЛПС одновременно в сыворотке крови и в моче;
- выявление 4-кратного и более увеличения титра антител в парных сыворотках крови, взятых с интервалом 2 - 3 дня (обе пробы сывороток крови исследуют одновременно в одном опыте);
- выявление IgM к возбудителям ГЛПС в сыворотке крови в острый период заболевания в совокупности с выявлением IgM и/или IgG в парной сыворотке;
- выявление 4-кратного и более увеличения титра IgG к возбудителям ГЛПС в парных сыворотках;
- обнаружение в исследуемых образцах специфического фрагмента РНК хантавирусов - возбудителей ГЛПС;
- выделение хантавирусов - возбудителей ГЛПС.
9.4. Изучение иммунной прослойки выборочных групп населения, проживающего на изучаемой территории, к возбудителям ГЛПС.
9.4.1. Уровень иммунной прослойки населения является дополнительным критерием интенсивности циркуляции возбудителя на изучаемой территории.
9.4.2. Сероэпидемиологические исследования осуществляют путем выявления антител класса G к хантавирусам - возбудителям ГЛПС (наиболее широко для этих целей используют ИФА) или суммарных специфических антител (с помощью МФА).
9.4.3. Объектом для изучения иммунной прослойки населения к возбудителям ГЛПС являются сыворотки крови здоровых лиц из выборочных групп (возрастных и социальных, не менее 100 человек в каждой из групп) населения, проживающего на изучаемой территории не менее 10 лет. Наличие специфических антител к возбудителям ГЛПС свидетельствует об имевшем место контакте с хантавирусами.
X. Подготовка специалистов и информационно-разъяснительная работа с населением
10.1. Подготовка специалистов по вопросам диагностики и профилактики заболеваний населения.
В энзоотичных по ГЛПС регионах рекомендуется проводить регулярную подготовку медицинских работников по вопросам эпидемиологии и профилактики заболеваний, обеспечивать консультативно-методическую поддержку.
К работе по вопросам эпидемиологии и профилактики ГЛПС рекомендуется привлекать зоологов.
10.2. Информационно-разъяснительная работа с населением.
На территории региона, энзоотичного по ГЛПС рекомендуется проводить регулярную информационно-разъяснительную (санитарно-просветительную) работу с населением по вопросам активности очагов, о путях заражения хантавирусами, мерах профилактики. Основными формами работы с людьми являются беседы с населением, выступления по радио и телевидению, на сборах в образовательных организациях, собраниях в производственных коллективах, распространение информационных листовок и буклетов, установка предупреждающих или запрещающих аншлагов.
Приложение 1
к МУ 3.1.3844-23
Списки млекопитающих
Российской Федерации, которые могут быть резервуарными хозяевами и источниками возбудителей природно-очаговых инфекционных болезней, в том числе ГЛПС 28
------------------------------
28 Названия млекопитающих Российской Федерации представлены на латинском и русском языках, возможны изменения в соответствии с современной классификацией
------------------------------
1. Erinaceus europaeus Linnaeus, 1758 - Европейский ёж, Ежиные (Erinaceidae);
2. Erinaceus amurensis Schrenk, 1858 - Амурский ёж, Ежиные (Erinaceidae);
3. Erinaceus roumanicus Barrett - Hamilton, 1900 - Белогрудый ёж, Ежиные (Erinaceidae);
4. Hemiechinus auritus Gmelin, 1770 - Ушастый ёж, Ежиные (Erinaceidae);
5. Hemiechinus dauuricus Sundevall, 1842 - Даурский ёж, Ежиные (Erinaceidae);
6. Desmana moschata Linnaeus, 1758 - Русская выхухоль, Кротовые (Talpidae);
7. Talpa europaea Linnaeus, 1758 - Европейский крот, Кротовые (Talpidae);
8. Talpa levantis Thomas, 1906 - Малый крот, Кротовые (Talpidae);
9. Talpa caucasica Satunin, 1908 - Кавказский крот, Кротовые (Talpidae);
10. Talpa altaica Nikolsky, 1883 - Алтайский крот, Кротовые (Talpidae);
11. Mogera robusta Nehring, 1891 - Уссурийская могера, Кротовые (Talpidae);
12. Sorex araneus Linnaeus, 1758 - Обыкновенная бурозубка, Землеройковые (Soricidae);
13. Sorex satunini Ognev, 1922 - Кавказская бурозубка, Землеройковые (Soricidae);
14. Sorex tundrensis Merriam, 1900 - Тундряная бурозубка, Землеройковые (Soricidae);
15. Sorex daphaenodon Thomas, 1907 - Крупнозубая бурозубка, Землеройковые (Soricidae);
16. Sorex caecutiens Laxmann, 1788 - Средняя бурозубка, Землеройковые (Soricidae);
17. Sorex isodon Turov, 1924 - Равнозубая бурозубка, Землеройковые (Soricidae);
18. Sorex unguiculatus Dobson, 1890 - Когтистая бурозубка, Землеройковые (Soricidae);
19. Sorex roboratus Hollister, 1913 - Плоскочерепная (бурая) бурозубка, Землеройковые (Soricidae);
20. Sorex minutus Linnaeus, 1766 - Малая бурозубка, Землеройковые (Soricidae);
21. Sorex volnuchini Ognev, 1921 - Бурозубка Волнухина, Землеройковые (Soricidae);
22. Sorex gracillimus Thomas, 1907 - Тонконосая бурозубка, Землеройковые (Soricidae);
23. Sorex minutissimus Zimmermann, 1780 - Крошечная бурозубка, Землеройковые (Soricidae);
24. Sorex raddei Satumin, 1895 - Бурозубка Радде, Землеройковые (Soricidae);
25. Sorex mirabilis Ognev, 1937 - Гигантская бурозубка, Землеройковые (Soricidae);
26. Sorex jacksoni Hall et Gilmore, 1932 - Бурозубка Портенко, Землеройковые (Soricidae);
27. Sorex camtschaticus Yudin, 1972 - Камчатская бурозубка, Землеройковые (Soricidae);
28. Sorex leucogaster Kuroda, 1933 - Парамуширская бурозубка, Землеройковые (Soricidae);
29. Neomys anomalus Cabrera, 1907 - Малая кутора, Землеройковые (Soricidae);
30. Neomys teres Miller, 1908 - Кутора Шелковникова, Землеройковые (Soricidae);
31. Neomys fodiens Pennant, 1771 - Обыкновенная кутора, Землеройковые (Soricidae);
32. Crocidura leucodon Hermann, 1780 - Белобрюхая белозубка, Землеройковые (Soricidae);
33. Crocidura gueldenstaedtii Pallas, 1811 - Длиннохвостая (кавказская) белозубка, Землеройковые (Soricidae);
34. Crocidura suaveolens Pallas, 1811 - Малая белозубка, Землеройковые (Soricidae);
35. Crocidura shantungensis Miller, 1901 - Манчжурская белозубка, Землеройковые (Soricidae);
36. Crocidura sibirica Dukelsky, 1930 - Сибирская белозубка, Землеройковые (Soricidae);
37. Crocidura lasiura Dobson, 1890 - Уссурийская белозубка, Землеройковые (Soricidae);
38. Crocidura pulchella Lichtenstein, 1823 - Пегий путорак, Землеройковые (Soricidae);
39. Suncus etruscus Savi, 1822 - Карликовая многозубка, Землеройковые (Soricidae);
40. Canis aureus Linnaeus, 1758 - Шакал, Псовые (Canidae);
41. Canis lupus Linnaeus, 1758 - Волк, Псовые (Canidae);
42. Nyctereutes procyonoides Gray, 1834 - Енотовидная собака, Псовые (Canidae);
43. Vulpes vulpes Linnaeus, 1758 - Обыкновенная лисица, Псовые (Canidae);
44. Vulpes corsac Linnaeus, 1768 - Корсак, Псовые (Canidae);
45. Vulpes lagopus Linnaeus, 1758 - Песец, Псовые (Canidae);
46. Mustela erminea Linnaeus, 1758 - Горностай, Куньи (Mustelidae);
47. Mustela putorius Linnaeus, 1758 - Лесной (черный) хорь, Куньи (Mustelidae);
48. Mustela lutreola Linnaeus, 1758 - Европейская норка, Куньи (Mustelidae);
49. Mustela eversmanii Lesson, 1827 - Степной (светлый) хорь, Куньи (Mustelidae);
50. Mustela sibirica Pallas, 1773 - Колонок, Куньи (Mustelidae);
51. Mustela altaica Pallas, 1811 - Солонгой, Куньи (Mustelidae);
52. Mustela itatsi Temminck, 1844 - Итатси, Куньи (Mustelidae);
53. Mustela nivalis Linnaeus, 1766 - Ласка, Куньи (Mustelidae);
54. Neovison vison Schreber, 1777 - Американская норка, Куньи (Mustelidae);
55. Vormela peregusna Guldenstadt, 1770 - Перевязка, Куньи (Mustelidae);
56. Gulo gulo Linnaeus, 1758 - Росомаха, Куньи (Mustelidae);
57. Martes martes Linnaeus, 1758 - Лесная куница, Куньи (Mustelidae);
58. Martes foina Erxleben, 1777 - Каменная куница, Куньи (Mustelidae);
59. Martes zibellina Linnaeus, 1758 - Соболь, Куньи (Mustelidae);
60. Martes ftavigula Boddaert, 1785 - Харза, Куньи (Mustelidae);
61. Meles males Linnaeus, 1758 - Европейский барсук, Куньи (Mustelidae);
62. Meles leucurus Hodgson, 1847 - Азиатский барсук, Куньи (Mustelidae);
63. Lutra lutra Linnaeus, 1758 - Выдра, Куньи (Mustelidae);
64. Enhydra lutris Linnaeus, 1758 - Калан, Куньи (Mustelidae);
65. Procyon lotor Linnaeus, 1758 - Енот-полоскун, Енотовые (Procyonidae);
66. Ochotona dauurica Pallas, 1776 - Даурская пищуха, Пищуховые (Ochotonidae);
67. Ochotona pusilla Pallas, 1768 - Степная пищуха, Пищуховые (Ochotonidae);
68. Ochotona alpina Pallas, 1773 - Алтайская пищуха, Пищуховые (Ochotonidae);
69. Ochotona turuchanensis Naumov, 1934 - Туруханская пищуха, Пищуховые (Ochotonidae);
70. Ochotona hyperborea Pallas, 1811 - Северная пищуха, Пищуховые (Ochotonidae);
71. Ochotona mantchurica Thomas, 1909 - Манчжурская пищуха, Пищуховые (Ochotonidae);
72. Ochotona hoffinanni Formozov et al., 1996 - Пищуха Хоффманна, Пищуховые (Ochotonidae);
73. Ochotona pallasii Gray, 1867 - Монгольская пищуха, Пищуховые (Ochotonidae);
74. Lepus europaeus Pallas, 1778 - Заяц русак, Зайцевые (Leporidae);
75. Lepus tolai Pallas, 1778 - Заяц толай, Зайцевые (Leporidae);
76. Lepus mandshurtcus Radde, 1861 - Манчжурский заяц, Зайцевые (Leporidae);
77. Lepus timidus Linnaeus, 1758 - Заяц беляк, Зайцевые (Leporidae);
78. Oryctolagus cuniculus Linnaeus, 1758 - Дикий кролик, Зайцевые (Leporidae);
79. Sciurtis vulgaris Linnaeus, 1758 - Обыкновенная белка, Беличьи (Sciuridae);
80. Pteromys volans Linnaeus, 1758 - Обыкновенная летяга, Беличьи (Sciuridae);
81. Eutamias siblrieus Laxmann, 1769 - Азиатский бурундук, Беличьи (Sciuridae);
82. Urocitellus undulatus Pallas, 1779 - Длиннохвостый суслик, Беличьи (Sciuridae);
83. Urocitellus parryii Richardson, 1825 - Берингийский суслик, Беличьи (Sciuridae);
84. Spermophilus dauricus Brandt, 1844 - Даурский суслик, Беличьи (Sciuridae);
85. Spermophilus major Pallas, 1779 - Большой суслик, Беличьи (Sciuridae);
86. Spermophilus erythrogenys Brandt, 1841 - Краснощекий суслик, Беличьи (Sciuridae);
87. Spermophilus fulvus Lichtenstein, 1823 - Желтый суслик, Беличьи (Sciuridae);
88. Spermophilus pygmaeus Pallas, 1778 - Малый суслик, Беличьи (Sciuridae);
89. Spermophilus suslicus Guldenstadt, 1770 - Крапчатый суслик, Беличьи (Sciuridae);
90. Marmota bobak Muller, 1776 - Байбак, Беличьи (Sciuridae);
91. Marmota baibacina Kastschenko, 1899 - Серый сурок, Беличьи (Sciuridae);
92. Marmota kastsehenkoi Stroganov et Yudin, 1956 - Сурок Кащенко, Беличьи (Sciuridae);
93. Marmota sibirica Radde, 1862 - Тарбаган (монгольский сурок), Беличьи (Sciuridae);
94. Marmota camtschatica Pallas, 1811 - Камчатский (черношапочный) сурок, Беличьи (Sciuridae);
95. Dryomys nitedula Pallas, 1778 - Лесная соня, Соневые (Gliridae);
96. Eliomys quercinus Linnaeus, 1766 - Садовая соня, Соневые (Gliridae);
97. Glis glis Linnaeus, 1766 - Полчок, Соневые (Gliridae);
98. Muscardinus avellanarius Linnaeus, 1758 - Орешниковая соня, Соневые (Gliridae);
99. Castor fiber Linnaeus, 1758 - Евразийский (обыкновенный) бобр, Бобровые (Castoridae);
100. Castor canadensis Kuhl, 1820 - Североамериканский (канадский) бобр, Бобровые (Castoridae);
101. Sicista betulina Pallas, 1779 - Лесная мышовка, Мышовковые (Sminthidae);
102. Sicista strandi Formosov, 1931 - Мышовка Штранда (южная), Мышовковые (Sminthidae);
103. Sicista subtilis Pallas, 1773 - Степная мышонка, Мышовковые (Sminthidae);
104. Sicista loriger Nordmann, 1840 - Степная мышовка Нордманна, Мышовковые (Sminthidae);
105. Sicista severizovi Ognev, 1935 - Мышовка Северцова (темная), Мышовковые (Sminthidae);
106. Sicista caucasica Vinogradov, 1925 - Кавказская мышовка, Мышовковые (Sminthidae);
107. Sicista khichorica Sokolov et al., 1980 - Клухорская мышовка, Мышовковые (Sminthidae);
108. Sicista kazbegica Sokolov et al., 1986 - Казбегская мышовка, Мышовковые (Sminthidae);
109. Sicista napaea Hollister, 1912 - Алтайская мышовка, Мышовковые (Sminthidae);
110. Sicista caudata Thomas, 1907 - Длиннохвостая мышовка, Мышовковые (Sminthidae);
111. Cardiocranius paradoxus Satunin, 1903 - Пятипалый карликовый тушканчик, Карликовые тушканчики (Cardiocraniidae);
112. Dipus sagitta Pallas, 1773 - Мохноногий тушканчик, Трехпалые тушканчики (Dipodidae);
113. Stylodipus telum Lichtenstein, 1823 - Обыкновенный емуранчик, Трехпалые тушканчики (Dipodidae);
114. Allactaga major Kerr, 1792 - Большой тушканчик, Пятипалые тушканчики (Allactagidae);
115. Allactaga elater Lichtenstein, 1825 - Малый тушканчик, Пятипалые тушканчики (Allactagidae);
116. Allactaga sibirica Forster, 1778 - Тушканчик-прыгун, Пятипалые тушканчики (Allactagidae);
117. Pygeretmus pumilio Kerr, 1792 - Тарбаганчик, Пятипалые тушканчики (Allactagidae);
118. Spalax giganteus Nehring, 1898 - Гигантский слепыш, Слепышовые (Spalacidae);
119. Spalax microphthalmus Guldenstadt, 1770 - Обыкновенный слепыш, Слепышовые (Spalacidae);
120. Myospalax myospalax Laxmann, 1773 - Алтайский цокор, Цокориные (Myospalacidae);
121. Myospalax aspalax Pallas, 1776 - Даурский цокор, Цокориные (Myospalacidae);
122. Myospalax psilurus Milne - Edwards, 1874 - Манчжурский цокор, Цокориные (Myospalacidae);
123. Phodopus roborovskii Satunin, 1903 - Хомячок Роборовского, Хомяковые (Cricetidae);
124. Phodopus sungonis Pallas, 1773 - Джунгарский хомячок, Хомяковые (Cricetidae);
125. Phodopus campbelli Thomas, 1905 - Хомячок Кэмпбела, Хомяковые (Cricetidae);
126. Allocricetulus eversmanni Brandt, 1859 - Хомячок Эверсманна, Хомяковые (Cricetidae);
127. Allocricetulus curtatus Allen, 1925 - Монгольский хомячок, Хомяковые (Cricetidae);
128. Cricetulus migratorius Pallas, 1773 - Серый хомячок, Хомяковые (Cricetidae);
129. Cricetulus barabensis Pallas, 1773 - Барабинский хомячок, Хомяковые (Cricetidae);
130. Cricetulus longicaudatus Milne - Edwards, 1867 - Длиннохвостый хомячок, Хомяковые (Cricetidae);
131. Cricetus cricetus Linnaeus, 1758 - Обыкновенный хомяк, Хомяковые (Cricetidae);
132. Mesocricetus brandti Nehring, 1898 - Закавказский хомяк, Хомяковые (Cricetidae);
133. Mesocricetus raddei Nehring, 1894 - Предкавказский хомяк, Хомяковые (Cricetidae);
134. Tscherskia triton de Winton, 1899 - Крысовидный хомячок, Хомяковые (Cricetidae);
135. Ondatra zibethicus Linnaeus, 1766 - Ондатра, Хомяковые (Cricetidae);
136. Prometheomys schaposchnikowi Satunin, 1901 - Прометеева полёвка, Хомяковые (Cricetidae);
137. Dicrostonyx torquatus Pallas, 1778 - Копытный лемминг, Хомяковые (Cricetidae);
138. Dicrostonyx groenlandicus Trail, 1823 - Гренландский лемминг, Хомяковые (Cricetidae);
139. Lemmus lemmus Linnaeus, 1758 - Сибирский лемминг, Хомяковые (Cricetidae);
140. Lemmus trimucronaius Richardson, 1825 - Бурый лемминг, Хомяковые (Cricetidae);
141. Myopus schisticolor Lilljeborg, 1844 - Лесной лемминг, Хомяковые (Cricetidae);
142. Myodes glareolus Schreber, 1780 - Рыжая полёвка, Хомяковые (Cricetidae);
143. Myodes rutilus Pallas, 1779 - Красная полёвка, Хомяковые (Cricetidae);
144. Craseomys rufocanus Sundevall, 1846 - Красно-серая полёвка, Хомяковые (Cricetidae);
145. Craseomys rex Imaizumi, 1971 - Шикотанская (японская лесная) полёвка, Хомяковые (Cricetidae);
146. Alticola tuvinicus Ognev, 1950 - Тувинская полёвка, Хомяковые (Cricetidae);
147. Alticola semicanus Allen, 1924 - Хангайская полёвка, Хомяковые (Cricetidae);
148. Alticola barakshin Bannikov, 1947 - Гобийская полёвка, Хомяковые (Cricetidae);
149. Alticola strelzowi Kastschenko, 1901 - Плоскочерепная полёвка, Хомяковые (Cricetidae);
150. Alticola macrotis Radde, 1861 - Большеухая полёвка, Хомяковые (Cricetidae);
151. Alticola lemminus Miller, 1899 - Лемминговидная полёвка, Хомяковые (Cricetidae);
152. Ellobius talpinus Pallas, 1770 - Обыкновенная слепушонка, Хомяковые (Cricetidae);
153. Ellobius tancrei Blasius, 1884 - Восточная слепушонка, Хомяковые (Cricetidae);
154. Lagunis lagurus Pallas, 1773 - Степная пеструшка, Хомяковые (Cricetidae);
155. Arvicola amphibius Linnaeus, 1758 - Водяная полёвка, Хомяковые (Cricetidae);
156. Chionomys nivalis Martins, 1842 - Снеговая полёвка, Хомяковые (Cricetidae);
157. Chionomys gud Satunin, 1909 - Гудаурская полёвка, Хомяковые (Cricetidae);
158. Chionomys roberti Thomas, 1906 - Малоазипская полёвка, Хомяковые (Cricetidae);
159. Lasiopodomys brandtii Radde, 1861 - Полёвка Брандта, Хомяковые (Cricetidae);
160. Lasiopodomys mandarinus Milne - Edwards, 1871 - Китайская полёвка, Хомяковые (Cricetidae);
161. Lasiopodomys gregalis Pallas, 1779 - Узкочерепная полёвка, Хомяковые (Cricetidae);
162. Agricola agrestis Linnaeus, 1761 - Темная (нашейная) полёвка, Хомяковые (Cricetidae);
163. Alexandromys middendorffii Poljakov, 1881 - Полёвка Миддендорфа, Хомяковые (Cricetidae);
164. Alexandromys mongolicus Radde, 1861 - Монгольская полёвка, Хомяковые (Cricetidae);
165. Alexandromys shantaricus Ognev, 1929 - Полёвка Громова, Хомяковые (Cricetidae);
166. Alexandromys alpinus Lissovsky et al., 2018 - Западномонгольская полёвка, Хомяковые (Cricetidae);
167. Alexandromys maximowiczii Schrenk, 1859 - Полёвка Максимовича, Хомяковые (Cricetidae);
168. Alexandromys fortis Buchner, 1889 - Восточная полёвка, Хомяковые (Cricetidae);
169. Alexandromys sachalinensis Vasin, 1955 - Сахалинская полёвка, Хомяковые (Cricetidae);
170. Alexandromys oeconomus Pallas, 1776 - Полёвка-экономка, Хомяковые (Cricetidae);
171. Microtus subterraneus Selys - Longchamps, 1838 - Подземная полёвка, Хомяковые (Cricetidae);
172. Microtus daghestanicus Shidlovsky, 1919 - Дагестанская полёвка, Хомяковые (Cricetidae);
173. Microtus majori Thomas, 1906 - Кустарниковая полёвка, Хомяковые (Cricetidae);
174. Microtus arvalis Pallas, 1778 - Обыкновенная полёвка, Хомяковые (Cricetidae) 29;
175. Microtus rossiaemeridionalis Ognev, 1924 - Восточноевропейская полёвка, Хомяковые (Cricetidae) 29;
------------------------------
29 Microtus arvalis и Microtus rossiaemeridionalis внешне не отличаются. При отсутствии результатов определения вида при помощи молекулярно-генетических методов, рекомендуется указывать: "обыкновенная полёвка" Microtus arvalis s.l. (обыкновенная полёвка, не определенная до вида).
------------------------------
176. Microtus socialis Pallas, 1773 - Общественная полёвка, Хомяковые (Cricetidae);
177. Meriones meridianus Pallas, 1773 - Полуденная песчанка, Мышиные (Muridae);
178. Meriones tamariscinus Pallas, 1773 - Тамарисковая песчанка, Мышиные (Muridae);
179. Meriones unguiculatus Milne - Edwards, 1867 - Когтистая песчанка, Мышиные (Muridae);
180. Micromys minutus Pallas, 1771 - Мышь-малютка, Мышиные (Muridae);
181. Apodemus agrarius Pallas, 1771 - Полевая мышь, Мышиные (Muridae);
182. Apodemus peninsulae Thomas, 1907 - Восточноазиатская мышь, Мышиные (Muridae);
183. Apodemus speciosus Temminck, 1844 - Японская мышь, Мышиные (Muridae);
184. Sylvaemus sylvaticus Linnaeus, 1758 - Европейская лесная мышь, Мышиные (Muridae);
185. Sylvaemus uralensis Pallas, 1811 - Малая лесная мышь, Мышиные (Muridae);
186. Sylvaemus witherbyi Thomas, 1902 - Степная (желтобрюхая) мышь, Мышиные (Muridae);
187. Sylvaemus flavicollis Melchior, 1834 - Желтогорлая мышь, Мышиные (Muridae);
188. Sylvaemus ponticus Sviridenko, 1936 - Кавказская мышь, Мышиные (Muridae);
189. Mus musculus Linnaeus, 1758 - Домовая мышь. Мышиные (Muridae);
190. Mus spicilegus Petenyi, 1882 - Курганчиковая мышь, Мышиные (Muridae);
191. Mus macedonicus Petrov and Ruzic, 1983 - Македонская мышь, Мышиные (Muridae);
192. Rattus norvegicus. Berkenhout, 1769 - Серая крыса (пасюк), Мышиные (Muridae);
193. Rattus rattus Linnaeus, 1758 - Черная крыса, Мышиные (Muridae);
194. Hystrix indica Kerr, 1792 - Индийский дикобраз, Дикобразовые (Hystricidae);
195. Myocastor coypus Molina, 1782 - Нутрия, Нутриевые (Myocastoridae).
Приложение 2
к МУ 3.1.3844-23
Основные принципы прогнозирования эпидемической ситуации в очагах ГЛПС
1. Прогнозирование эпизоотической активности природных очагов ГЛПС на территории Российской Федерации осуществляется на краткосрочную (сезон) и среднесрочную (год) перспективу. При этом краткосрочные эколого-эпизоотологические прогнозы являются фрагментом среднесрочного прогнозирования" изменения эпидемической обстановки в природных очагах ГЛПС.
Эпизоотологические и эпидемиологические прогнозы по ГЛПС основывают на широком спектре эколого-эпизоотологических и эпидемиологических данных, характеризующих эпизоотическую и эпидемическую активность природных очагов ГЛПС. Внедрение в практику эпидемиологического надзора прогнозов различной длительности дает возможность более точно определить время, место и масштаб обострения эпизоотической и эпидемической ситуации в природных очагах ГЛПС, позволяет разработать оптимальную и наиболее эффективную стратегию профилактики заболеваемости и организовать рациональное использование материальных и человеческих ресурсов. При этом проведение комплекса превентивных профилактических (противоэпидемических) мер на участках высокого риска заражения значительно эффективнее и дешевле, чем экстренная ликвидация внезапных вспышек в пик эпидемической активности природных очагов ГЛПС.
Для снижения рисков заражения необходимо сочетать качественные и количественные методы прогнозирования эпизоотической и эпидемической обстановки. Основой качественного эпизоотологического и эпидемиологического прогноза является экспертная оценка, базирующаяся на анализе имеющихся данных. Качественный прогноз эпидемических рисков заражения ГЛПС необходимо проведать в форме бальной оценки (риск заболеваемости отсутствует, низкий, средний, высокий для всех категорий административных, территорий (район, область, край, республика) (табл. 1).
В зависимости от текущей ситуации по каждой из градаций (А-Е) выставляют соответствующие баллы, из суммы которых вычисляется средняя арифметическая. При этом при среднем балле 1 дается прогноз на отсутствие рисков заражения; при 2 баллах на сохранение низкого уровня, при 3 баллах - на соответствие среднему уровню, при 4 - высокому уровню риска заражения.
Таблица 1
Балльная оценка прогностических рисков заражения в природных очагах ГЛПС Российской Федерации
| Уровень эпидемических рисков по ГЛПС для отдельных административных территорий | Уровень значений основных предикторов изменения эпизоотической и эпидемической ситуации по ГЛПС | Климатические характеристики (например, увлажненность, температура) | Количественная оценка используемых предикторов обострения эпизоотической, эпидемической ситуации, баллы | ||
|---|---|---|---|---|---|
| Заболеваемости ГЛПС в предшествующий сезон, год | Численности и индекса доминирования рыжей полёвки, других фоновых видов грызунов | Инфицированности рыжей полёвки и других резервуарных хозяев хантавирусов | |||
| (X) | (А) | (В) | (С) | (D) | |
| Отсутствуют | Очень низкий или его резкое падение | Повышение аридности климата | 1 | ||
| Низкий | Ниже среднемноголетних показателей | Соответствуют среднемноголетним показателям | 2 | ||
| Средний | Соответствует среднемноголетним показателям | Снижение аридности климата | 3 | ||
| Высокий | Выше среднемноголетних показателей и (или) его быстрый рост | Установление оптимальных климатических условий для существования популяций резервуарных хозяев хантавирусов | 4 | ||
2. Оценку параметров прогностических рисков заражения на отдельных административных территориях проводят по формуле:
X = (A + B + C + D) : 4,
где X - уровень прогностических рисков по ГЛПС для отдельных административных территорий Российской Федерации;
А - уровень заболеваемости ГЛПС в предшествующий сезон, год;
В - уровень численности и индекса доминирования рыжей полёвка и других резервуарных хозяев хантавирусов;
С - уровень инфицированности рыжей полёвки и других резервуарных хозяев хантавирусов;
D - показатель состояния климатических факторов.
3. Основные этапы построения эпизоотологического прогноза по ГЛПС:
- проведение эпизоотологического мониторинга природного очага ГЛПС;
- составление ретроспективной характеристики сезонной (годовой) заболеваемости ГЛПС;
- составление характеристики погодных условий, влияющих на состояние численности рыжей полёвки и других резервуарных хозяев хантавирусов;
- оценка кормовой базы резервуарных хозяев хантавирусов;
- оценка сезонной и многолетней динамики численности рыжей полёвки и других резервуарных хозяев хантавирусов, индексов их доминирования в различных частях ареала;
- оценка условий переживания зимнего периода популяций рыжей полёвки и других резервуарных хозяев хантавирусов;
- оценка размножения рыжей полёвки и других резервуарных хозяев хантавирусов;
- оценка численности синантропных видов грызунов в населенных пунктах;
- оценка интенсивности инфицированности рыжей полёвки и других резервуарных хозяев хантавирусов;
- составление экспертного (качественного) прогноза эпизоотической активности природных очагов ГЛПС.
4. Оценка прогностических рисков заражения в границах энзоотичной по ГЛПС территории строится на основе эпидемических и эпизоотологических показателей, в первую очередь "факторов риска", "территорий риска", "времени риска", "контингентов риска". Масштабность прогностических эпидемических проявлений ГЛПС во многом определяется интенсивностью контактов населения с очаговыми территориями. Тем не менее экспертные прогнозы эпидемической обстановки характеризуются высокой степенью реализации и позволяют определять основные тенденции сезонной и многолетней динамики эпизоотической и эпидемической активности природных очагов ГЛПС.
Количественный прогноз отличается тем, что в основе анализа используются показатели, имеющие численное выражение с возможностью составления временных рядов баз данных. Количественная оценка прогнозируемой ситуации возможна в случае, если массив имеющихся эпизоотологических и эпидемиологических данных достоверен, однороден и достаточен для составления минимального временного ряда, пригодного да статистической обработки. При этом показатели уровня заболеваемости, численности и инфицированности рыжей полёвки и других резервуарных хозяев хантавирусов, погодных условий являются основой для разработки краткосрочных (сезонных) и среднесрочных (годовых) прогнозов эпизоотической и эпидемической активности природных очагов ГЛПС.
5. Вариантом количественного прогноза заболеваемости населения эндемичных территорий может являться результат ретроспективного эпидемиологического анализа при условии выявления в многолетней динамике четкой цикличности со строгой периодичностью.
В эпидемиологической практике ретроспективный эпидемиологический анализ проводится методом наименьших квадратов с использованием прямолинейной функции (регрессии):
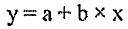 ,
,
где у - теоретическое значение показателя заболеваемости;
х - порядковый (ранжированный) номер года (при условии, что х для медианы вариационного ряда равен 0);
а - среднемноголетний показатель заболеваемости;
b - коэффициент регрессии (коэффициент наклона).
6. В повседневной практике с помощью функциональных возможностей электронных таблиц рекомендуется использование упрощенного варианта указанной регрессии:
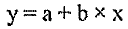 ,
,
где у - теоретическое (предсказанное) значение показателя;
х - время (порядковый номер года);
а - начальный уровень ряда;
b - коэффициент регрессии (коэффициент наклона).
При этом прямые, полученные обоими способами, и расчетные (теоретические) показатели на следующий год полностью совпадают.
7. Прогноз заболеваемости на следующий (расчетный) год рассчитывают с учетом доверительного интервала 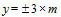 , с m рассчитанной по формуле:
, с m рассчитанной по формуле:
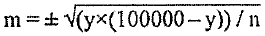 ,
,
где у - теоретическая заболеваемость прогнозируемого года;
n - предполагаемая численность населения изучаемой территории (как правило берется численность текущего года), при используемых единицах измерения "случаев на 100 тысяч населения".
При низкой численности населения (менее 100 тысяч) рекомендуется использовать 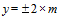 или даже
или даже 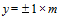 . Для выбора соответствующего множителя следует опираться на опыт соответствия друг другу расчетных (прогнозируемых) и фактических показателей заболеваемости предыдущих лет.
. Для выбора соответствующего множителя следует опираться на опыт соответствия друг другу расчетных (прогнозируемых) и фактических показателей заболеваемости предыдущих лет.
Определение цикличности и периодичности заболеваемости в этом случае можно провести визуально, исходя из предпосылки, что полученная линия регрессии является виртуальной осью х для предполагаемой линии графика цикличности.
При прогнозировании заболеваемости необходимо учитывать фазу выявленной цикличности, приходящейся на следующий год (период). При положительной фазе стоит предположить изменение прогнозируемого показателя в пределах от у до 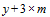 , при отрицательной - от у до
, при отрицательной - от у до 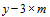 .
.
8. Для "качественного" прогнозирования заболеваемости населения эндемичных территорий целесообразно использовать накопленные данные численности и инфицированности отловленных зверьков. Следует помнить, что необходимо применять данные только биологических видов, формирующих резервуар инфекции. Например, для возбудителя ГЛПС Пуумала - рыжая полёвка.
Первоначально необходимо определить, существует ли достоверная корреляционная зависимость между численностью (и/или инфицированностью) отловленных зверьков с заболеваемостью населения за предыдущий максимально возможный период. Это возможно осуществить с помощью электронных таблиц, содержащих функцию "коррел" (или подобные), соответствующую определению коэффициента параметрической корреляции Пирсона. Следует помнить, что количество величин в сравниваемых вариационных рядах должно быть одинаковым. Методически верным, будет подвергнуть имеющиеся числовые данные проверке на нормальность распределения.
Оценить полученный коэффициент корреляции можно соответственно шкале Чеддока (табл. 2). В практике имеют значение коэффициенты корреляции, относящиеся (по модулю) к категориям оцениваемой связи "высокая" и "весьма высокая", т.е. превышающие (или равные) значение 0,7. Отрицательный коэффициент корреляции свидетельствует об обратной зависимости, т.е. когда с увеличением значений данных в одном из сравниваемых вариационном ряду происходит снижение в другом. Например, увеличение площадей, охватываемых дератизационной обработкой и, как следствие, снижение заболеваемости. Независимо от знака коэффициента корреляции необходимо определить его достоверность.
Таблица 2
Шкала Чеддока для оценки силы корреляционных связей
| Корреляционный коэффициент * | 0,1 - 0,3 | 0,3 - 0,5 | 0,5 - 0,7 | 0,7 - 0,9 | 0,9 - 1,0 |
|---|---|---|---|---|---|
| Характеристика связи | Слабая | Умеренная | Заметая | Высокая | Весьма высокая |
| Примечание: * - по модулю. | |||||
Оценить достоверность полученного коэффициента корреляции возможно при расчете критериального (t критер.) и критического (t критич.) значений коэффициента Стьюдента. Для этого t критер. рассчитываем по формуле:
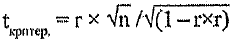 ,
,
где r - полученный коэффициент корреляции;
n - число наблюдений;
t критич. - рассчитывается при использовании функции "Стьюдрасобр", где под "степенью свободы" подразумевается число наблюдений (n).
При условии t критер. > t критич. полученный коэффициент корреляции следует считать достоверным (р  0,05). В ином случае коэффициент корреляции недостоверен и его использование неправомерно. Низкое значение t чаще всего объясняется недостаточным числом наблюдений (количество лет анализируемого периода) или распределением данных внутри вариационного ряда, не соответствующим нормальному (параметрическому) распределению.
0,05). В ином случае коэффициент корреляции недостоверен и его использование неправомерно. Низкое значение t чаще всего объясняется недостаточным числом наблюдений (количество лет анализируемого периода) или распределением данных внутри вариационного ряда, не соответствующим нормальному (параметрическому) распределению.
При достоверном коэффициенте корреляции между сравниваемыми величинами - заболеваемость и численность (и/или инфицированность) зверьков в отловах - можно качественно транспонировать выявленные тенденции численности (и/или инфицированности) в виде прогноза заболеваемости населения в следующем году. Отсутствие значимой корреляционной связи может быть обусловлено:
- коротким периодом наблюдений (малом числом лет);
- активностью социальных факторов (ограничительные мероприятия, низкая обращаемость населения за медицинской помощью при легких формах ГЛПС, например в связи ограничительными мероприятиями, закрытием территорий природных очагов в связи с пожароопасностью);
- природными факторами (например, аномальные климатические изменения, лесные пожары, подтапливание территорий);
- другими, не выявленными или малоизученными явлениями.
Приложение 3
к МУ 3.1.3844-23
Планирование полевых зоологических работ в природных очагах ГЛПС
1. Годовой план полевых зоологических работ центров гигиены и эпидемиологии в субъектах Российской Федерации (далее - федеральных бюджетных учреждений здравоохранения) составляется с разбивкой по месяцам. В годовом плане отражается обследование всех основных типов ландшафтно-экологических формаций субъекта Российской Федерации во все фенологические сезоны года (весна, лето, осень, зима). Границы контрольных (стационарных) участков целесообразно выбирать с. учетом физико-географического, эпидемиологического и эпизоотологического районирования территории, накопленных среднемноголетних данных, в том числе многолетней динамики эпизоотических проявлений природных очагов ГЛПС, с учетом их типологии, независимо от административно-территориального устройства субъекта Российской Федерации.
Годовой план полевых зоологических работ федеральных бюджетных учреждений здравоохранения включает проведение общей оценки биотических и абиотических условий на закрепленной территории, рекогносцировочных обследований и работ на стационарных участках.
В годовом, плане предусматривается возможность корректировки ежемесячных выездов, изменения в выборе обследуемых территорий в зависимости от условий среды, складывающейся эпидемической и эпизоотической обстановки.
В годовых планах рекомендуется указывать территории муниципальных образований (административных районов), планируемые для обследования, и объемы выставляемых орудий лова (ловушек, капканов) для учетов мелких млекопитающих.
Рекомендуемый объем учетных работ за один тур обследования в каждой стации - не менее 300 - 500 ловушко-ночей в зависимости от площади данного биотопа. Единовременно за одну ночь в открытых луго-полевых, и лесокустарниковых стациях - не менее 100 - 200 ловушек 30.
------------------------------
30 П. 4.4 MP 3.1.7.0250-21.
------------------------------
2. Годовой план полевых зоологических работ противочумных станций (далее - федеральных казенных учреждений здравоохранения) разрабатывается в соответствии с методическими документами 31.
------------------------------
31 П. 4.8 МУ 3.1.3.2355-08 "Организация и проведение эпидемиологического надзора в природных очагах чумы на территории Российской Федерации", утвержденных Руководителем Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека, Главным государственным санитарным врачом Российской Федерации 30.04.2008.
------------------------------
3. Между федеральными бюджетными и казенными учреждениями здравоохранения обеспечивается постоянный обмен информацией, в том числе о состоянии популяций резервуарных хозяев возбудителей природно-очаговых инфекций, включая ГЛПС 32.
------------------------------
32 Приказ Роспотребнадзора от 14.01.2013 N 6 "Об утверждении инструкции по оформлению обзора и прогноза численности мелких млекопитающих и членистоногих".
------------------------------
Приложение 4
к МУ 3.1.3844-23
Дезинфекция в очагах ГЛПС
1. Целью дезинфекции является уничтожение хантавирусов на путях передачи в очаге ГЛПС. В антропоургических очагах обеззараживанию подвергаются поверхности (например, пол, подоконник, мебель) и предметы быта (например, посуда, хлебницы, микроволновые печи, холодильники, белье, одежда), инфицированные экскретами (кал, моча, слюна) грызунов. В природных очагах дезинфекцию проводят в локальных местах, приспособленных населением для временного или постоянного пребывания.
Для очаговой дезинфекции применяют хорошо растворимые в воде дезинфицирующие средства в виде рабочих растворов, приготавливаемых из водорастворимых таблеток и порошков в соответствии с инструкциями по применению. В очагах ГЛПС используют хлорсодержащие дезинфектанты, обладающие высоким вирулицидным действием.
Текущую очаговую дезинфекцию проводят по результатам эпизоотологического обследования с целью экстренного обеззараживания объектов в отдельных строениях, где зарегистрированы случаи заражения людей возбудителем. ГЛПС, либо на ограниченной территории очага, где отмечается эпизоотия грызунов и имеется контакт населения с возбудителями через объекты внешней среды.
Профилактическую дезинфекцию помещений и объектов окружающей среды проводят при высокой численности грызунов на объектах и территориях, где возможно заражение ГЛПС. Она осуществляется до сезона появления людей в конкретном очаге.
Обеззараживание объектов дезинфицирующими средствами проводят способом орошения или протиранием, в соответствии с инструкциями по применению. Профилактическая дезинфекция в дачных домиках осуществляется весной в период начала дачного сезона (при расконсервации их после зимы и перед началом уборки помещений).
При планировании количества дезинфекционных средств, необходимых для обработки помещений и инфицированных объектов внешней среды, производят расчет исходя из норм расхода на 1 м 2 обрабатываемой площади. Хантавирусы относительно неустойчивы во внешней среде, поэтому помещения дачных домиков или квартир (бытовые очаги ГЛПС) подвергаются однократному мелкодисперсному орошению в профилактических (текущая дезинфекция) или экстренных (очаговая дезинфекция) целях.
В квартирных очагах при жалобах на появление грызунов дезинфекцию осуществляют одновременно с уборкой помещения. При дезинфекции помещений расходуют 0,1 л/м 2 при протирании и 0,2 л/м 2 при орошении пола. Дезинфекцию проводят равномерным орошением обрабатываемых поверхностей, предметов (в дачных и частных домах, квартирах) и объектов окружающей среды. Камерную дезинфекцию проводят для обеззараживания постельных принадлежностей, ковров и других мягких вещей. Обработку осуществляют при температуре плюс 80 - 90 °C и норме загрузки 40 кг на 1 м 2 полезной площади пола камеры. Время дезинфекции от 10 до 45 минут.
Дезинфекционную обработку в природных очагах проводят на небольших участках (до 100 га) в местах, приспособленных населением для временного отдыха по берегам рек, озер, в лесопарковых массивах и т.д. Расход дезинфектантов при мелкодисперсном орошении инфицированных объектов внешней среды в местах отдыха, свалок мусора и около них составляет от 0,3 до 0,5 л на м 2.
С целью индивидуальной защиты людей (например, сельского населения, работников железной дороги, дачников, охотников, рыбаков, туристов) от контакта с возбудителями ГЛПС, прерывания механизма передачи (респираторного, алиментарного) применяют: для защиты дыхательных путей - лепестковые респираторы, облегченные матерчатые маски; для протирания рук и лица - дезинфицирующие салфетки однократного действия, водно-спиртовые или гелиевые кожные антисептики. Необходимо хранить пищевые продукты в непроницаемой для грызунов таре и уничтожать продукты, поврежденные грызунами или контаминированные их выделениями.
Приложение 5
к МУ 3.1.3844-23
Способы взятия, условия хранения и транспортирования клинического секционного материала для лабораторной диагностики ГЛПС
1. Забор материала для иммунологической диагностики.
1.1. Материал для исследования. Для иммунологического исследования на наличие антител к хантавирусам используется сыворотка крови (как основной метод) и моча (как дополнительный метод). Для определения антигенов хантавирусов в тканях человека (материалах аутопсии) можно исследовать суспензии органов (почки, печень, легкие, селезенка).
1.2. Методы исследования. Основные - ИФА, МФА.
1.3. Период забора материала. Первый забор крови - при обращении больного за медицинской помощью (желательно до 4 - 7 дней, болезни), параллельно забирают мочу (1,0 мл). Повторный забор крови и мочи проводят через 2 - 3 дня.
При отсутствии антител во второй образце, но сохранении подозрения на ГЛПС, рекомендуется произвести забор третьего образца крови у пациента через 2 - 3 дня после второго.
Кусочки органов забирают при проведении аутопсии. Отбор секционного материала необходимо произвести как можно быстрее после смерти больного.
1.4. Методика забора материала. Забор крови производят натощак или не менее чем через 3 часа после приема пищи из вены с помощью вакуумной системы для забора крови типа "Vacuett" в пробирку с активатором сгустка. Пробирку аккуратно переворачивают несколько раз вверх дном, чтобы кровь перемешалась с реагентом. При отсутствии пробирок с реагентами возможен забор крови одноразовым шприцем с иглой диаметром 0,8 - 1,1 мм в стерильную пробирку без реагента, герметично закрывающуюся.
Мочу собирают в стерильный пластиковый контейнер объемом 30 - 50 мл. Для исследования необходима средняя порция утренней мочи.
Секционный материал. Отбирают кусочки тканей почек, печени, легких, селезенки. Забор проб проводят из нескольких участков, подвергшихся изменениям, и из участка рядом расположенной ткани, которая выглядит неизмененной. При наличии распада ткани основное внимание, обращают на пограничную зону. Кусочки материала объемом не более 1 х 1 х 1 см помещают в одноразовые стерильные контейнеры (емкости) с плотно завинчивающимися крышками.
1.5. Предобработка проб. Для получения сыворотки пробирку с кровью отстаивают при комнатной температуре в течение 30 мин до полного образования сгустка. Сыворотку переносят с помощью автоматического дозатора отдельным наконечником с фильтром (или пастеровской пипеткой) в стерильную пробирку. Сыворотка не должна быть гемолизированной.
Образец мочи объемом 1,0 мл центрифугируют в пробирке тина "Эппендорф" при 8000 об/мин в течение 10 мин. Величина центробежного ускорения g для используемой центрифуги рассчитывается по формуле:
g = 0,00001118 х r х (об/мин) 2,
где r - радиус ротора центрифуги в мм.
Осторожно удаляют 0,9 мл верхней части надосадочной жидкости в емкость с дезинфицирующим раствором. Осадок ресуспендируют в оставшихся 100 мкл надосадочной жидкости и используют (в неразведенном виде) для выявления специфических антител к хантавирусам.
Кусочки органов растирают в стерильных фарфоровых ступках или с помощью гомогенизатора и готовят 10 %-ю суспензию в стерильном 0,9 %-м растворе натрия хлорида или фосфатном буфере. Суспензию переносят в микропробирку объемом 1,5 мл и центрифугируют при 10000 об/мин в течение 30 секунд. Величина центробежного ускорения g для используемой центрифуги рассчитывается по формуле, представленной в п. 1.5 приложения 5 к настоящим МУ. Супернатант используют для постановки ИФА.
2. Забор материала для молекулярно-биологического исследования.
2.1. Материал для исследования.
Материалом для исследования служат образцы цельной крови, сыворотки и/или плазмы крови, мочи, пробы секционного материала (почки, печень, легкие, селезенка).
2.1. Методы исследования.
Основные - ОТ-ПЦР, РТ-ПЦР, секвенирование.
2.2. Период забора материала.
Кровь - забирают при обращении больного за медицинской помощью (желательно не позднее 5-го дня от начала заболевания). Мочу забирают в острый период заболевания. Кусочки органов забирают при проведении аутопсии. Отбор секционного материала необходимо произвести как можно быстрее после смерти больного.
2.3. Методика забора материала.
Кровь для получения сыворотки или плазмы для исследования методами ОТ-ПЦР или РТ-ПЦР забирают, как указано в п. 1.4 приложения 5 к настоящим МУ.
Для исследования цельной крови и плазмы кровь забирают натощак или не менее чем через 3 часа после приема пищи из вены с помощью вакуумной системы для забора крови типа "Vacuett" в пробирку с антикоагулянтом (с ЭДТА или с раствором натрия цитрата. Гепарин в качестве антикоагулянта использовать нельзя!). Пробирку аккуратно переворачивают несколько раз вверх дном, чтобы кровь перемешалась с реагентом.
Мочу собирают в стерильный пластиковый контейнер объемом 30 - 50 мл. Для исследования необходима средняя порция утренней мочи.
Секционный материал забирают, как указано в п. 1.4 приложения 5 к настоящим МУ.
2.4. Предобработка проб. Для получения сыворотки кровь обрабатывают, как указано в п. 1.5 приложения 5 к настоящим МУ.
Для работы с цельной кровью переносят необходимый объем материала с помощью автоматического дозатора отдельным наконечником с фильтром (или пастеровской пипеткой) в пробирку объемом 1,5 мл.
Для получения плазмы пробирку с кровью центрифугируют в течение 10 минут при величине центробежного ускорения g, соответствующей скорости вращения 2000 об/мин. Величина центробежного ускорения g для используемой центрифуги рассчитывается по формуле, представленной в п. 1.5 приложения 5 к настоящим МУ.
После центрифугирования плазму крови отбирают в пробирку объемом 1,5 мл.
Моча. При наличии центрифуги с охлаждением до плюс 4 °C для центрифужных пробирок типа "Фалькон" объемом 50 мл и ускорением 10000 об/мин образец мочи в объеме 10,0 мл центрифугируют при g, соответствующей 10000 об/мин, в течение 10 мин (величина центробежного ускорения g для используемой центрифуги рассчитывается по формуле, представленной в п. 1.5 приложения 5 к настоящим МУ). После центрифугирования надосадочную жидкость удаляют в емкость с дезинфицирующим раствором, а осадок и 1 мл надосадочной жидкости над ним переносят в пробирку типа "Эппендорф". Затем снова концентрируют пробу при g, соответствующей 10000 об/мин, в течение 10 мин (величина центробежного ускорения g для используемой центрифуги рассчитывается по формуле, представленной в п. 1.5 приложения 5 к настоящим МУ). Верхнюю часть надосадочной жидкости удаляют в емкость с дезинфицирующим раствором, а осадок ресуспендируют в нижней части надосадочной жидкости (100 - 200 мкл) и используют для экстракции РНК. Для экстракции РНК, в случае наличия большого количества солей, в отдельную пробирку типа "Эппендорф" переносят нижнюю часть надосадочной жидкости и используют ее для исследования. При отсутствии центрифуги с указанными выше параметрами проводят концентрирование только из 1 мл мочи, как описано выше. Экстракцию РНК также проводят из осадка и нижней части надосадочной жидкости.
Кусочки органов подготавливают, как указано в п. 1.5 приложения 5 к настоящим МУ.
3. Забор материала для вирусологического исследования.
3.1. Материал для исследования. Материалом для выделения возбудителей ГЛПС являются цельная кровь, плазма, сгусток крови, секционный материал (почки, печень, легкие, селезенка).
3.2. Метод исследования. Выделение вирусов на чувствительной биологической модели.
3.3. Период забора материала. Согласно п. 2.3 приложения 5 к настоящим МУ.
3.4. Методика забора материала. Кровь для исследования цельной крови и плазмы забирают, как указано в п. 2.4 приложения 5 к настоящим МУ; для исследования сгустка - как указано в п. 1.4 приложения 5 к настоящим МУ.
Секционный материал отбирают, как указано в п. 1.4 приложения 5 к настоящим МУ.
3.5. Предобработка проб. Согласно пп. 1.5 и 2.5 приложения 5 к настоящим МУ.
Для вирусологического исследования недопустимо внесение в пробы консерванта и проведение инактивации материала.
4. Условия хранения проб. Плазму и сыворотку крови хранят при температуре от плюс 2 °C до плюс 8 °C не более 2 суток, при температуре от минус 18 °C до минус 20 °C - не более одного месяца, при температуре не выше минус 70 °C или в жидком азоте - длительно. Образцы тканей хранят при температуре не выше минус 18 °C до месяца, при температуре не выше минус 70 °C или в жидком азоте - длительно.
Мочу для исследования на наличие антител к хантавирусам с помощью МФА хранят при температуре от плюс 2 °C до плюс 8 °C не более 2 - 3 суток, при температуре от минус 18 °C до минус 20 °C - длительно.
Мочу для исследования методом ПЦР, если нет возможности для ее транспортировки и исследования в течение 1 суток после взятия, переносят в центрифужную пробирку типа "Фалькон" или пробирку типа "Эппендорф", затем в нее вносят глицерин (10 % от объема пробы), перемешивают для равномерного распределения глицерина и замораживают при минус 18 °C для хранения в течение 1 недели, для более длительного хранения - при минус 70 °С.
Не допускается оттаивание материала до проведения исследования.
Цельная кровь замораживанию не подлежит. Необходимо отделить сыворотку крови от сгустка.
Все виды (аликвоты) материала, предназначенные для вирусологического исследования, хранят при температуре не выше минус 70 °C.
5. Условия транспортировки материала в лабораторию.
Материал должен быть транспортирован в лабораторию в максимально короткие сроки с момента забора. Если время транспортировки материала в лабораторию не превышает 4 ч, то возможно использование термоконтейнера с хладагентами; в этом случае материал до транспортировки не подлежит замораживанию.
При замораживании клинического материала его транспортировка также должна проводиться в замороженном состоянии. Допускается только однократное замораживание-оттаивание образцов.
При невозможности быстрой доставки материал для вирусологического исследования следует транспортировать в лабораторию в сосудах Дьюара с жидким азотом или в емкости с сухим льдом.
Нормативные и методические документы
1. Федеральный закон от 30.03.1999 N 52-ФЗ "О санитарно-эпидемиологическом благополучии населения".
2. Постановление Правительства Российской Федерации от 30.06.2021 N 1100 "О федеральном государственном санитарно-эпидемиологическом контроле (надзоре)".
3. СанПиН 3.3686-21 "Санитарно-эпидемиологические требования по профилактике инфекционных болезней".
4. Приказ Роспотребнадзора от 01.12.2017 N 1116 "О совершенствовании системы мониторинга, лабораторной диагностики инфекционных и паразитарных болезней и индикации ПБА в Российской Федерации".
5. Приказ Роспотребнадзора от 14.01.2013 N 6 "Об утверждении инструкции по оформлению обзора и прогноза численности мелких млекопитающих и членистоногих".
6. МУ 3.4.3008-12 "Порядок эпидемиологической и лабораторной диагностики особо опасных, "новых" и "возвращающихся" инфекционных болезней".
7. МУ 3.5.3.2949-11 "Борьба с грызунами в населенных пунктах, на железнодорожном, водном, воздушном транспорте".
8. МУ 3.1.3.2355-08 "Организация и проведение эпидемиологического надзора в природных очагах чумы на территории Российской Федерации".
9. МУ 1.3.2569-09 "Организация работы лабораторий, использующих Методы амплификации нуклеиновых кислот при работе с материалом, содержащим микроорганизмы I - IV групп патогенности".
10. МУ 3.4.2552-09 "Организация и проведение первичных противоэпидемических мероприятий в случаях выявления больного (трупа), подозрительного на заболевания инфекционными болезнями, вызывающими чрезвычайные ситуации в области санитарно-эпидемиологического благополучия населения".
11. МУК 4.2.2494-09 "Организация молекулярно-генетических исследований биологического материала из природных очагов геморрагической лихорадки с почечным синдромом".
12. МУ 4.2.2039-05 "Техника сбора и транспортирования биоматериалов в микробиологические лаборатории".
13. МР 3.5.3.0299-22 "Дератизационные мероприятия в зимний период в очагах геморрагической лихорадки с почечным синдромом (ГЛПС).
14. MP 3.1.7.0250-21 "Тактика и объемы зоологических работ в природных очагах инфекционных болезней".
15. МР 3.1.0211-20 "Отлов, учет и прогноз численности мелких млекопитающих и птиц в природных очагах инфекционных болезней".
16. ГОСТ Р ЕН 12469 "Национальный стандарт Российской Федерации. Биотехнология. Технические требования к боксам микробиологической безопасности".
Библиографические ссылки
1. Бернштейн А.Д., Гавриловская И.Н., Апекина Н.С., Дзагурова Т.К., Ткаченко Е.А. Особенности природной очаговости хантавирусных зоонозов. Эпидемиология и вакцинопрофилактика, 2010. N 2. С. 5 - 13.
2. Дзагурова Т.К., Мурзабаева Р.Т., Кутлугужина Ф.Г., Морозов В.Г. и др. Значение экскретируемых с мочой антител в специфической диагностике геморрагической лихорадки с почечным синдромом. Инфекция и иммунитет. 2022. N 3 (12).
3. Дзагурова Т.К., Ткаченко Е.А., Петров В.А. Эффективность применения культуральных антигенов для серодиагностики ГЛПС с помощью метода иммунофлюоресценции. Вопросы вирусологии. 1988. N 1 (33). С. 71 - 75.
4. 4. Иванова А.В., Попов Н.В., Карнаухов И.Г., Чумачкова Е.А., Хантавирусные болезни: обзор эпидемиологической ситуации и эпидемиологических рисков в регионах мира. Проблемы особо опасных инфекций. 2021. N 1. С. 23 - 32.
5. Ивантер Э.В. Териология: Учебник. Петрозаводск: Издательство ПетрГУ, 2014. 703 с.
6. Карасева Е.В., Телицына А.Ю., Жигальский О.А. Методы изучения грызунов в полевых условиях. М.: Издательство ЛКИ, 2008. 416 с.
7. Коренберг Э.И. Пути совершенствования эпидемиологического надзора за природно-очаговыми инфекциями. Эпидемиология и вакцинопрофилактика. 2016. N 6 (91). С. 18 - 29.
8. Корзиков В.А., Алексеев С.К., Овсянникова Л.В., Силаева О.Л. и др. Структура населения и численность мелких млекопитающих в лесокустарниковых стациях на юге Нечерноземного центра в 2004 - 2014 годах. Пест-менеджмент. 2015. N 2 (94). С. 19 - 33.
9. Корзиков В.А., Васильева О.Л., Рогуленко А.В., Овсянникова Л.В. Структура населения мелких млекопитающих и их эпизоотическое значение в околоводных стациях на юге нечерноземного центра в 1993 - 2018 гг. Дезинфекционное дело. 2019. N 1 (107). С. 45 - 57.
10. Корнеев А.Г., Аминев Р.М., Скачков М.В. Опыт применение индекса эпидемической активности. Материалы XI Всероссийского съезда гигиенистов и санитарных врачей: сборник статей. Под редакцией Г.Г. Онищенко, А.И. Потапова. Москва, Ярославль. Издательство "Канцлер". 2012. С. 32 - 34.
11. Корнеев А.Г., Сергевнин В.И., Верещагин И.Н., Паньков А.С., Сайков Д.И. Численность и инфицированность хантавирусами мелких млекопитающих лесостепных и степных зон и влияние этих показателей на заболеваемость населения геморрагической лихорадкой с почечным синдромом. Здоровье семьи - 21 век. 2015. N 2. С. 47 - 57.
12. Котеров A.Н., Ушенкова Л.Н., Зубенкова Э.С., Калинина М.В. и др. Сила связи. Сообщение 2. Градации величины корреляции. Медицинская радиология и радиационная безопасность. 2019. N 6 (64). С. 12 - 24.
13. Лапан С.Н., Чубенко А.В., Бабич П.Н. Статистические методы в медико-биологических исследованиях с использованием Excel. Киев. Морион. 2000. 320 с.
14. Лисовский А.А., Шефтель Б.И., Савельев А.П., Ермаков О.А. и др. Млекопитающие России: список видов и прикладные аспекты. Сборник трудов Зоологического музея МГУ Том 56. Москва. Товарищество научных изданий КМК. 2019. 191 с.
15. Матросов А.Н., Кузнецов А.А., Иванова А.В., Ермаков Н.М. и др. Профилактика заболеваний населения геморрагической лихорадкой с почечным синдромом в Саратовской области. Дезинфекционное дело. 2020. N 4. С. 59 - 70.
16. Матросов А.Н., Тарасов М.А., Шилов М.М., Кузнецов А.А. и др. Опыт зимней полевой дератизации в очаге геморрагической лихорадки с почечным синдромом. Гигиена и санитария. 1999. N 2. С. 57 - 59.
17. Медицинская дезинфекция, дератизация, дезинсекция: руководство для врачей. 2-е издание, дополненное и переработанное. Под редакцией В.В. Шкарина, В.А. Рыльникова. Нижний Новгород. Издательство Нижегородской государственной медицинской академии. 2016. 596 с.
18. МР "Неспецифическая профилактика геморрагической лихорадки с почечным синдромом в Республике Башкортостан". Уфа. 2010.
19. Покровский В.И., Филатов Н.Н., Палтышев И.П. Описательное эпидемиологическое исследование. Москва. Санэпидмедиа. 2005. 240 с.
20. Попов Н.В., Топорков В.П., Сафронов В.А., Кузнецов А.А. и др. Современные направления снижения уровня заболеваемости природно-очаговыми инфекционными болезнями на территории Российской Федерации. Эпидемиология и инфекционные болезни. Актуальные вопросы. 2013. N 5. С. 15 - 17.
21. Руководство по эпидемиологии инфекционных болезней: Руководство. Н.И. Брико, Г.Г. Онищенко, В.И. Покровский, в 2 т. Т. 1. Москва. ООО "Издательство "Медицинское информационное агентство". 2019. 880 с.
22. Руководство по эпидемиологии инфекционных болезней: Руководство. Н.И. Брико, Г.Г. Онищенко, В.И. Покровский, в 2 т. Т. 2. Москва. ООО "Издательство "Медицинское информационное агентство". 2019. 768 с.
23. Рябов С.В., Попов Н.В., Левкин И.А., Мохирев Д.Ю. Совершенствование неспецифических профилактических мероприятий в природных очагах геморрагической лихорадки с почечным синдромом в Российской Федерации. Современные вопросы дезинфектологии. Москва. 2018. С. 309 - 331.
24. Савилов Е.Д., Мамонтова Л.М., Астафьев В.А., Жданова С.Н. Применение статистических методов в эпидемиологическом анализе. Москва. МЕДпресс-информ. 2004. 112 с.
25. Савицкая Т.А., Иванова А.В., Исаева Г.Ш., Решетникова И.Д. и др. Обзор хантавирусных инфекций в мире, эпидемиологической ситуации по геморрагической лихорадке с почечным синдромом в Российской Федерации в 2020 году и прогноз на 2021 год. Проблемы особо опасных инфекций. 2021. N 2. С. 62 - 70.
26. Савицкая Т.А., Иванова А.И., Исаева Г.Ш., Решетникова И.Д., Трифонов В.А., Зиатдинов В.Б., Серова И.В., Сафронов В.А. Оценка эпидемиологической ситуации по лихорадке с почечным синдромом в мире и России, прогноз на 2020 г. Проблемы особо опасных инфекций. 2020. N 2. С. 62 - 70.
27. Скударева О.Н. Организация мероприятий по совершенствованию эпидемиологического надзора по ГЛПС. Дезинфекционное дело. 2007. N 4. С. 36 - 38.
28. Снедекор Дж.У. Статистические методы в применении к исследованиям в сельском хозяйстве и биологии. Москва. Сельхозиздат. 1961. 503 с.
29. Ткаченко Е.А., Бернштейн А.Д., Дзагурова Т.К., Транквилевский Д.В. и др. Сравнительный анализ эпидемических вспышек геморрагической лихорадки с почечным синдромом, вызванных вирусами Пуумала и Добрава/Белград. Эпидемиология и вакцинопрофилактика. 2005. N 4. С. 28 - 34.
30. Ткаченко Е.А., Окулова И.М., Юничева Ю.В., Дзагурова Т.К. и др. Эпизоотологические и вирусологические особенности природного очага хантавирусной инфекции в субтропической зоне Краснодарского края. Вопросы вирусологии. 2005. N 3 (50). С. 14 - 19.
31. Ткаченко Е.А., Бернштейн А.Д., Дзагурова Т.К., Коротина Н.А. Актуальные проблемы современного этапа изучения ГЛПС в России. Дезинфекционное дело. 2007. N 4. С. 26 - 33.
32. Ткаченко Е.А., Дзагурова Т.К., Юничева Ю.В. и др. Особенности геморрагической лихорадки с почечным синдромом, вызываемой генетическими подтипами вируса Добрава/Белград в России. Тихоокеанский Медицинский Журнал. 2008. N 2. С. 10 - 14.
33. Ткаченко Е.А. Актуальные проблемы современного этапа изучения ГЛПС в России. Дальневосточный журнал инфекционной патологии. 2008. N 13. С. 185 - 186.
34. Ткаченко Е.А., Дзагурова Т.К., Бернштейн А.Д., Транквилевский Д.В. и др. Геморрагическая лихорадка с почечным синдромом в России - проблема XXI века. Вестник Российской академии естественных наук. 2012. N 1. С. 48 - 54.
35. Ткаченко Е.А., Бернштейн А.Д., Дзагурова Т.К., Транквилевский Д.В. и др. Актуальные проблемы современного этапа изучения геморрагической лихорадки с почечным синдромом в России. Журнал Микробиологии Эпидемиологии и Иммунобиологии. 2013. N 1. С. 51 - 58.
36. Tkachenko Е.A., Witkowski Р.Т., Dzagurova Т.К. и др. Adler hantavirus, a new genetic variant of Tula virus identified in Major′s pine voles (Microtus majori) sampled in southern European Russia. Infection, Genetics and. Evolution. 2015. V. 29. P. 156 - 163.
37. Ткаченко E.А., Дзагурова T.K., Бернштейн А.Д., Транквилевский Д.В. и др. Геморрагическая лихорадка с почечным синдромом (прошлое и настоящее). Медицинская вирусология. Труды Института полиомиелита и вирусных энцефалитов им. М.П. Чумакова. 2016. N 2 (29). С. 33 - 53.
38. Ткаченко Е.А., Морозов В.Г., Дзагурова Т.К., Городин В.Н. и др. Этиологические и клинико-эпидемиологические особенности геморрагической лихорадки с почечным синдромом в Краснодарском крае. Эпидемиология и инфекционные болезни. 2016. N 1 (21). С. 22 - 30.
39. Ткаченко Е.А., Дзагурова Т.К., Бернштейн А.Д., Транквилевский Д.В. и др. Геморрагическая лихорадка с почечным синдромом (история, проблемы и перспективы изучения). Эпидемиология и вакцинопрофилактика. 2016. N 3 (15). С. 23 - 34.
40. Ткаченко Е.А., Дзагурова Т.К., Ишмухаметов А.А. Геморрагическая лихорадка с почечным синдромом в России: успехи и актуальные проблемы на современном этапе. Биомедицина XXI века: достижения и перспективные направления развития. Сборник научных трудов Российской Академии Естественных Наук. 2016. С. 331 - 346.
41. Ткаченко Е.А., Ишмухаметов А.А. История изучения этиологии геморрагической лихорадки почечным синдромом. Медицинский Совет. 2017. N 4. С. 86 - 92.
42. Tkachenko Е.A., Ishmukhametov A.A., Dzagurova Т.К., Bemshtein A.D. et al. Hemorrhagic Fever with Renal Syndrome: current status in Russia. Emerging Infectious Diseases Journal. 2019. V. 25. N 12. P. 2325 - 2328.
43. Транквилевский Д.В. Об инфицированности мелких млекопитающих возбудителями зоонозов в Российской Федерации. Здоровье населения и среда обитания. 2016. N 10 (283). С. 53 - 56.
44. Транквилевский Д.В., Бахметьева Ю.О., Дзагурова Т.К., Чубирко М.И., Ткаченко Е.А. Об активности, очагов геморрагической лихорадки с почечным синдромом в Воронежской области и прогнозировании заболеваемости этой инфекцией перед последней вспышкой 2006 года. Здоровье населения и среда обитания. 2012. N 5 (230). С. 35 - 38.
45. Транквилевский Д.В., Квасов Д.А., Мещерякова И.С., Михайлова Т.В. и др. Вопросы организации мониторинга природных очагов инфекций опасных для человека. Планирование, проведение и анализ результатов полевых наблюдений. Здоровье населения и среда обитания, 2014. N 8 (257). С. 38 - 43.
46. Транквилевский Д.В., Квасов Д.А., Ромашова И.Б., Ромашов Б.В. и др. Вопросы профилактики природно-очаговых инфекций в условиях развития экотуризма центрального Черноземья. Здоровье населения и среда обитания. 2013. N 7 (244). С. 27 - 30.
47. Транквилевский Д.В., Квасов Д.А., Сурков А.В., Кутузов А.В., Жуков В.И. Анализ структуры населения мелких млекопитающих в закрытых луго-полевых стациях Окско-Донской низменной равнины и Среднерусской возвышенности. Здоровье населения и среда обитания. 2013. N 5 (242). С. 36 - 39.
48. Транквилевский Д.В., Малкин Г.А., Мутных Е.С., Квасов Д.А. и др. О численности и инфицированности хантавирусами мелких млекопитающих в сельских населенных пунктах и роли, дератизационных мероприятий во время зимней вспышки геморрагической лихорадки с почечным синдромом в Центральном Черноземье. Дезинфекционное дело. 2015. N 1. С. 39 - 48.
49. Транквилевский Д.В., Царенко В.А., Жуков В.И. Современное состояние эпизоотологического мониторинга за природными очагами инфекций в Российской Федерации. Медицинская паразитология и паразитарные болезни. 2016. N 2. С. 19 - 24.
50. Трифонов В.А., Давидюк Ю.Н., Исаева Г.Ш., Решетникова И.Д. и др. Изучение инфицированности рыжей полёвки вирусом Puumala в природных очагах ГЛПС Татарстана. Дневник казанской медицинской школы. 2018. N 4 (22). С. 36 - 40.
51. Управление численностью проблемных биологических видов. Учебное пособие. Под ред. В.А. Рыльникова. В 3-х томах. Т. 3. Дератизация. Москва. Институт пест-менеджмента. 2011. 220 с.
52. Шестопалов Н.В. Задачи дезинфекции, дезинсекции и дератизации в обеспечении санитарно-эпидемиологического благополучия человека. Дезинфекционное дело. 2004. N 4. С. 20 - 24.
53. Шефтель Б.И. Методы учета численности мелких млекопитающих. Russian journal of ecosystem ecology. 2018. N 3 (3). С. 1 - 21.
54. Якименко В.В., Гаранина С.Б., Малькова М.Г., Балицкая А.В. и др. Итоги изучения хантавирусов в Западной Сибири. Тихоокеанский медицинский журнал. 2008. N 2. С. 20 - 26.
55. Яшина Л.И., Данчинова Г.А., Серегин С.В., Хаснатинов М.А., Янагихара Р. Генетическая идентификация хантавируса Хоккайдо (HOKV), циркулирующего среди М. rufocanus на территории Прибайкалья. Бюллетень ВСНЦ СО РАМН. 2013. N 4 (92). С. 147 - 152.
56. Emmanuel Kabwe, Yuriy Davidyuk, Anton Shamsutdinov, Ekaterina Garanina, Ekaterina Martynova, Kristina Kitaeva, Moffat Malisheni, Guzel Isaeva, Tatiana Savitskaya, Richard Urbanowicz, Sergey Morzunov, Cyprian Katongo, Albert Rizvanov and Svetlana Khaiboullina. Orthohantaviruses, Emerging Zoonotic Pathogens. Pathogens. 2020. Vol. 9. Is. 9. P. 1 - 21.
57. Yuriy Davidyuk, Anton Shamsutdinov, Emmanuel Kabwe, Ruzilya Ismagilova, Ekaterina Martynova, Alexander Belyaev, Eduard Shuralev, Vladimir Trifonov, Tatiana Savitskaya, Guzel Isaeva, Svetlana Khaiboullina, Albert Rizvanov and Sergey Morzunov. Prevalence of the Puumala orthohantavirus Strains in the Pre - Kama Area of the Republic of Tatarstan. Russia. Pathogens. 2020. Vol. 9. Art. N 540. P. 1 - 17.
Обзор документа
Заново урегулированы вопросы организации и обеспечения эпидемиологического надзора, лабораторной диагностики и профилактики геморрагической лихорадки с почечным синдромом.
Эпиднадзор включает сбор и анализ эпидемических данных, оценку эпидемической и эпизоотической ситуации, проведение районирования территории, прогнозирование обстановки и контроль эффективности проводимых мероприятий. Предусмотрен эпизоотологический мониторинг.



(1).jpg)


