Приказ Министерства здравоохранения РФ от 19 июля 2021 г. N 787 "Об утверждении фармакопейной статьи"
В соответствии со статьей 7 Федерального закона от 12 апреля 2010 г. N 61-ФЗ "Об обращении лекарственных средств" (Собрание законодательства Российской Федерации, 2010, N 16, ст. 1815; 2014, N 52, ст. 7540) приказываю:
1. Утвердить прилагаемую фармакопейную статью ФС.3.3.2.0016.21 "Иммуноглобулин человека против COVID-19, раствор для внутривенного введения Immunoglobulinum humanum contra COVID-19, solutio pro injectione intravenosa" и ввести ее в действие с 19 июля 2021 года.
2. Установить, что фармакопейная статья, утвержденная настоящим приказом, составляет приложения к Государственной фармакопее XIV издания.
3. Установить, что до 1 января 2022 года нормативная документация на зарегистрированный лекарственный препарат для медицинского применения и входящую в его состав фармацевтическую субстанцию подлежит приведению в соответствие с фармакопейной статьей, утвержденной настоящим приказом.
| Министр | М.А. Мурашко |
Приложение
к приказу Министерства здравоохранения
Российской Федерации
от 19 июля 2021 г. N 787
Министерство здравоохранения Российской Федерации
Фармакопейная статья
| Иммуноглобулин человека против COVID-19, раствор для внутривенного введения | ФС.3.3.2.0016.21 |
|---|---|
| Immunoglobulinum humanum contra COVID-19, solutio pro injectione intravenosa | Вводится впервые |
Настоящая фармакопейная статья распространяется на лекарственный препарат иммуноглобулина человека против COVID-19, раствор для внутривенного введения.
Препарат должен соответствовать требованиям ОФС "Лекарственные формы для парентерального применения", ОФС "Иммуноглобулины человека" и нижеприведённым требованиям.
Действующим веществом препарата являются иммуноглобулины класса G, обладающие активностью антител к SARS-CoV-2.
Препарат содержит:
не менее 95% иммуноглобулина класса G, обладающего активностью антител к SARS-CoV-2;
не менее 160 АКЕ от заявленной активности антител к SARS-CoV-2 в ИФА;
не менее 85,0% и не более 115,0% от заявленного количества глицина.
Препарат не содержит консервантов и антибиотиков.
Производство
Для производства иммуноглобулина человека против COVID-19 для внутривенного введения используется:
- карантинизированная плазма крови доноров, содержащая антитела IgG, нейтрализующие вирус SARS-CoV-2, соответствующая требованиям ФС "Плазма человека для фракционирования";
- некарантинизированная плазма крови доноров, содержащая антитела IgG, нейтрализующие вирус SARS-CoV-2, и соответствующая по показателям качества ФС "Плазма человека для фракционирования", при условии наличия в технологическом процессе производства не менее 4 валидированных стадий удаления и инактивации оболочечных и безоболочечных вирусов. Используется в случаях, обусловленных сложной эпидемической ситуацией, связанной c COVID-19;
- патогенредуцированная плазма крови доноров, содержащая антитела IgG к вирусу SARS-CoV-2, соответствующая по показателям качества ФС "Плазма человека для фракционирования". Используется в случаях, обусловленных сложной эпидемической ситуацией, связанной с COVID-19.
Технологический процесс производства препарата иммуноглобулина человека против COVID-19 включает процедуры инактивации и/или удаления вирусов: фракционирование этанолом на холоду, обработку сольвент/детергентной смесью, выдерживание при рН 4,0-4,5 и температуре 37°С в течение 48 часов, хроматографическую очистку, противовирусную фильтрацию (через фильтр с размером пор 20 нм).
Каждая серия иммуноглобулина производится из пула плазмы доноров, содержащих антитела против SARS-CoV-2, индивидуально проверенных на отсутствие поверхностного антигена вируса гепатита В (HBsAg), антител к вирусу гепатита С, антител к вирусу иммунодефицита человека ВИЧ-1 и ВИЧ-2 и антигена р24 ВИЧ-1, антител к возбудителю сифилиса (Treponema pallidum). Плазма доноров, объединенная в минипулы и производственный пул, дополнительно проверяется на отсутствие РНК вируса гепатита С, РНК вируса иммунодефицита человека и ДНК вируса гепатита В методом полимеразной цепной реакции (ПЦР). В производстве используется плазма только с отрицательными результатами тестирования.
Производство иммуноглобулина человека против COVID-19 для внутривенного введения должно осуществляться с соблюдением требований, указанных в ОФС "Иммуноглобулины человека", ФС "Иммуноглобулин человека нормальный для внутривенного введения" и ОФС "Вирусная безопасность лекарственных препаратов, полученных из плазмы крови человека".
Испытания
Описание. Прозрачный или слегка опалесцирующий, бесцветный или светло-желтый раствор.
Подлинность.
Видоспецифичность
Видоспецифичность подтверждается наличием линии преципитации только с сывороткой против белков сыворотки крови человека. Испытание проводят в соответствии с ОФС "Иммуноэлектрофорезом в агаровом геле". Допустимо проведение испытания методом иммунодиффузии в геле в соответствии с ОФС "Иммунодиффузия в геле".
Наличие специфической активности
Определение антител к SARS-CoV-2 проводят методом ИФА с использованием зарегистрированных наборов реагентов для определения иммуноглобулинов класса G к антигену SARS-CoV-2 (см. раздел специфическая активность).
Прозрачность. Оптическая плотность не более 0,05. Определение проводят в соответствии с требованиями ОФС "Прозрачность и степень мутности" спектрофотометрическим методом в кюветах с толщиной слоя 3 мм при длине волны 540 нм относительно воды.
Цветность. Оптическая плотность не более 0,05. Определение проводят в соответствии с требованиями ОФС "Степень окраски жидкостей" спектрофотометрическим методом в кюветах с толщиной слоя 3 мм при длине волны 440 нм относительно воды.
рН. От 4,5 до 5,5. Испытуемый образец разводят до 1% концентрации раствором натрия хлорида 0,9%. Испытание проводят потенциометрическим методом в соответствии с требованиями ОФС "Ионометрия".
Механические включения. Видимые механические включения: должны соответствовать требованиям ОФС "Видимые механические включения в лекарственных формах для парентерального применения и глазных лекарственных формах".
Извлекаемый объем. Не менее номинального. Определение проводят в соответствии с требованиями ОФС "Извлекаемый объем лекарственных форм для парентерального применения".
Термостабильность. Препарат должен оставаться жидким и не образовывать геля после выдерживания в водяной бане или водяном термостате при температуре 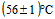 в течение 4 ч.
в течение 4 ч.
Электрофоретическая однородность. Основная фракция иммуноглобулинов IgG должна составлять не менее 95% от общего белка. Испытание проводят в соответствии с требованиями ОФС "Определение однородности лекарственных препаратов из сыворотки крови человека и животных методом электрофореза на пленках из ацетата целлюлозы".
Молекулярные параметры. Содержание мономеров и димеров иммуноглобулина G должно быть не менее 90%, полимеров и агрегатов - не более 3%. Определение проводят методом эксклюзионной высокоэффективной жидкостной хроматографии в соответствии с требованиями ОФС "Определение молекулярных параметров иммуноглобулинов методом ВЭЖХ".
Подвижная фаза (ПФ). Фосфатный буферный раствор с рН 7,0.
Испытуемый раствор. Препарат разводят фосфатным буферным раствором до концентрации белка 2 мг/мл.
Раствор стандартного образца. Иммуноглобулин человеческий BRP или соответствующий стандартный образец иммуноглобулина человека нормального, аттестованный относительно иммуноглобулина человеческого BRP. К 0,1 мл СО иммуноглобулина добавляют 4,9 мл фосфатного буферного раствора, перемешивают.
Хроматографические условия
| Колонка | 300х7,8 мм, силикагель гидрофильный модифицированный для разделения иммуноглобулинов, средних и крупных белков, 5 мкм; |
|---|---|
| Температура колонки | 25°С; |
| Температура образца | 15-25°С; |
| Скорость потока | 0,6 мл/мин; |
| Детектор | спектрофотометрический, 280 нм; |
| Объём пробы | 20 мкл; |
| Время хроматографирования | 30 мин. |
В хроматограф вводят раздельно по 20 мкл испытуемого раствора и раствора стандартного образца.
Ориентировочное время удерживания пика мономера соответствует времени удерживания пика мономера на хроматограмме раствора сравнения.
Сумма площадей пиков мономера и димера должна быть не менее 90,0% от суммы площадей всех пиков на хроматограмме,
- полимеров и агрегатов - не более 3,0%;
- не учитывают пики, площади которых составляют 0,05% и менее от площади пика мономера на хроматограмме испытуемого раствора.
Пригодность хроматографической системы:
- относительное стандартное отклонение площадей всех пиков на хроматограмме, полимеров и агрегатов должно быть не более 3,0%.
- эффективность хроматографической колонки, рассчитанная по пику мономера должна быть не менее 1500 теоретических тарелок;
- разрешение 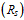 между пиками мономера и димера должно быть не менее 1.
между пиками мономера и димера должно быть не менее 1.
Расчет содержания молекулярных параметров в процентах проводят методом внутренней нормализации, используя программное обеспечение хроматографа.
Осмолярность. Не менее 240 мОсм/кг. Определение проводят криоскопическим методом в соответствии с требованиями ОФС "Осмолярность".
Белок. От 8,0 до 12,0% (от 80 до 120 мг/мл). Определение проводят колориметрическим методом с биуретовым реактивом в соответствии с ОФС "Количественное определение белка колориметрическим методом с биуретовым реактивом в препаратах крови человека и животных" (метод А).
Фракционный состав. На электрофореграмме испытуемого препарата должна выявляться интенсивная линия преципитации IgG и не более четырех дополнительных линий. Испытуемый образец разводят до 1% концентрации 0,9% раствором натрия хлорида. Определение проводят методом иммуноэлектрофореза в геле с использованием сыворотки против белков сыворотки крови человека в соответствии с ОФС "Иммуноэлектрофорез в агаровом геле".
Содержание иммуноглобулина А. Не более 1,0 мг/мл. Определение проводят методом радиальной иммунодифузии в геле (РИД) по Манчини в соответствии с ОФС "Количественное определение содержания иммуноглобулинов классов G, М и А в препаратах иммуноглобулина человека".
Аномальная токсичность. Препарат должен быть нетоксичным. Определение проводят в соответствии с ОФС "Аномальная токсичность". Двум морским свинкам массой 250-300 г вводят внутрибрюшинно по 5,0 мл препарата, пяти здоровым белым мышам массой 18-20 г по 0,5 мл препарата внутривенно. Период наблюдения за животными составляет 7 сут.
Пирогенность. Препарат должен быть апирогенным. Испытание проводят в соответствии с требованиями ОФС "Пирогенность".
Препарат вводят в дозе 500 мг/кг массы тела кролика в объеме не более 10 мл на 1 кг массы тела животного.
Стерильность. Препарат должен быть стерильным. Определение проводят в соответствии с требованиями ОФС "Стерильность".
Вирусная безопасность.
Поверхностный антиген вируса гепатита В (HBsAg). Препарат не должен содержать поверхностного антигена вируса гепатита В. Определение проводят иммуноферментным методом с использованием тест-систем, разрешенных к применению в практике здравоохранения России и имеющих чувствительность не ниже 0,1 МЕ/мл в соответствии с инструкциями по применению.
Антитела к вирусу гепатита С. Антитела к вирусу гепатита С должны отсутствовать. Определение проводят иммуноферментным методом с использованием тест-систем, разрешенных к применению в практике здравоохранения России и имеющих 100% чувствительность и специфичность в соответствии с инструкциями по применению.
Антитела к вирусу иммунодефицита человека (ВИЧ-1 и ВИЧ-2) и антиген р24 ВИЧ-1. Препарат не должен содержать антител к вирусу иммунодефицита человека (ВИЧ-1 и ВИЧ-2) и антиген р24 ВИЧ-1. Определение проводят иммуноферментным методом с использованием тест-систем, разрешенных к применению в практике здравоохранения России и имеющих 100% чувствительность и специфичность в соответствии с инструкциями по применению.
Специфическая безопасность.
Антикомплементарная активность. 1 мг белка иммуноглобулина должен связывать не более 1 ед. (СН50/мг белка) комплемента. Определение проводят в соответствии с ОФС "Определение антикомплементарной активности в лекарственных препаратах иммуноглобулинов человека для внутривенного введения".
Анти-А и анти-В гемагглютинины. Агглютинация должна отсутствовать в разведении препарата 1:64. Испытания проводят в соответствии с ОФС "Определение анти-А и анти-В гемагглютининов в лекарственных препаратах иммуноглобулинов человека".
Анти-D антитела. Содержание анти-D антител в препарате должно быть не более, чем в положительном стандартном образце. Испытания проводят в соответствии с ОФС "Испытание на анти-D антитела в лекарственных препаратах иммуноглобулинов человека".
Специфическая активность. Содержание антител IgG к вирусу SARS-CoV-2 должно быть не менее 160 АКЕ/мл. Антиковидная единица (АКЕ) - единица активности препарата иммуноглобулина человека против COVID-19. За 1 единицу АКЕ иммуноглобулина принимается величина, обратная его разведению, обладающему способностью ингибировать появление на монослое культуры клеток Vero цитопатогенного действия (ЦПД) SARS-CoV-2 в 2 из 3 лунок в реакции нейтрализации против 2,0 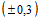 lg ТЦД50 (БОЕ) SARS-CoV-2.
lg ТЦД50 (БОЕ) SARS-CoV-2.
Определение проводят методом непрямого варианта твердофазного ИФА по отношению к соответствующему стандартному образцу (СОП) в соответствии с инструкциями по применению зарегистрированных в Российской Федерации тест-систем для выявления IgG к SARS-CoV-2, для которых экспериментально установлена корреляция между результатами определения содержания антител в плазме с вируснейтрализующей активностью, определенной в тесте с использованием пермиссивной культуры клеток.
Количественное определение
Стабилизаторы:
Глицин. Определение проводят методом формольного титрования с потенциометрическим определение конечной точки.
Метод формольного титрования (метод Серенсена).
К точной навеске или точному объему испытуемого образца прибавляют воду до объема 20 мл. При необходимости раствор нейтрализуют потенциометрически до рН 7,0, путем прибавления натрия гидроксида раствора 0,1 М или хлористоводородной кислоты раствора 0,1 М. По окончании нейтрализации прибавляют от 2 до 10 мл формальдегида раствора 35%, нейтрализованного в день анализа натрия гидроксида раствором 10% до рН 7,0, перемешивают и титруют натрия гидроксида раствором 0,1.
Параллельно проводят контрольный опыт.
1 мл натрия гидроксида раствора 0,1 М соответствует 1,4 мг аминного азота.
Испытуемый раствор. Препарат разводят в 4 раза (3 мл препарата помещают в пробирку, прибавляют 9 мл воды и перемешивают). Затем 8 мл полученного раствора переносят в химический стакан вместимостью 50 мл, добавляют 7 мл воды, 5 мл трихлоруксусной кислоты раствора 20% (все операции проводят стеклянной пипеткой). Полученный раствор тщательно перемешивают стеклянной палочкой и фильтруют через бумажный фильтр (синяя лента).
Проведение анализа.
Отбирают 10 мл фильтрата стеклянной пипеткой и помещают в химический стакан вместимостью 50 мл, прибавляют 7 мл воды, перемешивают на магнитной мешалке. Измеряют рН полученного раствора, и, при необходимости, доводят рН раствора до 7,0 добавлением при постоянном перемешивании натрия гидроксида раствора 1 М (около 2,5 мл) и корректируют 0,1 М раствором хлористоводородной кислоты.
Не вынимая электродов из испытуемого раствора и не выключая магнитную мешалку, добавляют 10 мл формалина (рН 7,0) и титруют из бюретки при постоянном перемешивании 0,1 М раствором натрия гидроксида до установления рН 7,6. Вблизи точки эквивалентности титрованный раствор прибавляют по 0,05 мл и после каждого прибавления измеряют рН.
Содержание глицина (X) в мг/мл в препарате вычисляют по формуле:
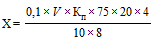 ,
,
где
0,1 - молярность раствора натрия гидроксида;
V - объем 0,1 М раствора натрия гидроксида, израсходованного на титрование, мл;
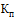 - поправочный коэффициент к молярности 0,1 М раствора натрия гидроксида;
- поправочный коэффициент к молярности 0,1 М раствора натрия гидроксида;
75 - молярная масса глицина, г/моль;
20 - общий объем смеси (8 мл раствора иммуноглобулина, 7 мл воды и 5 мл кислоты трихлоруксусной 20%), мл;
10 - объем фильтрата, мл;
8 - объем раствора иммуноглобулина, взятого на осаждение, мл;
4 - разведение препарата.
За результат принимают среднее значение двух определений.
Три-н-бутилфосфат (ТБФ). Не более 1 мкг/мл. Определение проводят методом газовой хроматографии в соответствии с требованиями ОФС "Газовая хроматография" на стадии производственного контроля.
Полисорбат-80. Не более 5 мкг/мл. Определение проводят методом газовой хроматографии в соответствии с требованиями ОФС "Газовая хроматография" на стадии производственного контроля.
Хранение. При температуре от 2 до 8°С в соответствии с требованиями ОФС "Хранение лекарственных средств". Замораживание не допускается.
Обзор документа
Минздрав утвердил фармакопейную статью ФС.3.3.2.0016.21 "Иммуноглобулин человека против COVID-19, раствор для внутривенного введения Immunoglobulinum humanum contra COVID-19, solutio pro injectione intravenosa". Она введена в действие с 19 июля 2021 г.
До 1 января 2022 г. нормативная документация на зарегистрированный лекарственный препарат и входящую в его состав фармацевтическую субстанцию должна быть приведена в соответствие с фармакопейной статьей.



(1).jpg)


