Постановление Правительства Российской Федерации от 30 мая 2025 г. № 805 “Об утверждении методики расчета предельных отпускных цен производителей на лекарственные препараты, включенные в перечень жизненно необходимых и важнейших лекарственных препаратов для медицинского применения”
В соответствии со статьей 60 Федерального закона "Об обращении лекарственных средств" Правительство Российской Федерации постановляет:
1. Утвердить прилагаемую методику расчета предельных отпускных цен производителей на лекарственные препараты, включенные в перечень жизненно необходимых и важнейших лекарственных препаратов для медицинского применения.
2. Настоящее постановление вступает в силу с 1 сентября 2025 г. и действует до 1 сентября 2031 г.
|
Председатель Правительства Российской Федерации |
М. Мишустин |
УТВЕРЖДЕНА
постановлением Правительства
Российской Федерации
от 30 мая 2025 г. № 805
Методика
расчета предельных отпускных цен производителей на лекарственные препараты, включенные в перечень жизненно необходимых и важнейших лекарственных препаратов для медицинского применения
I. Общие положения
1. Настоящая методика устанавливает порядок расчета предельных отпускных цен производителей лекарственных препаратов (далее - производители) на лекарственные препараты, включенные в перечень жизненно необходимых и важнейших лекарственных препаратов для медицинского применения (далее - лекарственные препараты), при их государственной регистрации и перерегистрации.
2. Предельная отпускная цена на лекарственный препарат устанавливается для каждого производителя в рамках регистрационного удостоверения лекарственного препарата в соответствии с требованиями пунктов 27 и 28 Правил государственной регистрации и перерегистрации предельных отпускных цен производителей на лекарственные препараты, включенные в перечень жизненно необходимых и важнейших лекарственных препаратов для медицинского применения, утвержденных постановлением Правительства Российской Федерации от 8 апреля 2025 г. № 462 "О государственном регулировании цен на лекарственные препараты, включенные в перечень жизненно необходимых и важнейших лекарственных препаратов для медицинского применения" (далее - Правила), на основании данных, рассчитанных в соответствии с настоящей методикой.
3. Предлагаемая к государственной регистрации предельная отпускная цена на лекарственный препарат для всех производителей без учета формы выпуска лекарственного препарата, за исключением случаев, предусмотренных пунктами 28 и 32 Правил, не может превышать:
а) в случае если в рамках одного регистрационного удостоверения лекарственного препарата зарегистрированы предельные отпускные цены на лекарственный препарат с такой же лекарственной формой и дозировкой (концентрацией, активностью в единицах действия), - стоимость одной лекарственной формы лекарственного препарата, умноженную на количество лекарственного препарата во вторичной (потребительской) упаковке заявляемого лекарственного препарата, на основании сведений о наличии зарегистрированных предельных отпускных цен заявляемого лекарственного препарата согласно приложению № 1, при этом стоимость одной лекарственной формы лекарственного препарата рассчитывается исходя из среднего арифметического значения последних зарегистрированных цен на ближайшие по значению количества заявляемого лекарственного препарата во вторичной (потребительской) упаковке;
б) в случае если не зарегистрированы предельные отпускные цены на заявляемый лекарственный препарат с такой же дозировкой (концентрацией, активностью в единицах действия), - стоимость единицы действующего вещества лекарственного препарата, умноженную на количество единиц действующего вещества заявляемого лекарственного препарата, на основании сведений о наличии зарегистрированных предельных отпускных цен заявляемого лекарственного препарата, предусмотренных приложением № 1 к настоящей методике, при этом стоимость единицы действующего вещества лекарственного препарата рассчитывается исходя из среднего арифметического значения последних зарегистрированных цен на ближайшие по значению дозировки (концентрации, активности в единицах действия) заявляемого лекарственного препарата.
4. Предлагаемая к государственной регистрации предельная отпускная цена производителя на лекарственный препарат не может превышать:
а) средневзвешенную фактическую отпускную цену на лекарственный препарат за отчетный период, предусмотренный пунктом 26 Правил, рассчитанную в соответствии с разделом IV настоящей методики на основании сведений об объемах и отпускных ценах находящихся в обращении в Российской Федерации лекарственных препаратов производителя государства - члена Евразийского экономического союза и лекарственных препаратов иностранного производства, первичная и (или) вторичная упаковка которых осуществляется или первичную и (или) вторичную упаковку которых планируется осуществлять в Российской Федерации, согласно приложению № 2;
б) средневзвешенную фактическую цену ввоза лекарственного препарата за отчетный период, предусмотренный пунктом 26 Правил, с учетом расходов по уплате таможенных сборов за совершение таможенных операций, связанных с выпуском товаров, рассчитанную в соответствии с разделом VI настоящей методики на основании сведений из системы мониторинга движения лекарственных препаратов для медицинского применения об объемах и о ценах ввоза лекарственного препарата иностранного производства, находящегося в обращении на территории Российской Федерации, за отчетный период, предусмотренный пунктом 26 Правил;
в) в случае если лекарственный препарат иностранного производства или производителя государства - члена Евразийского экономического союза реализуется в иностранных государствах, в отношении которых представляется информация об уровне минимальных отпускных цен на лекарственные препараты, по перечню согласно приложению № 3, - минимальную отпускную цену производителя (без учета производственных площадок) на лекарственный препарат в указанных иностранных государствах и в стране производителя, рассчитанную в соответствии с разделом VII настоящей методики на основании расчета предельной отпускной цены производителя на лекарственный препарат, представляемой на государственную регистрацию (перерегистрацию), согласно приложению № 4 с учетом расходов по уплате таможенных сборов за совершение таможенных операций, связанных с выпуском товаров.
II. Расчет предельной отпускной цены на референтный лекарственный препарат при ее государственной регистрации
5. При государственной регистрации предельная отпускная цена на референтный лекарственный препарат для всех производителей в рамках регистрационного удостоверения лекарственного препарата с учетом требований пункта 27 Правил не может превышать уровень минимальной из цен, рассчитанных с учетом требований пунктов 3 - 4 настоящей методики.
6. В случае если по состоянию на дату представления заявления о государственной регистрации предельной отпускной цены производителя на референтный лекарственный препарат в Министерство здравоохранения Российской Федерации в рамках международного непатентованного (при его отсутствии - группировочного или химического) наименования (далее - международное непатентованное наименование) и лекарственной формы зарегистрированы предельные отпускные цены производителей на соответствующие воспроизведенные, биоаналоговые (биоподобные) лекарственные препараты, при этом предельная отпускная цена производителя на референтный лекарственный препарат не зарегистрирована, предлагаемая к государственной регистрации предельная отпускная цена на референтный лекарственный препарат не может превышать максимальную зарегистрированную предельную отпускную цену на соответствующий воспроизведенный, биоаналоговый (биоподобный) лекарственный препарат.
7. В случае если по состоянию на дату представления заявления о государственной регистрации предельной отпускной цены производителя на референтный лекарственный препарат в Министерство здравоохранения Российской Федерации в рамках международного непатентованного наименования и лекарственной формы не зарегистрированы предельные отпускные цены производителей на соответствующие воспроизведенные, биоаналоговые (биоподобные) лекарственные препараты и на референтный лекарственный препарат, предлагаемая к государственной регистрации предельная отпускная цена на референтный лекарственный препарат не может превышать максимальную из зарегистрированных предельных отпускных цен на эквивалентную лекарственную форму лекарственного препарата в рамках данного международного непатентованного наименования, содержащегося в перечне жизненно необходимых и важнейших лекарственных препаратов для медицинского применения, в том числе исключенных из государственного реестра предельных отпускных цен производителей на лекарственные препараты, включенные в перечень жизненно необходимых и важнейших лекарственных препаратов для медицинского применения.
III. Расчет предельной отпускной цены на воспроизведенный, биоаналоговый (биоподобный) лекарственный препарат при ее государственной регистрации
8. Предельная отпускная цена на воспроизведенный, биоаналоговый (биоподобный) лекарственный препарат устанавливается для каждого производителя в рамках регистрационного удостоверения лекарственного препарата в соответствии с требованиями пунктов 27 и 28 Правил на основании данных, рассчитанных в соответствии с настоящей методикой для лекарственных препаратов производителя государства - члена Евразийского экономического союза и (или) лекарственных препаратов иностранного производства.
9. Предлагаемая к государственной регистрации предельная отпускная цена на воспроизведенный, биоаналоговый (биоподобный) лекарственный препарат не может превышать отпускную цену, рассчитанную с учетом требований пунктов 29-31 Правил и в соответствии с настоящим разделом на основании данных расчета предельной отпускной цены на воспроизведенный, биоаналоговый (биоподобный) лекарственный препарат, представляемой на государственную регистрацию, согласно приложению № 5.
10. При государственной регистрации предельная отпускная цена на воспроизведенный, биоаналоговый (биоподобный) лекарственный препарат для всех производителей государств - членов Евразийского экономического союза в рамках регистрационного удостоверения лекарственного препарата с учетом требований пункта 27 Правил не может превышать уровень минимальной из цен, рассчитанных с учетом требований пунктов 3, 4 и 9 настоящей методики.
При государственной регистрации предельная отпускная цена на воспроизведенный, биоаналоговый (биоподобный) лекарственный препарат для всех иностранных производителей, в том числе осуществляющих или планирующих осуществлять первичную и (или) вторичную упаковку лекарственного препарата в Российской Федерации, в рамках регистрационного удостоверения лекарственного препарата с учетом требований пункта 27 Правил не может превышать уровень минимальной из цен, рассчитанных с учетом требований пунктов 3, 4 и 9 настоящей методики.
11. При государственной регистрации предельной отпускной цены производителя на воспроизведенный, биоаналоговый (биоподобный) лекарственный препарат в случае, если в рамках международного непатентованного наименования и лекарственной формы не зарегистрирована предельная отпускная цена на соответствующий референтный лекарственный препарат и не зарегистрированы предельные отпускные цены производителей на воспроизведенные, биоаналоговые (биоподобные) лекарственные препараты, расчет цены осуществляется Федеральной антимонопольной службой на основании минимальной отпускной цены производителя (без учета производственных площадок, с учетом расходов по уплате таможенных сборов за совершение таможенных операций, связанных с выпуском товаров) на соответствующий референтный лекарственный препарат в иностранных государствах, указанных в приложении № 3 к настоящей методике, и в стране производителя с применением понижающего коэффициента, значения которого определяются в соответствии с настоящим разделом.
Если в случае, указанном в абзаце первом настоящего пункта, отпускные цены производителя на соответствующий референтный лекарственный препарат в иностранных государствах, указанных в приложении № 3 к настоящей методике, и в стране производителя отсутствуют, предлагаемая к государственной регистрации предельная отпускная цена на воспроизведенный, биоаналоговый (биоподобный) лекарственный препарат не может превышать максимальную из зарегистрированных предельных отпускных цен на эквивалентную лекарственную форму лекарственного препарата в рамках данного международного непатентованного наименования, содержащегося в перечне жизненно необходимых и важнейших лекарственных препаратов для медицинского применения, в том числе исключенных из государственного реестра предельных отпускных цен производителей на лекарственные препараты, включенные в перечень жизненно необходимых и важнейших лекарственных препаратов для медицинского применения.
12. Держатель или владелец регистрационного удостоверения (уполномоченное им лицо) воспроизведенного, биоаналогового (биоподобного) лекарственного препарата в случае, если предельная отпускная цена на соответствующий референтный лекарственный препарат зарегистрирована, представляет для государственной регистрации предельную отпускную цену на лекарственный препарат, не превышающую цену (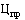 ) (рублей), рассчитанную по формуле:
) (рублей), рассчитанную по формуле:
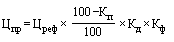 ,
,
где:
 - зарегистрированная на дату подачи заявления о государственной регистрации предельной отпускной цены держателем или владельцем регистрационного удостоверения воспроизведенного, биоаналогового (биоподобного) лекарственного препарата (или уполномоченным им лицом) предельная отпускная цена за вторичную (потребительскую) упаковку референтного лекарственного препарата;
- зарегистрированная на дату подачи заявления о государственной регистрации предельной отпускной цены держателем или владельцем регистрационного удостоверения воспроизведенного, биоаналогового (биоподобного) лекарственного препарата (или уполномоченным им лицом) предельная отпускная цена за вторичную (потребительскую) упаковку референтного лекарственного препарата;
 - понижающий коэффициент, значения которого при государственной регистрации предельной отпускной цены на лекарственный препарат определяются в соответствии с пунктами 14 и 15 настоящей методики (процентов), с округлением до сотых.
- понижающий коэффициент, значения которого при государственной регистрации предельной отпускной цены на лекарственный препарат определяются в соответствии с пунктами 14 и 15 настоящей методики (процентов), с округлением до сотых.
В случае если зарегистрированная предельная отпускная цена на референтный лекарственный препарат снижена в соответствии с пунктом 41 Правил ниже зарегистрированной предельной отпускной цены на воспроизведенный, биоаналоговый (биоподобный) лекарственный препарат, при расчете предельных отпускных цен производителей на последующие воспроизведенные, биоаналоговые (биоподобные) лекарственные препараты понижающий коэффициент принимается равным нулю;
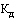 - коэффициент пересчета дозировки (концентрации, активности в единицах действия), определяемый как соотношение между количеством единиц действующего вещества в дозировке (концентрации, активности в единицах действия) воспроизведенного, биоаналогового (биоподобного) лекарственного препарата и количеством единиц действующего вещества в дозировке (концентрации, активности в единицах действия) референтного лекарственного препарата;
- коэффициент пересчета дозировки (концентрации, активности в единицах действия), определяемый как соотношение между количеством единиц действующего вещества в дозировке (концентрации, активности в единицах действия) воспроизведенного, биоаналогового (биоподобного) лекарственного препарата и количеством единиц действующего вещества в дозировке (концентрации, активности в единицах действия) референтного лекарственного препарата;
 - коэффициент пересчета фасовки, определяемый как соотношение между количеством лекарственного препарата во вторичной (потребительской) упаковке воспроизведенного, биоаналогового (биоподобного) лекарственного препарата и количеством лекарственного препарата во вторичной (потребительской) упаковке референтного лекарственного препарата.
- коэффициент пересчета фасовки, определяемый как соотношение между количеством лекарственного препарата во вторичной (потребительской) упаковке воспроизведенного, биоаналогового (биоподобного) лекарственного препарата и количеством лекарственного препарата во вторичной (потребительской) упаковке референтного лекарственного препарата.
13. Предельная отпускная цена за вторичную (потребительскую) упаковку референтного лекарственного препарата определяется как минимальная зарегистрированная предельная отпускная цена на референтный лекарственный препарат с такой же дозировкой (концентрацией, активностью в единицах действия) и таким же количеством лекарственного препарата во вторичной (потребительской) упаковке, что и заявляемый воспроизведенный, биоаналоговый (биоподобный) лекарственный препарат, с учетом случаев, предусмотренных пунктом 28 Правил.
В случае если не зарегистрированы предельные отпускные цены на референтный лекарственный препарат с таким же количеством лекарственного препарата во вторичной (потребительской) упаковке, что и заявляемый воспроизведенный, биоаналоговый (биоподобный) лекарственный препарат, цена на воспроизведенный, биоаналоговый (биоподобный) лекарственный препарат определяется как стоимость одной лекарственной формы референтного лекарственного препарата, умноженная на количество лекарственного препарата во вторичной (потребительской) упаковке заявляемого воспроизведенного, биоаналогового (биоподобного) лекарственного препарата, при этом коэффициент пересчета фасовки соответственно равен единице.
Стоимость одной лекарственной формы референтного лекарственного препарата рассчитывается исходя из среднего арифметического значения зарегистрированных цен на ближайшие по значению количества референтного лекарственного препарата во вторичной (потребительской) упаковке, в отношении лекарственных препаратов в жидких лекарственных формах расчет стоимости одной лекарственной формы осуществляется исходя из среднего арифметического значения зарегистрированных цен на ближайшие по значению количества лекарственного препарата в первичной упаковке.
В случае если не зарегистрированы предельные отпускные цены на референтный лекарственный препарат с такой же дозировкой (концентрацией, активностью в единицах действия), что и заявляемый воспроизведенный, биоаналоговый (биоподобный) лекарственный препарат, цена на воспроизведенный, биоаналоговый (биоподобный) лекарственный препарат определяется как стоимость единицы действующего вещества референтного лекарственного препарата, умноженная на количество единиц действующего вещества заявляемого воспроизведенного, биоаналогового (биоподобного) лекарственного препарата, при этом коэффициент пересчета дозировки соответственно равен единице.
Стоимость единицы действующего вещества референтного лекарственного препарата рассчитывается исходя из среднего арифметического значения зарегистрированных цен на ближайшие по значению дозировки (концентрации, активности в единицах действия) референтного лекарственного препарата.
14. При расчете предельной отпускной цены на воспроизведенный, биоаналоговый (биоподобный) лекарственный препарат:
а) в случае если на дату подачи в Министерство здравоохранения Российской Федерации заявления о государственной регистрации предельной отпускной цены производителя государства - члена Евразийского экономического союза на лекарственный препарат не зарегистрирована предельная отпускная цена на воспроизведенный, биоаналоговый (биоподобный) лекарственный препарат производителя государства - члена Евразийского экономического союза, отнесенный к одному международному непатентованному наименованию в такой же лекарственной форме (в том числе с учетом информации о взаимозаменяемых лекарственных препаратах для медицинского применения), что и заявляемый воспроизведенный, биоаналоговый (биоподобный) лекарственный препарат, понижающий коэффициент определяется по одной из формул расчета понижающих коэффициентов, применяемых при расчете предельной отпускной цены производителя на первый воспроизведенный, биоаналоговый (биоподобный) лекарственный препарат, а также воспроизведенный, биоаналоговый (биоподобный) орфанный лекарственный препарат, представляемой на государственную регистрацию, согласно приложению № 6;
б) в случае если на дату подачи в Министерство здравоохранения Российской Федерации заявления о государственной регистрации предельной отпускной цены лекарственного препарата иностранного производства, в том числе первичная и (или) вторичная упаковка которого осуществляется или первичную и (или) вторичную упаковку которого планируется осуществлять в Российской Федерации, не зарегистрирована предельная отпускная цена на воспроизведенный, биоаналоговый (биоподобный) лекарственный препарат, отнесенный к одному международному непатентованному наименованию в такой же лекарственной форме (в том числе с учетом информации о взаимозаменяемых лекарственных препаратах для медицинского применения), что и заявляемый воспроизведенный, биоаналоговый (биоподобный) лекарственный препарат, понижающий коэффициент определяется в соответствии с приложением № 6 к настоящей методике;
в) в случае если на дату подачи в Министерство здравоохранения Российской Федерации заявления о государственной регистрации предельной отпускной цены производителя государства - члена Евразийского экономического союза на лекарственный препарат зарегистрирована предельная отпускная цена на воспроизведенный, биоаналоговый (биоподобный) лекарственный препарат производителя государства - члена Евразийского экономического союза, отнесенный к одному международному непатентованному наименованию в такой же лекарственной форме (в том числе с учетом информации о взаимозаменяемых лекарственных препаратах для медицинского применения), что и заявляемый воспроизведенный, биоаналоговый (биоподобный) лекарственный препарат, понижающий коэффициент определяется по одной из формул расчета понижающих коэффициентов, применяемых при расчете предельной отпускной цены производителя на воспроизведенный, биоаналоговый (биоподобный) лекарственный препарат, представляемой на государственную регистрацию, согласно приложению № 7;
г) в случае если на дату подачи в Министерство здравоохранения Российской Федерации заявления о государственной регистрации предельной отпускной цены лекарственного препарата иностранного производства, в том числе первичная и (или) вторичная упаковка которого осуществляется или первичную и (или) вторичную упаковку которого планируется осуществлять в Российской Федерации, зарегистрирована предельная отпускная цена на воспроизведенный, биоаналоговый (биоподобный) лекарственный препарат, отнесенный к одному международному непатентованному наименованию в такой же лекарственной форме (в том числе с учетом информации о взаимозаменяемых лекарственных препаратах для медицинского применения), что и заявляемый воспроизведенный, биоаналоговый (биоподобный) лекарственный препарат, понижающий коэффициент определяется в соответствии с приложением № 7 к настоящей методике;
д) в случаях, при которых в рамках международного непатентованного наименования и лекарственной формы на референтный лекарственный препарат зарегистрированы различные предельные отпускные цены, применяется среднее арифметическое значение понижающего коэффициента, рассчитанное на основании зарегистрированных предельных отпускных цен на референтный лекарственный препарат, за исключением случаев, при которых понижающий коэффициент равен нулю.
15. В отношении воспроизведенного, биоаналогового (биоподобного) орфанного лекарственного препарата понижающий коэффициент определяется в соответствии с приложением № 6 к настоящей методике для воспроизведенного, биоаналогового (биоподобного) орфанного лекарственного препарата.
16. В случае отсутствия в рамках международного непатентованного наименования и лекарственной формы референтного лекарственного препарата или в случае, если предельная отпускная цена на референтный лекарственный препарат не зарегистрирована, держатель или владелец регистрационного удостоверения (уполномоченное им лицо) воспроизведенного, биоаналогового (биоподобного) лекарственного препарата представляет для государственной регистрации предельную отпускную цену на лекарственный препарат, не превышающую цену ( ) (рублей), рассчитанную по формуле:
) (рублей), рассчитанную по формуле:
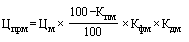 ,
,
где:
 - максимальная зарегистрированная предельная отпускная цена за вторичную (потребительскую) упаковку лекарственного препарата, который совпадает по международному непатентованному наименованию и лекарственной форме с воспроизведенным, биоаналоговым (биоподобным) лекарственным препаратом, в отношении которого планируется к государственной регистрации предельная отпускная цена, определенная в соответствии с пунктом 17 настоящей методики (рублей);
- максимальная зарегистрированная предельная отпускная цена за вторичную (потребительскую) упаковку лекарственного препарата, который совпадает по международному непатентованному наименованию и лекарственной форме с воспроизведенным, биоаналоговым (биоподобным) лекарственным препаратом, в отношении которого планируется к государственной регистрации предельная отпускная цена, определенная в соответствии с пунктом 17 настоящей методики (рублей);
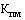 - понижающий коэффициент, значения которого при государственной регистрации предельной отпускной цены на лекарственный препарат определяются в соответствии с пунктом 18 настоящей методики (процентов), с округлением до сотых.
- понижающий коэффициент, значения которого при государственной регистрации предельной отпускной цены на лекарственный препарат определяются в соответствии с пунктом 18 настоящей методики (процентов), с округлением до сотых.
В случае если в рамках международного непатентованного наименования и лекарственной формы предельная отпускная цена на референтный лекарственный препарат не зарегистрирована и зарегистрирована предельная отпускная цена производителя на воспроизведенный, биоаналоговый (биоподобный) лекарственный препарат с учетом требований пункта 11 настоящей методики, при расчете предельных отпускных цен производителей на вторые и последующие воспроизведенные, биоаналоговые (биоподобные) лекарственные препараты понижающий коэффициент принимается равным нулю.
В случае расчета предельной отпускной цены на лекарственный препарат, в рамках регистрационного удостоверения которого зарегистрированная цена определена как максимальная цена в соответствии с пунктом 17 настоящей методики, понижающий коэффициент принимается равным нулю.
В случае если в рамках международного непатентованного наименования и лекарственной формы предельная отпускная цена на референтный орфанный лекарственный препарат не зарегистрирована и зарегистрирована предельная отпускная цена производителя на воспроизведенный, биоаналоговый (биоподобный) орфанный лекарственный препарат, при расчете предельных отпускных цен производителей на вторые и последующие воспроизведенные, биоаналоговые (биоподобные) орфанные лекарственные препараты понижающий коэффициент принимается равным нулю;
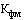 - соотношение между количеством лекарственного препарата во вторичной (потребительской) упаковке воспроизведенного, биоаналогового (биоподобного) лекарственного препарата, в отношении которого планируется к государственной регистрации предельная отпускная цена, и количеством лекарственного препарата во вторичной (потребительской) упаковке лекарственного препарата, цена на который зарегистрирована и который совпадает по международному непатентованному наименованию и лекарственной форме с воспроизведенным, биоаналоговым (биоподобным) лекарственным препаратом, в отношении которого планируется к государственной регистрации предельная отпускная цена;
- соотношение между количеством лекарственного препарата во вторичной (потребительской) упаковке воспроизведенного, биоаналогового (биоподобного) лекарственного препарата, в отношении которого планируется к государственной регистрации предельная отпускная цена, и количеством лекарственного препарата во вторичной (потребительской) упаковке лекарственного препарата, цена на который зарегистрирована и который совпадает по международному непатентованному наименованию и лекарственной форме с воспроизведенным, биоаналоговым (биоподобным) лекарственным препаратом, в отношении которого планируется к государственной регистрации предельная отпускная цена;
 - соотношение между количеством единиц действующего вещества в дозировке (концентрации, активности в единицах действия) воспроизведенного, биоаналогового (биоподобного) лекарственного препарата, в отношении которого планируется к государственной регистрации предельная отпускная цена, и количеством единиц действующего вещества в дозировке (концентрации, активности в единицах действия) лекарственного препарата, цена на который зарегистрирована и который совпадает по международному непатентованному наименованию и лекарственной форме с воспроизведенным, биоаналоговым (биоподобным) лекарственным препаратом, в отношении которого планируется к государственной регистрации предельная отпускная цена.
- соотношение между количеством единиц действующего вещества в дозировке (концентрации, активности в единицах действия) воспроизведенного, биоаналогового (биоподобного) лекарственного препарата, в отношении которого планируется к государственной регистрации предельная отпускная цена, и количеством единиц действующего вещества в дозировке (концентрации, активности в единицах действия) лекарственного препарата, цена на который зарегистрирована и который совпадает по международному непатентованному наименованию и лекарственной форме с воспроизведенным, биоаналоговым (биоподобным) лекарственным препаратом, в отношении которого планируется к государственной регистрации предельная отпускная цена.
17. Максимальная цена определяется как зарегистрированная (перерегистрированная) предельная отпускная цена за вторичную (потребительскую) упаковку лекарственного препарата, отнесенного к одному международному непатентованному наименованию с заявляемым воспроизведенным, биоаналоговым (биоподобным) лекарственным препаратом в таких же лекарственной форме (в том числе с учетом информации о взаимозаменяемых лекарственных препаратах для медицинского применения) и дозировке (концентрации, активности в единицах действия), с максимальной стоимостью одной лекарственной формы.
В случае если зарегистрирована (перерегистрирована) предельная отпускная цена на такой лекарственный препарат, который совпадает по количеству во вторичной (потребительской) упаковке с заявляемым воспроизведенным, биоаналоговым (биоподобным) лекарственным препаратом, максимальная цена определяется как последняя зарегистрированная (перерегистрированная) предельная отпускная цена на такой лекарственный препарат.
В случае если на такой лекарственный препарат в рамках регистрационного удостоверения лекарственного препарата не зарегистрированы предельные отпускные цены с таким же количеством лекарственного препарата во вторичной (потребительской) упаковке, что и заявляемый воспроизведенный, биоаналоговый (биоподобный) лекарственный препарат, максимальная цена определяется как стоимость одной лекарственной формы такого лекарственного препарата, умноженная на количество лекарственного препарата во вторичной (потребительской) упаковке заявляемого воспроизведенного, биоаналогового (биоподобного) лекарственного препарата, при этом коэффициент, указанный в абзаце девятом пункта 16 настоящей методики, соответственно равен единице.
Стоимость одной лекарственной формы такого лекарственного препарата рассчитывается исходя из среднего арифметического значения зарегистрированных цен на ближайшие по значению количества лекарственного препарата во вторичной (потребительской) упаковке такого лекарственного препарата, в отношении лекарственных препаратов в жидких лекарственных формах расчет стоимости одной лекарственной формы осуществляется исходя из среднего арифметического значения зарегистрированных цен на ближайшие по значению количества лекарственного препарата в первичной упаковке.
В случае если не зарегистрированы предельные отпускные цены на такой лекарственный препарат с такой же дозировкой (концентрацией, активностью в единицах действия), что и заявляемый воспроизведенный, биоаналоговый (биоподобный) лекарственный препарат, максимальная цена определяется как стоимость единицы действующего вещества такого лекарственного препарата, умноженная на количество единиц действующего вещества заявляемого воспроизведенного, биоаналогового (биоподобного) лекарственного препарата, при этом коэффициент, указанный в абзаце десятом пункта 16 настоящей методики, соответственно равен единице.
Стоимость единицы действующего вещества такого лекарственного препарата рассчитывается исходя из среднего арифметического значения зарегистрированных цен на ближайшие по значению дозировки (концентрации, активности в единицах действия).
18. Понижающий коэффициент при расчете предельных отпускных цен на воспроизведенные, биоаналоговые (биоподобные) лекарственные препараты определяется в соответствии с уровнем максимальной зарегистрированной предельной отпускной цены за вторичную (потребительскую) упаковку лекарственного препарата, который совпадает по международному непатентованному наименованию и лекарственной форме с воспроизведенным, биоаналоговым (биоподобным) лекарственным препаратом и рассчитывается в соответствии с пунктом 14 настоящей методики.
В случаях, при которых на лекарственный препарат, цена на который определена как максимальная зарегистрированная предельная отпускная цена в соответствии с требованиями пункта 17 настоящей методики, зарегистрированы предельные отпускные цены на различные дозировки (концентрации, активности в единицах действия) и (или) количества лекарственного препарата во вторичной (потребительской) упаковке, применяется среднее арифметическое значение понижающего коэффициента, рассчитанное с учетом максимальной стоимости единицы действующего вещества такого лекарственного препарата или лекарственной формы, за исключением случаев, при которых понижающий коэффициент равен нулю.
IV. Расчет средневзвешенной фактической отпускной цены на лекарственный препарат производителя государства - члена Евразийского экономического союза и лекарственный препарат иностранного производства, первичная и (или) вторичная упаковка которого осуществляется или первичную и (или) вторичную упаковку которого планируется осуществлять в Российской Федерации
19. Расчет средневзвешенной фактической отпускной цены на конкретный лекарственный препарат производителя государства - члена Евразийского экономического союза и (или) лекарственный препарат иностранного производства, первичная и (или) вторичная упаковка которого осуществляется или первичную и (или) вторичную упаковку которого планируется осуществлять в Российской Федерации, производится за отчетный период, предусмотренный пунктами 26 и 40 Правил, на основании сведений, предусмотренных приложением № 2 к настоящей методике, и (или) сведений из системы мониторинга движения лекарственных препаратов для медицинского применения об объемах и ценах ввоза лекарственного препарата иностранного производства, находящегося в обращении на территории Российской Федерации.
При расчете такой средневзвешенной фактической отпускной цены учитываются сведения об объемах отпуска производителем и отпускных ценах на лекарственный препарат за отчетный период, предусмотренный пунктом 26 Правил, по всем производителям в рамках одного регистрационного удостоверения лекарственного препарата. При этом в случае, если в рамках одного регистрационного удостоверения лекарственного препарата зарегистрированы предельные отпускные цены на лекарственный препарат производителя государства - члена Евразийского экономического союза, при расчете средневзвешенной фактической отпускной цены для государственной регистрации предельных отпускных цен на этот лекарственный препарат иностранного производства, первичная и (или) вторичная упаковка которого осуществляется или первичную и (или) вторичную упаковку которого планируется осуществлять в Российской Федерации, не учитываются сведения об объемах отпуска лекарственного препарата производителем государства - члена Евразийского экономического союза и отпускных ценах на него.
Расчет средневзвешенной фактической отпускной цены на лекарственный препарат осуществляется с учетом всех форм выпуска (упаковки, комплектности) лекарственного препарата, за исключением случаев, предусмотренных пунктом 28 Правил.
20. Средневзвешенная фактическая отпускная цена производителя государства - члена Евразийского экономического союза на лекарственный препарат (указывается по торговому наименованию, международному непатентованному наименованию, дозировке (концентрации, активности в единицах действия), лекарственной форме, количеству лекарственного препарата во вторичной (потребительской) упаковке (количеству доз в упаковке, объему) в рамках регистрационного удостоверения лекарственного препарата, отгруженный производителем в адрес дистрибьюторов в целях последующей реализации за отчетный период, предусмотренный пунктом 26 Правил, ( ) (рублей), определяется по формуле:
) (рублей), определяется по формуле:
 ,
,
где:
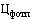 - фактическая отпускная цена производителя государства - члена Евразийского экономического союза за одну вторичную (потребительскую) упаковку лекарственного препарата (указывается по торговому наименованию, международному непатентованному наименованию, дозировке (концентрации, активности в единицах действия), лекарственной форме, количеству лекарственного препарата во вторичной (потребительской) упаковке (количеству доз в упаковке, объему) (рублей);
- фактическая отпускная цена производителя государства - члена Евразийского экономического союза за одну вторичную (потребительскую) упаковку лекарственного препарата (указывается по торговому наименованию, международному непатентованному наименованию, дозировке (концентрации, активности в единицах действия), лекарственной форме, количеству лекарственного препарата во вторичной (потребительской) упаковке (количеству доз в упаковке, объему) (рублей);
 - количество вторичных (потребительских) упаковок лекарственного препарата (указывается по торговому наименованию, международному непатентованному наименованию, дозировке (концентрации, активности в единицах действия), лекарственной форме, количеству лекарственного препарата во вторичной (потребительской) упаковке (количеству доз в упаковке, объему) производителя государства - члена Евразийского экономического союза, отгруженного производителем в адрес дистрибьюторов с целью последующей реализации за отчетный период, предусмотренный пунктом 26 Правил, по одной цене (штук);
- количество вторичных (потребительских) упаковок лекарственного препарата (указывается по торговому наименованию, международному непатентованному наименованию, дозировке (концентрации, активности в единицах действия), лекарственной форме, количеству лекарственного препарата во вторичной (потребительской) упаковке (количеству доз в упаковке, объему) производителя государства - члена Евразийского экономического союза, отгруженного производителем в адрес дистрибьюторов с целью последующей реализации за отчетный период, предусмотренный пунктом 26 Правил, по одной цене (штук);
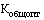 - общее количество вторичных (потребительских) упаковок лекарственного препарата (указывается по торговому наименованию, международному непатентованному наименованию, дозировке (концентрации, активности в единицах действия), лекарственной форме, количеству лекарственного препарата во вторичной (потребительской) упаковке (количеству доз в упаковке, объему) производителей государств - членов Евразийского экономического союза в рамках регистрационного удостоверения лекарственного препарата, произведенного и отгруженного производителем в адрес дистрибьюторов с целью последующей реализации за отчетный период, предусмотренный пунктом 26 Правил (штук). Из общего количества исключаются экспортные поставки, поставки, осуществленные в рамках различных видов гуманитарной помощи, и поставки лекарственных препаратов в рамках благотворительности, а также поставки лекарственных препаратов с остаточным сроком годности менее 10 процентов.
- общее количество вторичных (потребительских) упаковок лекарственного препарата (указывается по торговому наименованию, международному непатентованному наименованию, дозировке (концентрации, активности в единицах действия), лекарственной форме, количеству лекарственного препарата во вторичной (потребительской) упаковке (количеству доз в упаковке, объему) производителей государств - членов Евразийского экономического союза в рамках регистрационного удостоверения лекарственного препарата, произведенного и отгруженного производителем в адрес дистрибьюторов с целью последующей реализации за отчетный период, предусмотренный пунктом 26 Правил (штук). Из общего количества исключаются экспортные поставки, поставки, осуществленные в рамках различных видов гуманитарной помощи, и поставки лекарственных препаратов в рамках благотворительности, а также поставки лекарственных препаратов с остаточным сроком годности менее 10 процентов.
21. Средневзвешенная фактическая отпускная цена лекарственного препарата иностранного производства, первичная и (или) вторичная упаковка которого осуществляется или первичную и (или) вторичную упаковку которого планируется осуществлять в Российской Федерации (указывается по торговому наименованию, международному непатентованному наименованию, дозировке (концентрации, активности в единицах действия), лекарственной форме, количеству лекарственного препарата во вторичной (потребительской) упаковке (количеству доз в упаковке, объему) в рамках регистрационного удостоверения лекарственного препарата, отгруженного производителем в адрес дистрибьюторов в целях последующей реализации за отчетный период, предусмотренный пунктом 26 Правил (рублей), определяется по формуле, приведенной в пункте 20 настоящей методики.
V. Расчет рентабельности для лекарственного препарата производителя государства - члена Евразийского экономического союза при перерегистрации предельной отпускной цены на лекарственный препарат
22. Расчет и обоснование расходов, связанных с разработкой, производством и реализацией лекарственного препарата производителя государства - члена Евразийского экономического союза, представляемой на перерегистрацию предельной отпускной цены на лекарственный препарат, осуществляется согласно приложению № 8.
23. Расчет рентабельности лекарственного препарата за отчетный период, предусмотренный пунктом 40 Правил, осуществляется по каждому производителю государства - члена Евразийского экономического союза в рамках одного регистрационного удостоверения лекарственного препарата.
24. При перерегистрации предельной отпускной цены производителя государства - члена Евразийского экономического союза на лекарственный препарат, находившийся в обращении на территории Российской Федерации, фактический уровень рентабельности продукции ( ) (процентов) определяется по формуле:
) (процентов) определяется по формуле:
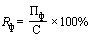 ,
,
где:
 - прибыль от реализации производителем конкретного лекарственного препарата за отчетный период, предусмотренный пунктом 40 Правил, в соответствии с приложением № 8 к настоящей методике (рублей);
- прибыль от реализации производителем конкретного лекарственного препарата за отчетный период, предусмотренный пунктом 40 Правил, в соответствии с приложением № 8 к настоящей методике (рублей);
С - сумма прямых, общепроизводственных и общехозяйственных расходов, согласно приложению № 8 к настоящей методике (рублей).
25. При перерегистрации предельной отпускной цены производителя государства - члена Евразийского экономического союза на лекарственный препарат, не поступавший в обращение на территории Российской Федерации в течение отчетного периода, прогнозируемый уровень рентабельности продукции ( ) (процентов) определяется по формуле:
) (процентов) определяется по формуле:
 ,
,
где  - прибыль от реализации производителем конкретного лекарственного препарата за год, которая приведена в приложении № 8 к настоящей методике (рублей).
- прибыль от реализации производителем конкретного лекарственного препарата за год, которая приведена в приложении № 8 к настоящей методике (рублей).
26. При перерегистрации предельной отпускной цены производителя государства - члена Евразийского экономического союза на лекарственный препарат в случаях, предусмотренных подпунктами "а" - "в" пункта 34 Правил, если фактический уровень рентабельности за отчетный период, предусмотренный пунктом 40 Правил, превысит 30 процентов, заявляемая к перерегистрации предельная отпускная цена на лекарственный препарат подлежит снижению с учетом данного ограничения.
VI. Расчет средневзвешенной фактической цены ввоза лекарственного препарата иностранного производства в Российскую Федерацию
27. Расчет средневзвешенной фактической цены ввоза конкретного лекарственного препарата иностранного производства в Российскую Федерацию производится на основании сведений из системы мониторинга движения лекарственных препаратов для медицинского применения об объемах и ценах ввоза лекарственного препарата иностранного производства, находящегося в обращении на территории Российской Федерации.
При расчете средневзвешенной фактической цены ввоза лекарственного препарата учитываются сведения об объемах и о ценах ввоза лекарственного препарата за отчетный период, предусмотренный пунктами 26 и 40 Правил, по каждому иностранному производителю в рамках одного регистрационного удостоверения лекарственного препарата.
Расчет средневзвешенной фактической цены ввоза лекарственного препарата осуществляется с учетом формы выпуска (упаковки, комплектности) лекарственного препарата, за исключением случаев, предусмотренных пунктом 28 Правил.
28. Средневзвешенная фактическая цена ввоза лекарственного препарата (указывается по торговому наименованию, международному непатентованному наименованию, дозировке (концентрации, активности в единицах действия), лекарственной форме, количеству лекарственного препарата во вторичной (потребительской) упаковке (количеству доз в упаковке, объему) иностранных производителей, указанных в регистрационном удостоверении лекарственного препарата, ввезенного за отчетный период, предусмотренный пунктом 26 Правил, на территорию Российской Федерации (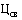 ) (рублей), определяется по формуле:
) (рублей), определяется по формуле:
 ,
,
где:
 - фактическая цена ввоза одной вторичной (потребительской) упаковки лекарственного препарата (указывается по торговому наименованию, международному непатентованному наименованию, дозировке (концентрации, активности в единицах действия), лекарственной форме, количеству лекарственного препарата во вторичной (потребительской) упаковке (количеству доз в упаковке, объему) иностранного производства (рублей);
- фактическая цена ввоза одной вторичной (потребительской) упаковки лекарственного препарата (указывается по торговому наименованию, международному непатентованному наименованию, дозировке (концентрации, активности в единицах действия), лекарственной форме, количеству лекарственного препарата во вторичной (потребительской) упаковке (количеству доз в упаковке, объему) иностранного производства (рублей);
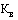 - количество вторичных (потребительских) упаковок лекарственного препарата иностранного производства (указывается по торговому наименованию, международному непатентованному наименованию, дозировке (концентрации, активности в единицах действия), лекарственной форме, количеству лекарственного препарата во вторичной (потребительской) упаковке (количеству доз в упаковке, объему), ввезенного иностранным производителем (импортером) на территорию Российской Федерации за отчетный период, предусмотренный пунктом 26 Правил, по одной цене (штук);
- количество вторичных (потребительских) упаковок лекарственного препарата иностранного производства (указывается по торговому наименованию, международному непатентованному наименованию, дозировке (концентрации, активности в единицах действия), лекарственной форме, количеству лекарственного препарата во вторичной (потребительской) упаковке (количеству доз в упаковке, объему), ввезенного иностранным производителем (импортером) на территорию Российской Федерации за отчетный период, предусмотренный пунктом 26 Правил, по одной цене (штук);
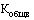 - общее количество вторичных (потребительских) упаковок лекарственного препарата (указывается по торговому наименованию, международному непатентованному наименованию, дозировке (концентрации, активности в единицах действия), лекарственной форме, количеству лекарственного препарата во вторичной (потребительской) упаковке (количеству доз в упаковке, объему) иностранных производителей в рамках регистрационного удостоверения лекарственного препарата, ввезенного иностранным производителем (импортером) на территорию Российской Федерации за отчетный период, предусмотренный пунктом 26 Правил (штук).
- общее количество вторичных (потребительских) упаковок лекарственного препарата (указывается по торговому наименованию, международному непатентованному наименованию, дозировке (концентрации, активности в единицах действия), лекарственной форме, количеству лекарственного препарата во вторичной (потребительской) упаковке (количеству доз в упаковке, объему) иностранных производителей в рамках регистрационного удостоверения лекарственного препарата, ввезенного иностранным производителем (импортером) на территорию Российской Федерации за отчетный период, предусмотренный пунктом 26 Правил (штук).
Из общего количества ввезенного иностранным производителем (импортером) на территорию Российской Федерации объема лекарственных препаратов исключаются данные о ввозе лекарственных препаратов в рамках различных видов гуманитарной помощи и (или) в рамках благотворительности, данные о ввозе лекарственных препаратов с остаточным сроком годности менее 10 процентов, а также данные о ввозе лекарственных препаратов с фактической ценой ввоза, превышающей зарегистрированную предельную отпускную цену производителя.
VII. Расчет минимальной цены производителя на лекарственный препарат в иностранных государствах, указанных в приложении № 3 к настоящей методике, и в стране производителя
29. Расчет предельной отпускной цены производителя на лекарственный препарат (по торговому наименованию, международному непатентованному наименованию, дозировке (концентрации, активности в единицах действия), лекарственной форме, количеству лекарственного препарата во вторичной (потребительской) упаковке (количеству доз в упаковке, объему) производится на основании сведений об уровне минимальных цен лекарственного препарата (без учета производственных площадок) в иностранных государствах, указанных в приложении № 3 к настоящей методике, и в стране производителя и на основании сведений, предусмотренных разделом III приложения № 4 к настоящей методике.
30. В разделе III приложения № 4 к настоящей методике минимальные цены производителя на лекарственный препарат в иностранных государствах, указанных в приложении № 3 к настоящей методике, и в стране производителя указываются в рублях. Пересчет цены в иностранной валюте в рубли осуществляется по среднему курсу соответствующей иностранной валюты к рублю Российской Федерации, установленному Центральным банком Российской Федерации за 3 календарных месяца, предшествующие месяцу даты подачи заявления о государственной регистрации (перерегистрации) предельной отпускной цены производителя на лекарственный препарат. Курс соответствующей иностранной валюты к рублю Российской Федерации, в соответствии с которым осуществлен пересчет цены в иностранной валюте в рубли, указывается в разделе IV приложения № 4 к настоящей методике.
31. В случае если лекарственный препарат реализуется в иностранных государствах, указанных в приложении № 3 к настоящей методике, и в стране производителя под другим торговым наименованием, в разделе III приложения № 4 к настоящей методике указываются соответствующее торговое наименование и минимальные цены производителя на лекарственный препарат.
32. В случае государственной регистрации (перерегистрации) в Российской Федерации предельной отпускной цены на лекарственный препарат с количеством лекарственного препарата во вторичной (потребительской) упаковке (количеством доз в упаковке, объемом), отсутствующим в одном или нескольких иностранных государствах, указанных в приложении № 3 к настоящей методике, и в стране производителя, в разделе III приложения № 4 к настоящей методике указываются минимальные цены на лекарственный препарат, в отношении которого заявляются к государственной регистрации (перерегистрации) предельные отпускные цены, с ближайшими по значению количествами лекарственного препарата во вторичной (потребительской) упаковке (вне зависимости от наличия их государственной регистрации на территории Российской Федерации), которые реализуются в иностранных государствах, указанных в приложении № 3 к настоящей методике, и в стране производителя.
При этом минимальная цена производителя на заявляемый к государственной регистрации (перерегистрации) лекарственный препарат определяется как среднее арифметическое значение стоимости одной лекарственной формы лекарственных препаратов, имеющих ближайшие по значению количества лекарственного препарата во вторичной (потребительской) упаковке, умноженное на количество лекарственного препарата во вторичной (потребительской) упаковке заявляемого к государственной регистрации (перерегистрации) лекарственного препарата в каждом из иностранных государств, указанных в приложении № 3 к настоящей методике, и в стране производителя (графа 5 раздела III приложения № 4 к настоящей методике).
В случае государственной регистрации (перерегистрации) в Российской Федерации предельной отпускной цены лекарственного препарата с дозировкой (концентрацией, активностью в единицах действия), отсутствующей в одном или нескольких иностранных государствах, указанных в приложении № 3 к настоящей методике, и в стране производителя, в разделе III приложения № 4 к настоящей методике указываются минимальные цены на заявляемый к государственной регистрации (перерегистрации) лекарственный препарат с ближайшими по значению дозировками (концентрациями, активностями в единицах действия) (вне зависимости от наличия их государственной регистрации на территории Российской Федерации), которые реализуются в иностранных государствах, указанных в приложении № 3 к настоящей методике.
При этом минимальная цена производителя на заявляемый к государственной регистрации (перерегистрации) лекарственный препарат определяется как среднее арифметическое значение стоимости единицы действующего вещества лекарственных препаратов, имеющих ближайшие по значению дозировки (концентрации, активности в единицах действия), умноженное на количество единиц действующего вещества заявляемого к государственной регистрации (перерегистрации) лекарственного препарата в каждом из иностранных государств, указанных в приложении № 3 к настоящей методике, и в стране производителя (графа 6 раздела III приложения № 4 к настоящей методике). В расчете не учитываются ближайшие по значению дозировки (концентрации, активности в единицах действия), превышающие дозировку (концентрации, активности в единицах действия) заявленного к государственной регистрации (перерегистрации) лекарственного препарата, предназначенного для применения в педиатрической практике (на основании сведений инструкции по медицинскому применению лекарственного препарата), более чем в 2 раза.
33. В случае если лекарственный препарат иностранного производства или иностранного держателя или владельца регистрационного удостоверения лекарственного препарата, в том числе стадия производства готовой лекарственной формы которого и(или) стадия первичной и(или) вторичной упаковки которого осуществляются или первичную и (или) вторичную упаковку которого планируется осуществлять в Российской Федерации, производится только для продажи в Российской Федерации (не реализуется в иностранных государствах, указанных в приложении № 3 к настоящей методике, и в стране производителя), для расчета предельной отпускной цены производителя на лекарственный препарат представляется информация о минимальных ценах других иностранных производителей на лекарственные препараты, отнесенные к одному международному непатентованному наименованию в такой же лекарственной форме (в том числе с учетом информации о взаимозаменяемых лекарственных препаратах для медицинского применения), обращающиеся в государстве производителя, на основании данных из открытых общедоступных источников, соответствующих требованиям пункта 21 Правил. При этом заявленная к государственной регистрации цена на такой лекарственный препарат не должна превышать минимальную цену других иностранных производителей (с учетом расходов по уплате таможенных сборов за совершение таможенных операций, связанных с выпуском товаров), рассчитанную на основании раздела III приложения № 4 к настоящей методике.
VIII. Расчет предельной отпускной цены производителей на лекарственный препарат производителя государства - члена Евразийского экономического союза при ее перерегистрации
34. Предельная отпускная цена на лекарственный препарат при ее перерегистрации устанавливается для каждого производителя в рамках регистрационного удостоверения лекарственного препарата в соответствии с требованиями пунктов 27, 28 и 32 Правил и не может превышать минимальную цену, рассчитанную в соответствии с настоящим разделом.
35. Перерегистрация предельной отпускной цены производителя государства - члена Евразийского экономического союза на лекарственный препарат в случаях, предусмотренных подпунктами "а" - "в" пункта 34 Правил, осуществляется в соответствии с приложением № 8 к настоящей методике.
36. Предельная отпускная цена производителя государства - члена Евразийского экономического союза на лекарственный препарат при ее перерегистрации в случаях, указанных в подпунктах "а" и "в" пункта 34 Правил, подлежит увеличению:
а) на величину удорожания сырья и материалов;
б) на величину изменения накладных расходов.
37. Предельная отпускная цена производителя государства - члена Евразийского экономического союза на лекарственный препарат при ее перерегистрации в случае, указанном в подпункте "б" пункта 34 Правил, подлежит увеличению в части стоимости сырья и материалов, используемых при производстве конкретного лекарственного препарата, пропорционально величине удорожания стоимости сырья и материалов в структуре затрат на производство и реализацию лекарственного препарата, которое в равной степени влияет на зарегистрированные цены на все лекарственные препараты, отнесенные к одному международному непатентованному наименованию и имеющие одинаковый путь введения.
38. Величина увеличения зарегистрированной предельной отпускной цены на лекарственный препарат производителя государства - члена Евразийского экономического союза при ее перерегистрации в случаях, указанных в подпунктах "а" и "б" пункта 34 Правил, не должна превышать уровень фактической инфляции в предшествующем календарном году с учетом прогнозируемого уровня инфляции, установленного на текущий год федеральным законом о федеральном бюджете на соответствующий финансовый год и плановый период (И) (процентов), определяемый по формуле:
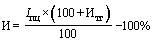 ,
,
где:
 - индекс потребительских цен на товары и услуги предшествующего календарного года (процентов);
- индекс потребительских цен на товары и услуги предшествующего календарного года (процентов);
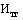 - прогнозируемый уровень инфляции, установленный на текущий год федеральным законом о федеральном бюджете на соответствующий финансовый год и плановый период (процентов).
- прогнозируемый уровень инфляции, установленный на текущий год федеральным законом о федеральном бюджете на соответствующий финансовый год и плановый период (процентов).
39. При расчете предельной отпускной цены на лекарственный препарат при ее перерегистрации в случаях, указанных в подпунктах "а" - "в" пункта 34 Правил, не учитывается увеличение накладных расходов при изменении способа отнесения затрат организации, которые напрямую не связаны с основным производством, на себестоимость лекарственного препарата.
40. Перерегистрация предельной отпускной цены производителя государства - члена Евразийского экономического союза на лекарственный препарат в случае, предусмотренном подпунктом "г" пункта 34 Правил, осуществляется на основании сведений, предусмотренных приложением № 2 к настоящей методике.
41. Предельная отпускная цена производителя государства - члена Евразийского экономического союза на лекарственный препарат подлежит перерегистрации в случае, указанном в подпункте "г" пункта 34 Правил, если средневзвешенная фактическая отпускная цена на лекарственный препарат за истекший период со дня принятия решения о государственной регистрации (перерегистрации) до дня подачи заявления о государственной перерегистрации была ниже зарегистрированной на этот период цены не более чем на прогнозируемый уровень инфляции, установленный на текущий год федеральным законом о федеральном бюджете на соответствующий финансовый год и плановый период, но не выше величины, рассчитанной в соответствии с настоящей методикой.
42. Величина увеличения зарегистрированной предельной отпускной цены производителя государства - члена Евразийского экономического союза на лекарственный препарат при ее перерегистрации в случае, указанном в подпункте "г" пункта 34 Правил (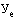 ) (процентов), с округлением до сотых определяется по формуле:
) (процентов), с округлением до сотых определяется по формуле:
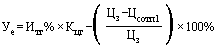 ,
,
где:
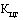 - коэффициент ценовой группы, определяемый в соответствии со значениями коэффициента ценовой группы, применяемого при расчете предельных отпускных цен производителей на лекарственные препараты, в отношении которых представляются на перерегистрацию предельные отпускные цены, согласно приложению № 9.
- коэффициент ценовой группы, определяемый в соответствии со значениями коэффициента ценовой группы, применяемого при расчете предельных отпускных цен производителей на лекарственные препараты, в отношении которых представляются на перерегистрацию предельные отпускные цены, согласно приложению № 9.
Ценовая группа определяется исходя из зарегистрированной предельной отпускной цены на лекарственный препарат за период, истекший со дня государственной регистрации (последней перерегистрации);
 - зарегистрированная предельная отпускная цена на лекарственный препарат за период, истекший со дня государственной регистрации (последней перерегистрации) (рублей);
- зарегистрированная предельная отпускная цена на лекарственный препарат за период, истекший со дня государственной регистрации (последней перерегистрации) (рублей);
 - средневзвешенная фактическая отпускная цена производителя государства - члена Евразийского экономического союза на лекарственный препарат, отгруженный производителем в адрес дистрибьюторов с целью последующей реализации за отчетный период, предусмотренный пунктом 40 Правил, рассчитанная в соответствии с разделом IV настоящей методики (рублей).
- средневзвешенная фактическая отпускная цена производителя государства - члена Евразийского экономического союза на лекарственный препарат, отгруженный производителем в адрес дистрибьюторов с целью последующей реализации за отчетный период, предусмотренный пунктом 40 Правил, рассчитанная в соответствии с разделом IV настоящей методики (рублей).
43. Предлагаемая к перерегистрации предельная отпускная цена на воспроизведенный, биоаналоговый (биоподобный) лекарственный препарат не может превышать отпускную цену, рассчитанную в соответствии с настоящей методикой с учетом требований пункта 33 Правил.
44. Предлагаемая к перерегистрации предельная отпускная цена на лекарственный препарат, реализуемый в иностранных государствах, указанных в приложении № 3 к настоящей методике, и в стране производителя, не может превышать минимальную отпускную цену на этот же лекарственный препарат, определенную в соответствии с разделом VII настоящей методики на основании расчета, предусмотренного приложением № 4 к настоящей методике, с учетом расходов по уплате таможенных сборов за совершение таможенных операций, связанных с выпуском товаров.
IX. Расчет предельной отпускной цены на лекарственный препарат иностранного производства, в том числе первичная и (или) вторичная упаковка которого осуществляется или первичную и (или) вторичную упаковку которого планируется осуществлять в Российской Федерации, при ее перерегистрации
45. Предельная отпускная цена на лекарственный препарат иностранного производства при ее перерегистрации устанавливается для каждого производителя в рамках регистрационного удостоверения лекарственного препарата в соответствии с требованиями пунктов 27, 28 и 32 Правил и не может превышать минимальную цену, рассчитанную в соответствии с настоящим разделом.
46. Перерегистрация предельной отпускной цены на лекарственный препарат иностранного производства осуществляется на основании:
а) обоснования расчета предельной отпускной цены на лекарственный препарат иностранного производства, в том числе первичная и (или) вторичная упаковка которого осуществляется или первичную и (или) вторичную упаковку которого планируется осуществлять в Российской Федерации, представляемой на перерегистрацию, согласно приложению № 10 к настоящей методике;
б) сведений о средневзвешенной фактической цене ввоза лекарственного препарата иностранного производства, предусмотренных приложением № 10.
47. Перерегистрация предельной отпускной цены на лекарственный препарат иностранного производства, первичная и (или) вторичная упаковка которого осуществляется или первичную и (или) вторичную упаковку которого планируется осуществлять в Российской Федерации, на лекарственный препарат осуществляется на основании:
а) сведений, предусмотренных приложением № 2 к настоящей методике;
б) обоснования расчета предельной отпускной цены на лекарственный препарат иностранного производства, в том числе первичная и (или) вторичная упаковка которого осуществляется или первичную и (или) вторичную упаковку которого планируется осуществлять в Российской Федерации, представляемой на перерегистрацию, предусмотренного приложением № 10 к настоящей методике.
48. Предельная отпускная цена на лекарственный препарат иностранного производства, в том числе первичная и (или) вторичная упаковка которого осуществляется или первичную и (или) вторичную упаковку которого планируется осуществлять в Российской Федерации, при ее перерегистрации подлежит увеличению при соблюдении следующих условий:
а) если рост курса национальной валюты каждого государства-производителя к рублю со дня принятия решения о государственной регистрации или перерегистрации предельной отпускной цены производителя на лекарственный препарат по отношению к курсу национальной валюты по день подачи заявления о государственной перерегистрации превышает прогнозируемый уровень инфляции, установленный на текущий год федеральным законом о федеральном бюджете на соответствующий финансовый год и плановый период (за исключением случаев, предусмотренных абзацем третьим пункта 36 Правил);
б) если средневзвешенная фактическая цена ввоза лекарственного препарата (для лекарственного препарата иностранного производства, первичная и (или) вторичная упаковка которого осуществляется или первичную и (или) вторичную упаковку которого планируется осуществлять в Российской Федерации, применяется средневзвешенная фактическая отпускная цена) за отчетный период, предусмотренный пунктом 40 Правил, была ниже зарегистрированной на этот период цены не более чем на прогнозируемый уровень инфляции, установленный на текущий год федеральным законом о федеральном бюджете на соответствующий финансовый год и плановый период;
в) если предельная отпускная цена на лекарственный препарат иностранного производства при ее перерегистрации не превышает минимальную отпускную цену на лекарственный препарат иностранного производства в иностранных государствах, указанных в приложении № 3 к настоящей методике, и в стране производителя, определенную в соответствии с разделом VII настоящей методики на основании расчета, предусмотренного приложением № 4 к настоящей методике, с учетом расходов по уплате таможенных сборов за совершение таможенных операций, связанных с выпуском товаров.
49. Предлагаемая к перерегистрации предельная отпускная цена на воспроизведенный лекарственный препарат не может превышать отпускную цену, рассчитанную в соответствии с настоящей методикой с учетом требований пункта 33 Правил.
50. Величина увеличения зарегистрированной предельной отпускной цены на лекарственный препарат иностранного производства при ее перерегистрации ( ) (процентов) с округлением до сотых определяется по формуле:
) (процентов) с округлением до сотых определяется по формуле:
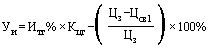 ,
,
где 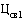 - средневзвешенная фактическая цена ввоза лекарственного препарата иностранного производства, ввезенного за отчетный период, предусмотренный пунктом 40 Правил, рассчитанная в соответствии с разделом VI настоящей методики (рублей).
- средневзвешенная фактическая цена ввоза лекарственного препарата иностранного производства, ввезенного за отчетный период, предусмотренный пунктом 40 Правил, рассчитанная в соответствии с разделом VI настоящей методики (рублей).
51. Величина увеличения зарегистрированной предельной отпускной цены на лекарственный препарат иностранного производства, первичная и (или) вторичная упаковка которого осуществляется или первичную и (или) вторичную упаковку которого планируется осуществлять в Российской Федерации, при ее перерегистрации определяется по формуле, приведенной в пункте 42 настоящей методики.
52. В случае если за отчетный период, предусмотренный пунктом 40 Правил, лекарственный препарат в рамках одного регистрационного удостоверения ввозился на территорию Российской Федерации иностранным производителем (импортером) и отгружался иностранным производителем, осуществлявшим первичную и (или) вторичную упаковку лекарственного препарата в Российской Федерации, расчет предельной отпускной цены производителя при ее перерегистрации осуществляется с одновременным применением средневзвешенной фактической цены ввоза и средневзвешенной фактической отпускной цены лекарственного препарата.
Одновременное применение средневзвешенной фактической цены ввоза и средневзвешенной фактической отпускной цены лекарственного препарата вместо применения отдельно средневзвешенной фактической цены ввоза лекарственного препарата и отдельно средневзвешенной фактической отпускной цены лекарственного препарата предусмотрено при перерегистрации предельной отпускной цены производителя на лекарственный препарат в случаях, предусмотренных пунктом 36 Правил, для расчетов в соответствии с подпунктом "б" пункта 48, пунктами 50 и 51 настоящей методики.
X. Расчет предельной отпускной цены производителя на лекарственный препарат при ее перерегистрации в целях снижения
53. Перерегистрация в целях снижения предельной отпускной цены производителя на лекарственный препарат проводится в случаях, предусмотренных подпунктом "а" пункта 44 Правил, в связи со снижением цены в иностранной валюте на лекарственный препарат в иностранных государствах, указанных в приложении № 3 к настоящей методике, и в стране производителя на основании расчета, предусмотренного приложением № 4 к настоящей методике, в случае, если рассчитанная в соответствии с разделом VII настоящей методики минимальная отпускная цена производителя на лекарственный препарат с учетом расходов по уплате таможенных сборов за совершение таможенных операций, связанных с выпуском товаров, ниже, чем зарегистрированная предельная отпускная цена на лекарственный препарат.
54. Перерегистрация предельной отпускной цены воспроизведенного, биоаналогового (биоподобного) лекарственного препарата проводится в случаях, предусмотренных подпунктом "б" пункта 44 Правил, в связи со снижением предельной отпускной цены референтного лекарственного препарата в случаях, предусмотренных подпунктом "а" пункта 44 Правил.
Перерегистрация в целях снижения предельной отпускной цены воспроизведенного, биоаналогового (биоподобного) лекарственного препарата осуществляется в случае, если зарегистрированная предельная отпускная цена воспроизведенного, биоаналогового (биоподобного) лекарственного препарата превышает цену референтного лекарственного препарата, перерегистрированную в целях снижения в соответствии с пунктом 53 настоящей методики. При этом предельная отпускная цена воспроизведенного, биоаналогового (биоподобного) лекарственного препарата подлежит снижению до минимальной отпускной цены производителя на референтный лекарственный препарат в иностранных государствах, указанных в приложении № 3 к настоящей методике, и в стране производителя на основании расчета, предусмотренного приложением № 4 к настоящей методике.
55. Перерегистрация предельной отпускной цены на воспроизведенный, биоаналоговый (биоподобный) лекарственный препарат иностранного производства, в том числе первичная и (или) вторичная упаковка которого осуществляется или первичную и (или) вторичную упаковку которого планируется осуществлять в Российской Федерации, проводится в случаях, предусмотренных подпунктом "в" пункта 44 Правил, на основании данных расчета предельных отпускных цен на воспроизведенные, биоаналоговые (биоподобные) лекарственные препараты, представляемых на государственную регистрацию в соответствии с приложением № 7 к настоящей методике в связи с государственной регистрацией второй цены на совпадающий по международному непатентованному наименованию, лекарственной форме и дозировке (концентрации, активности в единицах действия) воспроизведенный, биоаналоговый (биоподобный) лекарственный препарат.
Перерегистрация в целях снижения предельной отпускной цены на воспроизведенный, биоаналоговый (биоподобный) лекарственный препарат иностранного производства, в том числе первичная и (или) вторичная упаковка которого осуществляется или первичную и (или) вторичную упаковку которого планируется осуществлять в Российской Федерации, осуществляется в случае, если зарегистрированная предельная отпускная цена превышает цену, рассчитанную в качестве проекта предельной отпускной цены на воспроизведенный, биоаналоговый (биоподобный) лекарственный препарат в соответствии с разделом III настоящей методики.
56. Перерегистрация предельной отпускной цены воспроизведенного биоаналогового (биоподобного) лекарственного препарата производителя государства - члена Евразийского экономического союза проводится в случаях, предусмотренных подпунктом "г" пункта 44 Правил, на основании данных расчета предельных отпускных цен на воспроизведенные лекарственные препараты, представляемых на государственную регистрацию в соответствии с приложением № 7 к настоящей методике в связи с государственной регистрацией второй цены на совпадающий по международному непатентованному наименованию, лекарственной форме и дозировке (концентрации, активности в единицах действия) воспроизведенный биоаналоговый (биоподобный) лекарственный препарат производителя государства - члена Евразийского экономического союза.
Перерегистрация в целях снижения предельной отпускной цены воспроизведенного биоаналогового (биоподобного) лекарственного препарата производителя государства - члена Евразийского экономического союза осуществляется в случае, если зарегистрированная предельная отпускная цена превышает цену, рассчитанную в качестве проекта предельной отпускной цены на воспроизведенный лекарственный препарат производителя государства - члена Евразийского экономического союза в соответствии с разделом III настоящей методики.
57. Предельная отпускная цена на лекарственный препарат при перерегистрации в целях снижения устанавливается для каждого производителя в рамках регистрационного удостоверения лекарственного препарата в соответствии с требованиями пунктов 27, 28 и 32 Правил.
Приложение № 1
к методике расчета предельных отпускных
цен производителей на лекарственные
препараты, включенные в перечень жизненно
необходимых и важнейших лекарственных
препаратов для медицинского применения
СВЕДЕНИЯ
о наличии зарегистрированных предельных отпускных цен заявляемого лекарственного препарата1
_________________________________________________________________________________________
(наименование организации-заявителя)
I. Сведения о лекарственном препарате
| 1. Номер регистрационного удостоверения | |
|---|---|
| 2. Международное непатентованное, или группировочное, или химическое наименование | |
| 3. Торговое наименование | |
| 4. Лекарственная форма, дозировка (концентрация, активность в единицах действия) | |
| 5. Общее количество во вторичной (потребительской) упаковке |
| Владелец регистрационного удостоверения, производитель, упаковщик, организация, осуществляющая выпускающий контроль | Лекарственная форма, дозировка (концентрация, активность в единицах действия) | Количество во вторичной (потребительской) упаковке | Дата и номер приказа о государственной регистрации (перерегистрации) предельной отпускной цены | Зарегистрированная предельная отпускная цена производителя на лекарственный препарат (без НДС), рублей | ||
|---|---|---|---|---|---|---|
| за вторичную (потребительскую) упаковку | расчет за одну лекарственную форму | расчет за единицу действующего вещества | ||||
| 1 | 2 | 3 | 4 | 5 | 6 | 7 |
II. Расчет цены
| Значение, рассчитанное исходя из среднего арифметического значения последних зарегистрированных цен на ближайшие по значению количества лекарственного препарата во вторичной (потребительской) упаковке заявляемого лекарственного препарата, умноженное на количество лекарственного препарата во вторичной (потребительской) упаковке заявляемого лекарственного препарата (без НДС), рублей2 | Значение, рассчитанное исходя из среднего арифметического значения последних зарегистрированных цен на ближайшие по значению дозировки (концентрации, активности в единицах действия) заявляемого лекарственного препарата, умноженное на количество единиц действующего вещества заявляемого лекарственного препарата (без НДС), рублей3 | Расчетная предельная отпускная цена заявляемого лекарственного препарата за вторичную (потребительскую) упаковку (без НДС), рублей4 |
|---|---|---|
| Руководитель организации-заявителя | ____________ (подпись) | _____________ (фамилия, имя, отчество (при наличии) | _______________________________________ (телефон, адрес электронной почты) | ||
|---|---|---|---|---|---|
| Исполнитель | ____________ (подпись) | _____________ (фамилия, имя, отчество (при наличии) | _______________________________________ (телефон, адрес электронной почты) |
------------------------------
1 Указываются сведения обо всех регистрационных удостоверениях, лекарственных формах, дозировках (концентрациях, активности в единицах действия), упаковках, на которые зарегистрированы предельные отпускные цены заявляемого лекарственного препарата.
2 Рассчитывается в случае, указанном в подпункте "а" пункта 3 методики расчета предельных отпускных цен производителей на лекарственные препараты, включенные в перечень жизненно необходимых и важнейших лекарственных препаратов для медицинского применения, утвержденной постановлением Правительства Российской Федерации от 30 мая 2025 г. № 805 "Об утверждении методики расчета предельных отпускных цен производителей на лекарственные препараты, включенные в перечень жизненно необходимых и важнейших лекарственных препаратов для медицинского применения".
3 Рассчитывается в случае, указанном в подпункте "б" пункта 3 методики расчета предельных отпускных цен производителей на лекарственные препараты, включенные в перечень жизненно необходимых и важнейших лекарственных препаратов для медицинского применения, утвержденной постановлением Правительства Российской Федерации от 30 мая 2025 г. № 805 "Об утверждении методики расчета предельных отпускных цен производителей на лекарственные препараты, включенные в перечень жизненно необходимых и важнейших лекарственных препаратов для медицинского применения".
4 Указывается расчетная предельная отпускная цена лекарственного препарата для дозировки (концентрации, активности в единицах действия) и общего количества во вторичной (потребительской) упаковке, представленных в пунктах 4 и 5 раздела I настоящего приложения.
------------------------------
Приложение № 2
к методике расчета предельных отпускных
цен производителей на лекарственные
препараты, включенные в перечень жизненно
необходимых и важнейших лекарственных
препаратов для медицинского применения
Сведения
об объемах и отпускных ценах находящихся в обращении в Российской Федерации лекарственных препаратов производителя государства - члена Евразийского экономического союза и лекарственных препаратов иностранного производства, первичная и (или) вторичная упаковка которых осуществляется или первичную и (или) вторичную упаковку которых планируется осуществлять в Российской Федерации
за период с ___________ г. по ______________ г.1
_____________________________________________
(наименование организации-заявителя)
I. Сведения о лекарственном препарате
| 1. Номер регистрационного удостоверения | |
|---|---|
| 2. Международное непатентованное, или группировочное, или химическое наименование | |
| 3. Торговое наименование | |
| 4. Лекарственная форма, дозировка (концентрация, активность в единицах действия) | |
| 5. Общее количество во вторичной (потребительской) упаковке |
II. Расчет цены
| Количество отпущенного лекарственного препарата | Средневзвешенная фактическая отпускная цена лекарственного препарата за вторичную (потребительскую) упаковку (без НДС), рублей | Зарегистрированная предельная отпускная цена лекарственного препарата за вторичную (потребительскую) упаковку (без НДС), рублей2 | Проект предельной отпускной цены за вторичную (потребительскую) упаковку, предложенной на перерегистрацию (без НДС), рублей2 | Прогнозируемый уровень инфляции, установленный на текущий год, процентов2 | Увеличение предельной отпускной цены, процентов2 | |
|---|---|---|---|---|---|---|
| тыс. упаковок | тыс. рублей | |||||
| 1 | 2 | 3 | 4 | 5 | 6 | 7 |
III. Реестр отгрузок лекарственного препарата за период
с 20__ по 20__ год
| Торговое наименование (лекарственная форма, дозировка (концентрация, активность в единицах действия), количество во вторичной (потребительской) упаковке) | Производитель | Наименование поставщика | Номер товарной накладной | Дата товарной накладной | Количество отпущенного лекарственного препарата, упаковок | Цена за одну упаковку отпущенного лекарственного препарата (без НДС), рублей | Объем реализации лекарственного препарата (без НДС), тыс. рублей | Остаточный срок годности отпущенного лекарственного препарата, процентов |
|---|---|---|---|---|---|---|---|---|
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
| Итого |
 3
3
|
 4
4
|
||||||
| Средневзвешенная фактическая отпускная цена лекарственного препарата за вторичную (потребительскую) упаковку (без НДС), рублей |
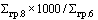
|
|||||||
| Руководитель организации-заявителя | ____________ (подпись) | _____________ (фамилия, имя, отчество (при наличии) | _______________________________________ (телефон, адрес электронной почты) | ||
|---|---|---|---|---|---|
| Исполнитель | ____________ (подпись) | _____________ (фамилия, имя, отчество (при наличии) | _______________________________________ (телефон, адрес электронной почты) |
------------------------------
1 Отчетный период при государственной регистрации предельной отпускной цены производителя на лекарственный препарат определяется в соответствии с пунктом 26 Правил государственной регистрации и перерегистрации предельных отпускных цен производителей на лекарственные препараты, включенные в перечень жизненно необходимых и важнейших лекарственных препаратов для медицинского применения, утвержденных постановлением Правительства Российской Федерации от 8 апреля 2025 г. № 462 "О государственном регулировании цен на лекарственные препараты, включенные в перечень жизненно необходимых и важнейших лекарственных препаратов для медицинского применения", отчетный период при перерегистрации предельной отпускной цены производителя на лекарственный препарат определяется в соответствии с пунктом 40 указанных Правил.
2 Заполняется при перерегистрации предельной отпускной цены производителя на лекарственный препарат в случаях, предусмотренных подпунктом "г" пункта 34 и пунктом 36 Правил государственной регистрации и перерегистрации предельных отпускных цен производителей на лекарственные препараты, включенные в перечень жизненно необходимых и важнейших лекарственных препаратов для медицинского применения, утвержденных постановлением Правительства Российской Федерации от 8 апреля 2025 г. № 462 "О государственном регулировании цен на лекарственные препараты, включенные в перечень жизненно необходимых и важнейших лекарственных препаратов для медицинского применения".
3 Указывается суммарное количество упаковок отпущенного лекарственного препарата за отчетный период, предусмотренный пунктом 26 или пунктом 40 Правил государственной регистрации и перерегистрации предельных отпускных цен производителей на лекарственные препараты, включенные в перечень жизненно необходимых и важнейших лекарственных препаратов для медицинского применения, утвержденных постановлением Правительства Российской Федерации от 8 апреля 2025 г. № 462 "О государственном регулировании цен на лекарственные препараты, включенные в перечень жизненно необходимых и важнейших лекарственных препаратов для медицинского применения".
4 Указывается суммарный объем реализации лекарственного препарата (в рублях) за отчетный период, предусмотренный пунктом 26 или пунктом 40 Правил государственной регистрации и перерегистрации предельных отпускных цен производителей на лекарственные препараты, включенные в перечень жизненно необходимых и важнейших лекарственных препаратов для медицинского применения, утвержденных постановлением Правительства Российской Федерации от 8 апреля 2025 г. № 462 "О государственном регулировании цен на лекарственные препараты, включенные в перечень жизненно необходимых и важнейших лекарственных препаратов для медицинского применения".
------------------------------
Примечание. Дополнительно в форме табличных данных (Excel) представляются данные об объемах реализации лекарственных препаратов по всем фактическим отпускным ценам за отчетный период в электронном виде.
Приложение № 3
к методике расчета предельных
отпускных цен производителей на
лекарственные препараты, включенные
в перечень жизненно необходимых
и важнейших лекарственных
препаратов для медицинского
применения
Перечень
иностранных государств, в отношении которых представляется информация об уровне минимальных отпускных цен на лекарственные препараты
1. Королевство Бельгия
2. Венгрия
3. Греческая Республика
4. Королевство Испания
5. Королевство Нидерландов
6. Республика Польша
7. Румыния
8. Словацкая Республика
9. Турецкая Республика
10. Французская Республика
11. Чешская Республика
Приложение № 4
к методике расчета предельных отпускных
цен производителей на лекарственные
препараты, включенные в перечень жизненно
необходимых и важнейших лекарственных
препаратов для медицинского применения
Расчет
предельной отпускной цены производителя на лекарственный препарат, представляемой на государственную регистрацию (перерегистрацию)
_________________________________________________________________________________________
(наименование организации-заявителя)
I. Сведения о лекарственном препарате
| 1. Номер регистрационного удостоверения | |
|---|---|
| 2. Международное непатентованное, или группировочное, или химическое наименование | |
| 3. Торговое наименование | |
| 4. Лекарственная форма, дозировка (концентрация, активность в единицах действия) | |
| 5. Общее количество во вторичной (потребительской) упаковке |
II. Расчет цены
| Код ТН ВЭД ЕАЭС | Минимальная отпускная цена производителя на лекарственный препарат в стране производителя и в других иностранных государствах1 | Проект отпускной цены "поставка без оплаты таможенной пошлины и сборов за таможенное оформление", рублей2 | Действующая ставка таможенной пошлины2 | Сборы за таможенное оформление, рублей2 | Проект расчетной предельной отпускной цены производителя с учетом расходов по уплате таможенных сборов за совершение таможенных операций, связанных с выпуском товаров (без НДС), рублей | ||
|---|---|---|---|---|---|---|---|
| наименование иностранного государства | цена, рублей | процентов | рублей | ||||
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
III. Сведения об уровне минимальных цен
| Торговое наименование лекарственного препарата | Лекарственная форма, дозировка (концентрация, активность в единицах действия) | Количество во вторичной (потребительской) упаковке | Минимальная отпускная цена по графам 7-18, рублей | Минимальная отпускная цена производителя на лекарственный препарат, рублей3 | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| за упаковку | расчет за одну лекарственную форму | расчет за единицу действующего вещества | Королевство Бельгия | Венгрия | Греческая Республика | Королевство Испания | Королевство Нидерландов | Республика Польша | Румыния | Словацкая Республика | Турецкая Республика | Французская Республика | Чешская Республика | Страна производителя | |||
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
Итоговые значения
| Минимальная расчетная отпускная цена производителя за одну лекарственную форму, рублей4 | Минимальная расчетная отпускная цена производителя за единицу действующего вещества лекарственного препарата5, рублей | Минимальная отпускная цена производителя на лекарственный препарат в стране производителя и в других странах (с учетом пересчета), рублей | Название страны с минимальной отпускной ценой на лекарственный препарат6 | Особенности7 |
|---|---|---|---|---|
IV. Курс валют для расчета минимальных отпускных цен на лекарственные препараты
за период с _____________ г. по _______________ г.
| Страна | Наименование валюты | Средний курс валюты8 |
|---|---|---|
| 1 | 2 | 3 |
| Руководитель организации-заявителя | ____________ (подпись) | _____________ (фамилия, имя, отчество (при наличии) | _______________________________________ (телефон, адрес электронной почты) | ||
|---|---|---|---|---|---|
| Исполнитель | ____________ (подпись) | _____________ (фамилия, имя, отчество (при наличии) | _______________________________________ (телефон, адрес электронной почты) |
------------------------------
1 Указываются данные из графы "Минимальная отпускная цена производителя на лекарственный препарат в стране производителя и в других странах (с учетом пересчета), рублей" подраздела "Итоговые значения" раздела III настоящего приложения и иностранное государство, цена которого использовалась для расчета.
2 Не заполняется для лекарственных препаратов производителя государства - члена Евразийского экономического союза и лекарственных препаратов иностранного производства, первичная и (или) вторичная упаковка которых осуществляется или первичную и (или) вторичную упаковку которых планируется осуществлять в Российской Федерации.
3 Расчет цены производится путем пересчета цены лекарственного препарата в иностранной валюте в рубли по курсу, указываемому в разделе IV настоящего приложения.
4 Рассчитывается в случае государственной регистрации (перерегистрации) предельной отпускной цены на лекарственный препарат с количеством лекарственного препарата во вторичной (потребительской) упаковке (количеством доз в упаковке, объемом), которое отсутствует в референтных странах.
5 Рассчитывается в случае государственной регистрации (перерегистрации) предельной отпускной цены на лекарственный препарат с дозировкой (концентрацией, активностью в единицах действия), которая отсутствует в референтных странах.
6 Указывается название страны, отпускная цена на лекарственный препарат в которой является минимальной среди цен на лекарственный препарат в референтных странах.
7 В случае если цены в отдельных странах определяются на основе межгосударственных соглашений по вопросам поставки лекарственного препарата, необходимо указать особенности формирования этих цен. При этом не учитываются цены на лекарственные препараты, поставляемые за счет международных финансовых организаций (фондов) по решению Всемирной организации здравоохранения.
8 Рассчитывается по среднему курсу национальной валюты к рублю Российской Федерации, установленному Центральным банком Российской Федерации за 3 календарных месяца, предшествующие месяцу даты подачи заявления, в целях государственной регистрации или перерегистрации предельных отпускных цен на лекарственный препарат.
------------------------------
Приложение № 5
к методике расчета предельных отпускных
цен производителей на лекарственные
препараты, включенные в перечень жизненно
необходимых и важнейших лекарственных
препаратов для медицинского применения
Расчет
предельной отпускной пены на воспроизведенный, биоаналоговый (биоподобный) лекарственный препарат, представляемой на государственную регистрацию
_________________________________________________________________________________________
(наименование организации-заявителя)
I. Сведения о лекарственном препарате
| 1. Номер регистрационного удостоверения | |
|---|---|
| 2. Международное непатентованное, или группировочное, или химическое наименование | |
| 3. Торговое наименование | |
| 4. Лекарственная форма, дозировка (концентрация, активность в единицах действия) | |
| 5. Общее количество во вторичной (потребительской) упаковке |
II. Расчет цены
| Производитель |
Зарегистрированная предельная отпускная цена на референтный лекарственный препарат (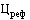 ) или на лекарственный препарат с максимальной зарегистрированной предельной отпускной ценой (
) или на лекарственный препарат с максимальной зарегистрированной предельной отпускной ценой ( )
)
|
Коэффициент пересчета дозировки (концентрации, активности в единицах действия) (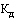 или
или 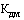 )1
)1
|
Коэффициент пересчета фасовки
( или
или  )1
)1
|
Понижающий коэффициент ( или
или  )1
)1
|
Расчетная предельная отпускная цена на воспроизведенный, биоаналоговый (биоподобный) лекарственный препарат без НДС ( или
или 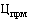 ), рублей
), рублей
|
||||
|---|---|---|---|---|---|---|---|---|---|
| производитель | наименование лекарственного препарата | лекарственная форма, дозировка (концентрация, активность в единицах действия) | количество во вторичной (потребительской) упаковке |
зарегистрированная предельная отпускная цена без НДС
( или
или  ), рублей1
), рублей1
|
|||||
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| Руководитель организации-заявителя | ____________ (подпись) | _____________ (фамилия, имя, отчество (при наличии) | _______________________________________ (телефон, адрес электронной почты) | ||
|---|---|---|---|---|---|
| Исполнитель | ____________ (подпись) | _____________ (фамилия, имя, отчество (при наличии) | _______________________________________ (телефон, адрес электронной почты) |
------------------------------
1 Определяется в соответствии с разделом III методики расчета предельных отпускных цен производителей на лекарственные препараты, включенные в перечень жизненно необходимых и важнейших лекарственных препаратов для медицинского применения, утвержденной постановлением Правительства Российской Федерации от 30 мая 2025 г. № 805 "Об утверждении методики расчета предельных отпускных цен производителей на лекарственные препараты, включенные в перечень жизненно необходимых и важнейших лекарственных препаратов для медицинского применения".
------------------------------
Приложение № 6
к методике расчета предельных отпускных
цен производителей на лекарственные
препараты, включенные в перечень жизненно
необходимых и важнейших лекарственных
препаратов для медицинского применения
Формулы
расчета понижающих коэффициентов, применяемых при расчете предельной отпускной цены производителя на первый воспроизведенный, биоаналоговый (биоподобный) лекарственный препарат, а также воспроизведенный, биоаналоговый (биоподобный) орфанный лекарственный препарат, представляемой на государственную регистрацию
Зарегистрированная предельная отпускная цена за вторичную (потребительскую) упаковку лекарственного препарата, рублей
( или
или  )
)
|
Понижающий коэффициент для расчета цены на первый воспроизведенный лекарственный препарат ( или
или  )
)
|
Понижающий коэффициент для расчета цены на первый биоаналоговый (биоподобный) лекарственный препарат, а также воспроизведенный, биоаналоговый (биоподобный) орфанный лекарственный препарат
(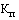 или
или 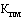 )
)
|
||
|---|---|---|---|---|
| производителя государства - члена Евразийского экономического союза, процентов | иностранного производства, процентов1 | производителя государства - члена Евразийского экономического союза, процентов | иностранного производства, процентов1 | |
| До 100 рублей (включительно) | 0 | 0 | 0 | 0 |
| От 100 до 500 рублей (включительно) | 0 |
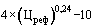 или
или
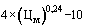
|
0 | 0 |
| От 500 до 100000 рублей2 (включительно) |
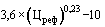 или
или

|
 или
или

|
 или
или

|
 или
или
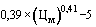
|
| Свыше 100000 рублей | 40 | 55 | 25 | 40 |
------------------------------
1 Лекарственные препараты иностранного производства, в том числе первичная и (или) вторичная упаковка которых осуществляется или первичную и (или) вторичную упаковку которых планируется осуществлять в Российской Федерации.
2 В случае если рассчитанный понижающий коэффициент превышает понижающий коэффициент, предусмотренный для ценовой категории свыше 100000 рублей, применяется понижающий коэффициент, предусмотренный для ценовой категории свыше 100000 рублей.
------------------------------
Приложение № 7
к методике расчета предельных отпускных
цен производителей на лекарственные
препараты, включенные в перечень жизненно
необходимых и важнейших лекарственных
препаратов для медицинского применения
Формулы
расчета понижающих коэффициентов, применяемых при расчете предельной отпускной цены производителя на воспроизведенный, биоаналоговый (биоподобный) лекарственный препарат, представляемой на государственную регистрацию
Зарегистрированная предельная отпускная цена за вторичную (потребительскую) упаковку лекарственного препарата, рублей
( или
или 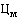 )
)
|
Понижающий коэффициент для расчета цены на воспроизведенный лекарственный препарат
(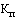 или
или 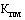 )
)
|
Понижающий коэффициент для расчета цены на биоаналоговый (биоподобный) лекарственный препарат
( или
или  )
)
|
||
|---|---|---|---|---|
| производителя государства - члена Евразийского экономического союза, процентов | иностранного производства, процентов1 | производителя государства - члена Евразийского экономического союза, процентов | иностранного производства, процентов1 | |
| До 100 рублей (включительно) | 0 | 0 | 0 | 0 |
| От 100 до 500 рублей (включительно) |
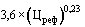 или
или

|
 или
или

|
0 | 0 |
| От 500 до 100000 рублей2 (включительно) |
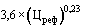 или
или

|
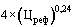 или
или

|
 или
или

|
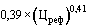 или
или
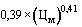
|
| Свыше 100000 рублей | 50 | 65 | 30 | 45 |
------------------------------
1 Лекарственные препараты иностранного производства, в том числе первичная и (или) вторичная упаковка которых осуществляется или первичную и (или) вторичную упаковку которых планируется осуществлять в Российской Федерации.
2 В случае если рассчитанный понижающий коэффициент превышает понижающий коэффициент, предусмотренный для ценовой категории свыше 100000 рублей, применяется понижающий коэффициент, предусмотренный для ценовой категории свыше 100000 рублей.
------------------------------
Приложение № 8
к методике расчета предельных отпускных
цен производителей на лекарственные
препараты, включенные в перечень жизненно
необходимых и важнейших лекарственных
препаратов для медицинского применения
Расчет и обоснование
расходов, связанных с разработкой, производством и реализацией лекарственного препарата производителя государства - члена Евразийского экономического союза, представляемой на перерегистрацию предельной отпускной цены на лекарственный препарат
_________________________________________________________________________________________
(наименование организации-заявителя)
I. Сведения о лекарственном препарате
| 1. Номер регистрационного удостоверения | |
|---|---|
| 2. Международное непатентованное, или группировочное, или химическое наименование | |
| 3. Торговое наименование | |
| 4. Лекарственная форма, дозировка (концентрация, активность в единицах действия) | |
| 5. Общее количество во вторичной (потребительской) упаковке |
II. Расчет цены
| Производитель | Прямые расходы | Общепроизводственные расходы | Общехозяйственные расходы | Прибыль2 | Рентабельность, процентов2 | Фактическая отпускная цена на вторичную (потребительскую) упаковку (без НДС), рублей3 | Проект отпускной цены на лекарственный препарат за вторичную (потребительскую) упаковку (без НДС), рублей | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| материалы | сырье | заработная плата | заработная плата общепроизводственного и вспомогательного персонала | электроэнергия, теплоснабжение, водоснабжение и топливо | амортизация основных средств, используемых для производства | прочие производственные1 | разработка | реализация | прочие хозяйственные1 | |||||||||||||||||
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | ||||||||||||
| факт | план | факт | план | факт | план | факт | план | факт | план | факт | план | факт | план | факт | план | факт | план | факт | план | факт | план | факт | план | |||
| Руководитель организации-заявителя | ____________ (подпись) | _____________ (фамилия, имя, отчество (при наличии) | _______________________________________ телефон, адрес электронной почты) | ||
|---|---|---|---|---|---|
| Исполнитель | ____________ (подпись) | _____________ (фамилия, имя, отчество (при наличии) | _______________________________________ (телефон, адрес электронной почты) |
III. Планируемый объем выпуска лекарственного препарата,
его удельный вес в общем объеме производимых лекарственных препаратов, в натуральном и стоимостном выражении
| Наименование лекарственного препарата, дозировка (концентрация, активность в единицах действия) и количество во вторичной (потребительской) упаковке, производитель | Единица измерения | Планируемый объем выпуска, в натуральном выражении (количество единиц измерения) | Планируемый объем выпуска, в стоимостном выражении (без НДС), рублей | Удельный вес лекарственного препарата в общем объеме производимых лекарственных препаратов, в натуральном выражении, процентов | Удельный вес лекарственного препарата в общем объеме производимых лекарственных препаратов, в стоимостном выражении (без НДС), рублей |
|---|---|---|---|---|---|
| 1 | 2 | 3 | 4 | 5 | 6 |
IV. Калькуляция затрат материалов
по производству одной вторичной (потребительской) упаковки
(графа 2 раздела II настоящего приложения)
_________________________________________________________________________________________
(наименование препарата, дозировка (концентрация, активность в единицах действия),
количество лекарственного препарата во вторичной (потребительской) упаковке)
| № | Расходы на материалы | Единица измерения | Норма расхода (согласно техническому регламенту предприятия) | Цена фактической закупки (без НДС), рублей4 | Сумма затрат на одну вторичную (потребительскую) упаковку (без НДС), рублей | |||
|---|---|---|---|---|---|---|---|---|
| 1 | 2 | 3 | 4 | 5 | 6 | |||
| факт | план | факт | план | факт | план | |||
| Итого5 | ||||||||
V. Опись документального подтверждения расходов на материалы
(графа 2 раздела II настоящего приложения)
| Наименование материала | Наименование поставщика | Номер и дата товарной накладной, или грузовой таможенной декларации, или иного вида документального подтверждения | ||
|---|---|---|---|---|
| 1 | 2 | 3 | ||
| факт | план | факт | план | |
VI. Калькуляция затрат на сырье
по производству одной вторичной (потребительской) упаковки
(графа 3 раздела II настоящего приложения)
_________________________________________________________________________________________
(наименование препарата, дозировка (концентрация, активность в единицах действия),
количество лекарственного препарата во вторичной (потребительской) упаковке)
| Статьи расходов на сырье | Единица измерения | Норма расхода (согласно техническому регламенту предприятия) | Цена фактической закупки (без НДС), рублей6 | Сумма затрат на одну вторичную (потребительскую) упаковку (без НДС), рублей | ||
|---|---|---|---|---|---|---|
| 1 | 2 | 3 | 4 | 5 | ||
| факт | план | факт | план | |||
| Активная фармацевтическая субстанция | ||||||
| Вспомогательные вещества | ||||||
| Итого7 | ||||||
VII. Информация
об активной фармацевтической субстанции
(графа 3 раздела II настоящего приложения)
| № | Наименование активной фармацевтической субстанции | Удельный вес активной фармацевтической субстанции в статье "Сырье" за отчетный период, в натуральном выражении, процентов | Производитель активной фармацевтической субстанции | Страна производства активной фармацевтической субстанции | Поставщик активной фармацевтической субстанции | Единица измерения активной фармацевтической субстанции | Цена активной фармацевтической субстанции (с учетом расходов по уплате таможенных сборов за совершение таможенных операций, связанных с выпуском товаров), без НДС | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| в валюте (указывается вид валюты) | в рублях (в пересчете на дату таможенной декларации, или товарной накладной, или иного вида документального подтверждения) | |||||||||||||||
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | ||||||||
| факт | план | факт | план | факт | план | факт | план | факт | план | факт | план | факт | план | факт | план | |
VIII. Опись
документального подтверждения расходов на сырье
(графа 3 раздела II настоящего приложения)
| Наименование фармацевтической субстанции или вспомогательного вещества | Наименование поставщика | Номер и дата товарной накладной или грузовой таможенной декларации | ||
|---|---|---|---|---|
| 1 | 2 | 3 | ||
| факт | план | факт | план | |
IX. Расшифровка затрат по статье "Заработная плата"
(графа 4 раздела II настоящего приложения)
| Наименование структурного подразделения | Оплата труда по 20 счету, рублей | Страховые взносы по 20 счету, рублей8 | Страховые взносы на обязательное социальное страхование от несчастных случаев на производстве и профессиональных заболеваний по 20 счету, рублей | Итого (без НДС), рублей | ||||
|---|---|---|---|---|---|---|---|---|
| 1 | 2 | 3 | 4 | 5 | ||||
| факт | план | факт | план | факт | план | факт | план | |
| Заработная плата работников, занятых непосредственно на производстве лекарственного препарата | ||||||||
| Итого | ||||||||
| В расчете на одну вторичную (потребительскую) упаковку9 | ||||||||
X. Расшифровка затрат
(графы 5-8 раздела II настоящего приложения)
Расшифровка затрат по статье "Заработная плата общепроизводственного и вспомогательного персонала"
(графа 5 раздела II настоящего приложения)
| Наименование структурного подразделения | Оплата труда по 25 счету, рублей | Страховые взносы по 25 счету, рублей10 | Страховые взносы на обязательное социальное страхование от несчастных случаев на производстве и профессиональных заболеваний по 25 счету, рублей | Итого (без НДС), рублей | ||||
|---|---|---|---|---|---|---|---|---|
| 1 | 2 | 3 | 4 | 5 | ||||
| факт | план | факт | план | факт | план | факт | план | |
| Итого | ||||||||
| В расчете на одну вторичную (потребительскую) упаковку11 | ||||||||
Расшифровка затрат по статье "Электроэнергия, теплоснабжение, водоснабжение и топливо"
(графа 6 раздела II настоящего приложения)
| Статья затрат | Поставщик | Стоимость услуг (без НДС), рублей | ||
|---|---|---|---|---|
| 1 | 2 | 3 | ||
| факт | план | факт | план | |
| 1. Электроэнергия | ||||
| 2. Теплоснабжение | ||||
| 3. Водоснабжение | ||||
| 4. Топливо | ||||
| Итого | ||||
| В расчете на одну вторичную (потребительскую) упаковку12 | ||||
Расшифровка затрат по статье "Амортизация основных средств, используемых для производства"
(графа 7 раздела II настоящего приложения)
| № | Основные средства | Амортизация (без НДС), рублей | ||
|---|---|---|---|---|
| 1 | 2 | 3 | ||
| факт | план | факт | план | |
| Итого | ||||
| В расчете на одну вторичную (потребительскую) упаковку13 | ||||
Расшифровка затрат по статье "Прочие производственные расходы"
(графа 8 раздела II настоящего приложения)
| № | Статья расходов | Поставщик услуги | Стоимость услуг (без НДС), рублей | |||
|---|---|---|---|---|---|---|
| 1 | 2 | 3 | 4 | |||
| факт | план | факт | план | факт | план | |
| Итого | ||||||
| В расчете на одну вторичную (потребительскую) упаковку14 | ||||||
XI. Расшифровка затрат
(графы 9-11 раздела II настоящего приложения)
Расшифровка затрат по статье "Разработка"
(графа 9 раздела II настоящего приложения)
| Статья расходов | Поставщик услуги | Стоимость услуг (без НДС), рублей | ||
|---|---|---|---|---|
| 1 | 2 | 3 | ||
| факт | план | факт | план | |
| 1. Разработка конкретного лекарственного препарата, в том числе собственные расходы предприятия | ||||
| 2. Регистрационные процедуры, в том числе доклинические исследования лекарственных средств и клинические исследования лекарственного препарата | ||||
| 3. Прочие расходы | ||||
| Итого | ||||
| В расчете на одну вторичную (потребительскую) упаковку15 | ||||
Расшифровка затрат по статье "Реализация"
(графа 10 раздела II настоящего приложения)
| № | Статья расходов | Поставщик услуг | Стоимость услуг (без НДС), рублей | |||
|---|---|---|---|---|---|---|
| 1 | 2 | 3 | 4 | |||
| факт | план | факт | план | факт | план | |
| Итого | ||||||
| В расчете на одну вторичную (потребительскую) упаковку16 | ||||||
Расшифровка затрат по статье "Прочие хозяйственные расходы"
(графа 11 раздела II настоящего приложения)
| № | Статья расходов | Поставщик услуги | Стоимость услуг (без НДС), рублей | |||
|---|---|---|---|---|---|---|
| 1 | 2 | 3 | 4 | |||
| факт | план | факт | план | факт | план | |
| Итого | ||||||
| В расчете на одну вторичную (потребительскую) упаковку17 | ||||||
------------------------------
1 Относятся на затраты, которые напрямую не связаны с основным производством.
2 Прибыль и рентабельность продукции (графы 12 и 13 раздела II настоящего приложения) определяются в соответствии с разделом V методики расчета предельных отпускных цен производителей на лекарственные препараты, включенные в перечень жизненно необходимых и важнейших лекарственных препаратов для медицинского применения, утвержденной постановлением Правительства Российской Федерации от 30 мая 2025 г. № 805 "Об утверждении методики расчета предельных отпускных цен производителей на лекарственные препараты, включенные в перечень жизненно необходимых и важнейших лекарственных препаратов для медицинского применения".
3 Заполняется для лекарственных препаратов, находившихся в обращении на территории Российской Федерации.
4 В случае отсутствия закупки материалов, необходимых для производства конкретного лекарственного препарата, представляются сведения по аналогичным по своим характеристикам материалам, закупаемым для производства иных жизненно необходимых и важнейших лекарственных препаратов, цены на которые ранее зарегистрированы.
5 В расчете на одну вторичную (потребительскую) упаковку.
6 В случае отсутствия закупки вспомогательных веществ, используемых при производстве конкретного лекарственного препарата, представляются сведения по этим же вспомогательным веществам, закупаемым для производства иных жизненно необходимых и важнейших лекарственных препаратов, цены на которые ранее зарегистрированы.
7 В расчете на одну вторичную (потребительскую) упаковку.
8 Учитываются страховые взносы на обязательное социальное страхование на случай временной нетрудоспособности и в связи с материнством, обязательное пенсионное страхование, обязательное медицинское страхование.
9 Рассчитывается путем деления итогового значения (в рублях) на планируемый или фактический объем выпуска препарата в соответствии с разделом VIII методики расчета предельных отпускных цен производителей на лекарственные препараты, включенные в перечень жизненно необходимых и важнейших лекарственных препаратов для медицинского применения, утвержденной постановлением Правительства Российской Федерации от 30 мая 2025 г. № 805 "Об утверждении методики расчета предельных отпускных цен производителей на лекарственные препараты, включенные в перечень жизненно необходимых и важнейших лекарственных препаратов для медицинского применения".
10 Учитываются страховые взносы на обязательное социальное страхование на случай временной нетрудоспособности и в связи с материнством, обязательное пенсионное страхование, обязательное медицинское страхование.
11-17 Указывается формула, в соответствии с которой рассчитывается цена на одну вторичную (потребительскую) упаковку.
------------------------------
Примечание. Допускается включение в раздел XI дополнительных сведений, учитывающих способ отнесения общепроизводственных и общехозяйственных расходов в соответствии с учетной политикой организации.
Приложение № 9
к методике расчета предельных отпускных
цен производителей на лекарственные
препараты, включенные в перечень жизненно
необходимых и важнейших лекарственных
препаратов для медицинского применения
Значения
коэффициента ценовой группы, применяемого при расчете предельных отпускных цен производителей на лекарственные препараты, представляемых на перерегистрацию
| Ценовая группа |
Коэффициент ценовой группы (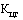 ),
процентов
),
процентов
|
|---|---|
| До 100 рублей (включительно) | 100 |
| От 100 до 500 рублей (включительно) | 90 |
| От 500 до 1000 рублей (включительно) | 85 |
| От 1000 до 3000 рублей (включительно) | 80 |
| От 3000 до 5000 рублей (включительно) | 75 |
| От 5000 до 10000 рублей (включительно) | 70 |
| От 10000 до 20000 рублей (включительно) | 60 |
| От 20000 до 40000 рублей (включительно) | 50 |
| От 40000 до 100000 рублей (включительно) | 40 |
| Свыше 100000 рублей | 30 |
Приложение № 10
к методике расчета предельных отпускных
цен производителей на лекарственные
препараты, включенные в перечень жизненно
необходимых и важнейших лекарственных
препаратов для медицинского применения
Обоснование расчета
предельной отпускной цены на лекарственный препарат иностранного производства, в том числе первичная и (или) вторичная упаковка которого осуществляется или первичную и (или) вторичную упаковку которого планируется осуществлять в Российской Федерации, представляемой на перерегистрацию,
за период с ________ г. по _________ г.1
_____________________________________________
(наименование организации-заявителя)
I. Сведения о лекарственном препарате
| 1. Номер регистрационного удостоверения | |
|---|---|
| 2. Международное непатентованное, или группировочное, или химическое наименование | |
| 3. Торговое наименование | |
| 4. Лекарственная форма, дозировка (концентрация, активность в единицах действия) | |
| 5. Общее количество во вторичной (потребительской) упаковке |
| Производитель (с указанием стадии производства) | Наименование национальной валюты государства-производителя | Курс национальной валюты государства-производителя к рублю (рублей) | Средневзвешенная фактическая цена ввоза или средневзвешенная фактическая отпускная цена лекарственного препарата, рублей2 | Величина увеличения предельной отпускной цены, процентов3 | Предельная отпускная цена за вторичную (потребительскую) упаковку (без НДС), рублей | ||||
|---|---|---|---|---|---|---|---|---|---|
| курс при государственной регистрации (последней регистрации) | курс при перерегистрации | процент увеличения | зарегистрированная4 | заявленная5 | процент увеличения | ||||
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| Руководитель организации-заявителя | ____________ (подпись) | _____________ (фамилия, имя, отчество (при наличии) | _______________________________________ (телефон, адрес электронной почты) | ||
|---|---|---|---|---|---|
| Исполнитель | ____________ (подпись) | _____________ (фамилия, имя, отчество (при наличии) | _______________________________________ (телефон, адрес электронной почты) |
------------------------------
1 Отчетный период при перерегистрации предельной отпускной цены производителя на лекарственный препарат определяется в соответствии с пунктом 40 Правил государственной регистрации и перерегистрации предельных отпускных цен производителей на лекарственные препараты, включенные в перечень жизненно необходимых и важнейших лекарственных препаратов для медицинского применения, утвержденных постановлением Правительства Российской Федерации от 8 апреля 2025 г. № 462 "О государственном регулировании цен на лекарственные препараты, включенные в перечень жизненно необходимых и важнейших лекарственных препаратов для медицинского применения".
2 При перерегистрации предельной отпускной цены на лекарственный препарат иностранного производства указывается средневзвешенная фактическая цена ввоза лекарственного препарата. При перерегистрации предельной отпускной цены на лекарственный препарат иностранного производства, первичная и (или) вторичная упаковка которого осуществляется или первичную и (или) вторичную упаковку которого планируется осуществлять в Российской Федерации, указывается средневзвешенная фактическая отпускная цена лекарственного препарата. Дополнительно в форме табличных данных (Excel) представляют данные об объемах реализации лекарственных препаратов по всем фактическим отпускным ценам за отчетный период в электронном виде и расчет средневзвешенной фактической цены ввоза или средневзвешенной фактической отпускной цены лекарственного препарата, произведенный с учетом требований раздела VI методики расчета предельных отпускных цен производителей на лекарственные препараты, включенные в перечень жизненно необходимых и важнейших лекарственных препаратов для медицинского применения, утвержденной постановлением Правительства Российской Федерации от 30 мая 2025 г. № 805 "об утверждении методики расчета предельных отпускных цен производителей на лекарственные препараты, включенные в перечень жизненно необходимых и важнейших лекарственных препаратов для медицинского применения".
3 Рассчитывается в соответствии с пунктами 49 - 51 методики расчета предельных отпускных цен производителей на лекарственные препараты, включенные в перечень жизненно необходимых и важнейших лекарственных препаратов для медицинского применения, утвержденной постановлением Правительства Российской Федерации от 30 мая 2025 г. № 805 "Об утверждении методики расчета предельных отпускных цен производителей на лекарственные препараты, включенные в перечень жизненно необходимых и важнейших лекарственных препаратов для медицинского применения".
4 Предельная отпускная цена производителя на лекарственный препарат, зарегистрированная по состоянию на дату подачи заявления о перерегистрации предельной отпускной цены.
5 Заявленная к перерегистрации предельная отпускная цена производителя на лекарственный препарат.
Обзор документа
В рамках "регуляторной гильотины" установлена новая методика расчета предельных отпускных цен производителей на жизненно необходимые и важнейшие лекарства при их регистрации и перерегистрации. Цена устанавливается для каждого производителя в рамках регистрационного удостоверения препарата.
Указан порядок расчета цены на референтный, воспроизведенный и биоаналоговый (биоподобный) препараты при ее регистрации, средневзвешенной фактической цены на препарат ЕАЭС и зарубежный препарат, первичная или вторичная упаковка которых осуществляется или планируется в России, рентабельности препарата ЕАЭС при перерегистрации цены, средневзвешенной фактической цены ввоза зарубежного препарата в Россию, минимальной цены в некоторых странах и в стране производителя, цены на препарат ЕАЭС при ее перерегистрации, а также цены при ее перерегистрации для снижения.
Постановление вступает в силу с 1 сентября 2025 г. и действует до 1 сентября 2031 г.

(1).jpg)


