Проект Приказа Федеральной службы по ветеринарному и фитосанитарному надзору "Об утверждении форм проверочных листов (список контрольных вопросов), используемых должностными лицами территориальных органов Федеральной службы по ветеринарной и фитосанитарному надзору при проведении плановых проверок в рамках осуществления федерального государственного надзора в сфере обращения лекарственных средств для ветеринарного применения" (подготовлен Россельхознадзором 20.11.2017)
Досье на проект
В соответствии с частью 11.3 статьи 9 Федерального закона от 26.12.2008 N294-ФЗ "О защите прав юридических лиц и индивидуальных предпринимателей при осуществлении государственного контроля (надзора) и муниципального контроля" (Собрание законодательства Российской Федерации , 2008, N52, ст.6249; 2016, N27, ст. 4210), постановлением Правительства Российской Федерации от 13.02.2017 N177 "Об утверждении общих требований к разработке и утверждению проверочных листов (списков контрольных вопросов)" (Собрание законодательства Российской Федерации, 2017, N9, ст. 1359) приказываю:
1. Утвердить:
Формы проверочных листов (списков контрольных вопросов), используемых должностными лицами территориальных органов Россельхознадзора при проведении плановых проверок в рамках осуществления федерального государственного надзора в сфере обращения лекарственных средств для ветеринарного применения, согласно приложениям к настоящему приказу.
2. Контроль за исполнением настоящего приказа оставляю за собой.
| Заместитель Руководителя | Н.А. Власов |
___________________________________________________________________________________
наименование органа государственного контроля (надзора)
_______________________________________________________________________________________
вид государственного контроля (надзора
Проверочный лист (список контрольных вопросов)
По адресу/адресам:
_________________________________________________________________________________________________________
________________________________________________________________________________________________________
(место проведения проверки)
На основании:
________________________________________________________________________________________________________
________________________________________________________________________________________________________
(вид документа с указанием реквизитов (номер, дата))
была проведена плановая проверка в отношении:
________________________________________________________________________________________________________
________________________________________________________________________________________________________
________________________________________________________________________________________________________
(наименование юридического лица, фамилия, имя, отчество (последнее - при наличии) индивидуального предпринимателя)
________________________________________________________________________________________________________
________________________________________________________________________________________________________
(учетный номер проверки и дата присвоения учетного номера проверки в едином реестре проверок)
Лицо(а), проводившее проверку:
________________________________________________________________________________________________________
________________________________________________________________________________________________________
________________________________________________________________________________________________________
________________________________________________________________________________________________________
________________________________________________________________________________________________________
(фамилия, имя, отчество (последнее - при наличии), должность должностного лица (должностных лиц), проводившего(их) проверку; в случае привлечения к участию в проверке экспертов, экспертных организаций указываются фамилии, имена, отчества (последнее - при наличии), должности экспертов и/или наименования экспертных организаций с указанием реквизитов свидетельства об аккредитации и наименование органа по аккредитации, выдавшего свидетельство)
При проведении проверки присутствовали:
________________________________________________________________________________________________________
________________________________________________________________________________________________________
________________________________________________________________________________________________________
________________________________________________________________________________________________________
(фамилия, имя, отчество (последнее - при наличии), должность руководителя, иного должностного лица (должностных лиц) или уполномоченного представителя юридического лица, уполномоченного представителя индивидуального предпринимателя, уполномоченного представителя саморегулируемой организации (в случае проведения проверки члена саморегулируемой организации), присутствовавших при проведении мероприятий по проверке)
| № п/п | Перечень предъявляемых требований | Структурные элементы нормативных правовых актов и технических нормативных правовых актов | Да | Нет | Не требуется | Примечание |
|---|---|---|---|---|---|---|
| Фармацевтическая система качества | ||||||
| 1. | производитель производит лекарственные средства в соответствие с требованиями регистрационного досье | п. 5 Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| 2. | в наличии документ, подтверждающий проведение периодических обзоров функционирования фармацевтической системы качества со стороны руководства предприятия-производителя. | п.11. (1.6) Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| 3. | фармацевтическая система качества документально оформлена в виде руководства по качеству или аналогичного документа, содержащий описание системы управления качеством, включая ответственность руководства. | п.12. (1.7) Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| 4. | на все производственные процессы в наличии регламентирующие документы с отметкой об актуализации | п.14. а) (i) Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| 5. | все критические стадии производственного процесса и существенные изменения процесса прошли валидацию; | п.14. б) (ii) Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| 6. | Имеется достаточное количество помещений и площадей для хранения, производства и контроля качества лекарственных препаратов; в соответствии с документами и производственным досье. | п.14. в) (iii) Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| 7. | в наличии необходимое количество оборудования в соответствии с промышленными регламентами на производимые лекарственные средства | п.14. в) (iii) Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| 8. | все процедуры и инструкции утверждены должностными лицами; | п.14. в) (iii) Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| 9. | соблюдаются условия хранения и транспортировки, исходного сырья, промежуточной и готовой продукции, предусмотренные регистрационным досье на лекарственное средство и (или) производителем исходного сырья | п.14. в) (iii) Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| 10. | в инструкциях и процедурах описан подробный порядок действий применительно к выполняемой операции | п.14. г) (iv) Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| 11. | в процессе производства составляются записи, документально подтверждающие фактическое проведение этапов в соответствие с утвержденными процедурами | п.14. е) (vi) Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| 12. | имеются в наличии документы по расследованию отклонений | п.14. ж) (vii), п.16. г) (iv), п. 150 (5.15) Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| 13. | в наличии досье на каждую серию, включающее полную историю производства серии | п.14. з) (viii) Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| 14. | организована система отзыва любой серии лекарственных средств из обращения | п.14. к) (x) Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| 15. | наличие соответствующих помещений и оборудования для проведения контроля качества, позволяет проводить все методы контроля, указанные в регистрационном досье, промышленных регламентах на производимые лекарственные средства | п.16. a) (i) Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| 16. | наличие утвержденных методик для отбора проб, контроля и испытаний исходного сырья и упаковочных материалов, промежуточной, нерасфасованной и готовой продукции, а также для мониторинга условий производственной среды | п.16. a) (i) Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| 17. | отбор проб исходного сырья и упаковочных материалов, промежуточной, нерасфасованной и готовой продукции проведится аттестованным персоналом | п.16. б) (ii) Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| 18. | методики испытаний валидированы | п.16. в) (ii) Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| 19. | фармацевтические субстанции, используемые для производства лекарственных препаратов, соответствуют требованиям регистрационного досье | п.16. д) (v) Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| 20. | записи, оформленные по результатам контроля и испытаний исходного сырья и упаковочных материалов, промежуточной, нерасфасованной и готовой продукции, сопоставлены с требованиями спецификаций. | п.16. е) (vi) Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| 21. | оценка продукции должна включает обзор и оценку производственной документации и оценку отклонений от установленных процедур | п.16. е) (vi) Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| 22. | каждая серия лекарственных средств выпускается в гражданский оборот с письменного разрешения уполномоченного лица | п.16. ж) (viii), п. 5 (2.1) Приложение №16 Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| 23. | обзоры качества всех произведенных лекарственных средств проводятся и оформлены документально. | п.17. (1.10) Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| 24. | периодичность проведения обзоров качества соблюдается | п.17. (1.10) Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| 25. | обзоры качества содержат всю информацию, установленную пп. а)-д) п.18 Правил | п.18. Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| 26. | В случае если юридическое лицо, на имя которого выдано регистрационное удостоверение, не является производителем между ними заключено соглашение, определяющее обязанности сторон в отношении составления обзора качества и проведения мероприятий по итогам его оценки | п.21 Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| 27. | В наличии документы, подтверждающие проведение оценки рисков для качества лекарственного средства, их контроля, передачи информации, а также обзора в отношении указанных рисков. | п.22. (1.12) Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| Персонал | ||||||
| 28. | весь персонал обучен в соответствии с выполняемыми функциями по утвержденным программам | п.14. в (iii), д) (v), п.25. (2.1), п.33 (2.8), п. 2 (1) Приложение № 8 Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| 29. | производитель имеет документально оформленную организационную структуру | п.26. (2.2) Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| 30. | должностные обязанности изложены в должностных инструкциях | п.26. (2.2) Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| 31. | отсутствуют случаи дублирования обязанностей и функций работников | п.26. (2.2) Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| 32. | все функциональные обязанности закреплены за работниками предприятия | п.26. (2.2) Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| 33. | ответственный персонал (руководитель производства, руководитель подразделения контроля качества, уполномоченное(ые) лицо(а)) работает на условиях полного рабочего времени | п.27. (2.3) Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| 34. | руководители производства и подразделения контроля качества независимы друг от друга согласно функциональным обязанностям | п.27. (2.3) Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| 35. | документально подтверждено проведение первичного обучения принятых на работу работников в соответствии с закрепленными за ними обязанностями | п.34. (2.9) Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| 36. | документально подтверждено проведение непрерывного обучения персонала и проведение периодической оценки эффективности обучения | п.34. (2.9) Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| 37. | имеются учебные программы, утвержденные руководителем производства либо руководителем подразделения контроля качества | п.34. (2.9) Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| 38. | документально подтверждено проведение специального обучения с персоналом, работающим в зонах, где контаминация представляет опасность, например, в чистых зонах или в зонах работы с высоко активными, токсичными, инфицирующими или сенсибилизирующими веществами | п.35. (2.10) Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| 39. | проводится инструктаж с посетителями по правилам личной гигиены и использованию защитной одежды и подтверждается документально | п.36. (2.11) Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| 40. | разработан и документально подтвержден комплекс мероприятий содержащий процедуры, касающиеся соблюдения требований к состоянию здоровья, санитарных правил и требований к одежде персонала | п.38. (2.13) Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| 41. | визуально подтверждено, что работники, должностные обязанности которых предполагают пребывание в зонах производства и зонах контроля качества, соблюдают санитарные правила и требования к одежде персонала. | п.38. (2.13) Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| 42. | проводится медицинский осмотр лиц, принимаемых на работу, и последующие регулярные медицинские осмотры персонала | п.39. (2.14) Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| 43. | документально подтверждено что производитель осведомлен о состоянии здоровья персонала, которое может повлиять на качество продукции | п.39. (2.14) Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| 44. | используемая одежда персонала соответствует выполняемым в этих зонах операциям и классу чистоты помещения | п.41. (2.16) Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики»; п.49.(42),п.50.(43) Приложения №1 Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| 45. | Не осуществляется прием пищи, питье, жевание или курение, а также хранение пищевых продуктов, напитков, табачных изделий и личных лекарственных препаратов в производственных зонах и зонах хранения | п.42. (2.17) Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| 46. | визуально подтверждено отсутствие непосредственного контакта рук персонала с открытой продукцией или с любой частью оборудования, контактирующей с продукцией | п.43. (2.18) Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| 47. | документально подтверждено проведение инструктажа по правилам мытья рук с персоналом | п.44. (2.19) Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| Помещения и оборудование | ||||||
| 48. | при осмотре и в соответствии с промышленным регламентом и утвержденными схемами, планировочное решение и конструкция помещения и оборудование расположены, спроектированы, построены, оснащены, очищаются, эксплуатируются и обслуживаются в соответствии с проводимыми операциями | п. 46, п. 47 (3.1), п. 48 (3.2), п. 62 (3.15) Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| 49. | документально подтверждено, что уборка и дезинфекция помещений проводится в соответствии с подробными инструкциями, утвержденными производителем | п. 48 (3.2) Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| 50. | при проектировании и эксплуатации помещений обеспечена защита от проникновения в них насекомых или животных, подтверждается визуально и документально | п. 50 (3.4) Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| 51. | вход в производственные зоны, складские зоны и зоны контроля качества ограничен (электронные коды, список допущенных лиц) | п. 51 (3.5), п. 151 (5.16) Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| Производственная зона | ||||||
| 52. | при производстве сенсибилизирующих веществ или биологических лекарственных препаратов предусмотрено специально предназначенное и обособленное помещение, оборудование и средства их обслуживания. | п. 52 (3.6) Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| 53. | производство отдельных видов антибиотиков, определенных гормонов, цитотоксинов, высоко активных лекарственных средств и продукции, не являющейся лекарственными средствами осуществляется в разных помещениях. (исключение разделении циклов производства по времени с соблюдением специальных мер предосторожности и проведением необходимой валидации) | п. 52 (3.6) Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| 54. | производство ядов технического назначения, таких как пестициды и гербициды, в помещениях, используемых для производства лекарственных средств не осуществляется | п. 53 Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| 55. | помещения обеспечивают выполнение требований к уровню чистоты и соответствуют логической последовательности производственных операций | п. 54 (3.7) Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| 56. | производственные зоны и внутрипроизводственные зоны хранения обеспечивают последовательное и логичное размещение оборудования и материалов, сводящее к минимуму риск перепутывания различных лекарственных средств или их компонентов, обеспечивающее отсутствие перекрестной контаминации и сводящее к минимуму риск пропуска или неправильного осуществления любого этапа при производстве или контроле | п. 55 (3.8) Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| 57. | в помещениях, в которых исходное сырье и первичные упаковочные материалы, промежуточная или нерасфасованная продукция подвержены влиянию производственной среды, внутренние поверхности (стены, полы и потолки) гладкие, без щелей и трещин на стыках, не выделяют частиц, легко и эффективно очищаются, и дезинфицируются. | п. 56 (3.9) Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| 58. | трубопроводы, осветительные приборы, вентиляционные установки и другие системы обслуживания спроектированы и расположены таким образом, чтобы не было углублений, затрудняющих их очистку. | п. 57 (3.10) Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| 59. | имеется доступ к трубопроводам, осветительным приборам, вентиляционным установкам и другим системам обслуживания извне производственных зон для обслуживания | п. 57 (3.10) Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| 60. | точки подключения к канализационным стокам имеют соответствующий размер и оборудованы устройствами для предотвращения обратного потока | п. 58 (3.11) Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| 61. | открытые сливные желоба неглубокие для облегчения очистки и дезинфекции | п. 58 (3.11) Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| 62. | в производственных зонах имеется эффективная система вентиляции, имеющая средства для контроля параметров воздуха (включая температуру, влажность и фильтрацию) | п. 49 (3.3), п. 59 (3.12) Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| 63. | имеется отдельное помещение, предназначенное для взвешивания исходного сырья | п. 60 (3.13) Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| 64. | приняты специальные технические меры предосторожности для предупреждения перекрестной контаминации и облегчения очистки во время отбора проб, взвешивания, смешивания, производственных операций, упаковки сухой продукции | п. 61 (3.14), п. 64 (3.17), п. 146 (5.11) Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| 65. | производственые зоны хорошо освещены, особенно в местах, где проводится постоянный визуальный контроль | п. 63 (3.16) Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| Складские зоны | ||||||
| 66. | складские зоны имеют достаточную вместимость для упорядоченного хранения различных категорий материалов и продукции | п. 65 (3.18) Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| 67. | складские зоны предусматривают надлежащие условия хранения. складские зоны чистые и сухие, поддерживается требуемая температура | п. 66 (3.19) Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| 68. | специальные условия в соответствии с нормативной документацией по хранению обеспечиваются, проверяются и осуществляется их мониторинг, имеется документальное подтверждение. | п. 49 (3.3), п. 66 (3.19),п. 71 (3.24) Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| 69. | в местах приемки и отгрузки обеспечена защита исходного сырья, упаковочных материалов и продукции от воздействия погодных условий. | п. 67 (3.20) Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| 70. | зоны приемки спроектированы и оборудованы таким образом, чтобы тару с поступающими исходным сырьем и упаковочными материалами можно было очищать перед складированием. | п. 67 (3.20) Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| 71. | имеются раздельные зоны карантина, которые четко обозначены. В случае если применяется другая система, заменяющая физический карантин, обеспечивается эквивалентную безопасность. | п. 68 (3.21) Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| 72. | доступ в зону карантина ограничен (электронные коды, список допущенных лиц) и разрешен только персоналу, имеющему соответствующие полномочия | п. 68 (3.21) Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| 73. | имеется отдельная зона для отбор проб исходного сырья и первичных упаковочных материалов с соблюдением мероприятий по предотвращению контаминации и перекрестной контаминации | п. 69 (3.22) Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| 74. | для хранения забракованных, отозванных или возвращенных исходного сырья, упаковочных материалов, печатных упаковочных материалов или продукции предусмотрены изолированные зоны. | п. 70 (3.23), п. 72 (3.25) Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| Зоны контроля качества | ||||||
| 75. | лаборатории контроля качества отделены от производственных зон | п. 73 (3.26) Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| 76. | лаборатории по контролю биологических и микробиологических лекарственных средств, и радиоизотопов отделены друг от друга | п. 73 (3.26) Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| 77. | помещения лабораторий спроектированы для исключения перепутывания и перекрестной контаминацию, имеют место для хранения образцов и записей | п. 74 (3.27) Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| 78. | для чувствительных приборов, нуждающихся в защите от вибрации, электромагнитных полей, влажности воздуха и других условий предусмотрены отдельные комнаты | п. 75 (3.28) Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| 79. | лаборатории, в которых проводятся работы со специфическими веществами (спирт, эфир и др.) соблюдаются специальные требования, установленные нормативными правовыми актами российской федерации | п. 76 (3.29) Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| Вспомогательные зоны | ||||||
| 80. | комнаты отдыха и приема пищи отделены от других зон. | п. 77 (3.30) Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| 81. | туалеты непосредственно не сообщаются с производственными или складскими зонами. | п. 78 (3.31) Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| 82. | хранение запасных частей и инструментов осуществляется в предусмотренных для этого комнатах или запирающихся ящиках | п. 79 (3.32) Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| 83. | виварии изолированы от других зон имеют отдельный вход (доступ к животным) | п. 80 (3.33) Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| 84. | виварии имеют отдельные системы воздухоподготовки | п. 80 (3.33) Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| Оборудование | ||||||
| 85. | конструкция, монтаж и порядок технического обслуживания производственного оборудования соответствует его назначению по документам производителя | п. 81 (3.34) Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| 86. | конструкция производственного оборудования позволяет проводить очистку легко и тщательно | п. 83 (3.36) Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| 87. | документально подтверждено, что очистка проводится в соответствии с подробными инструкциями, утвержденными производителем | п. 83 (3.36) Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| 88. | оборудование содержится в чистом и сухом состоянии | п. 83 (3.36) Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| 89. | для очистки оборудования используются подготовленный (очищенный) инвентарь, моющие и дезинфицирующие средства | п. 84 (3.37) Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| 90. | технологическое оборудование соответствует своему предназначению согласно нормативной документации производителя. Поверхность технологического оборудования контактирующие с продукцией, не вступают с ней в химическую реакцию, не выделяет или абсорбирует вещества, оказывающие влияние на качество продукции | п. 85 (3.38), п. 86 (3.39) Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| 91. | весы и другие средства измерения на основании нормативной документации соответствуют производственным и контрольным операциям, в которых они используются | п. 87 (3.40) Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| 92. | калибровка и поверка весов и других средств измерений, регистрирующих и контрольных приборов проводятся с определенной периодичностью. результаты калибровки и поверки документально оформлены, записи подлежат хранению | п. 88 (3.41) Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| 93. | стационарные трубопроводы имеют маркировку с указанием проходящих по ним веществ и (если требуется) направления потока | п. 89 (3.42) Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| 94. | трубопроводы для воды очищенной, воды для инъекций и трубопроводы для другой воды подвергаются санитарной обработке в соответствии с инструкциями, утвержденными производителем и имеют документальное подтверждение | п. 90 (3.43) Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| 95. | в инструкциях по санитарной обработке трубопроводов указаны пределы микробной контаминации и меры, принимаемые в случае их превышения | п. 90 (3.43) Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| 96. | неисправное оборудование удалено из производственной зоны и зоны контроля качества или четко маркировано как неисправное | п. 91 (3.44) Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| Документация | ||||||
| 97. | производителем разработана регламентирующая и регистрирующая документация, имеется основное досье производственной площадки в котором описана организация производства и контроля качества лекарственных средств | пп. 92- 95, пп. 97-99 Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| 98. | на каждую серию оформляется досье отражающее процесс производства каждой серии продукции, в том числе выдачу разрешения на ее выпуск, и все факторы, влияющие на качество готовой продукции | п. 96, п. 119 Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| 99. | установлен порядок разработки, оформления, выдачи, изъятия документов и внесения в них изменений, документы соответствуют требованиям регистрационного досье | п.100 (4.2) Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| 100. | установлен срок действия регламентирующих документов, которые имеют уникальную идентификацию | п.101 (4.3) Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| 101. | используются только актуальные версии документов | п.103. (4.5) Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| 102. | записи ведут при выполнении каждого действия четко и разборчиво, можно проследить всю деятельность, касающуюся производства лекарственных средств | п. 105. (4.7), п. 106. (4.8) Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| 103. | изменение, вносимое в документ, подписывается и датируется, имеется возможность прочтения первоначальной информации | п. 107. (4.9) Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| 104. | хранение документации на серию (после окончания срока годности этой серии или после оценки соответствия серии уполномоченным лицом) осуществляется в течение одного года после окончания срока годности этой серии или не менее пяти лет после оценки соответствия серии уполномоченным лицом (в зависимости от того, какой срок дольше). | п. 109 (4.11) Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| 105. | хранение критической документации, включая исходные данные (касающиеся валидации или стабильности), подтверждающие информацию регистрационного досье, осуществляется на протяжении срока действия регистрационного удостоверения | п. 109 (4.11), п. 110 (4.12) Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| 106. | имеются утвержденные спецификации на исходное сырье, упаковочные материалы и готовую продукцию. | п. 111 (4.13) Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| 107. | спецификации на исходное сырье и упаковочные материалы содержат следующую информацию: - описание исходного сырья или упаковочных материалов, включающее: наименование и внутренний код (при необходимости), ссылку на фармакопейную статью, нормативную документацию или нормативный документ; наименование утвержденных поставщиков и производителя исходного сырья или упаковочных материалов; образец печатных материалов; - инструкции по отбору проб и проведению испытаний; - качественные и количественные характеристики с указанием предельных значений; - условия хранения и меры предосторожности; - срок годности. | п. 112. (4.14) Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| 108. | имеются спецификации на промежуточную и нерасфасованную продукцию аналогично спецификациям на исходное сырье, или на готовую продукцию | п. 113. (4.15), п. 171 (5.36) Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| 109. | спецификации на готовую продукцию содержат следующую информацию: - наименование лекарственного средства и код (при необходимости); - состав лекарственного средства или ссылку на соответствующую фармакопейную статью, нормативную документацию или нормативный документ; - описание лекарственной формы и подробные сведения об упаковке - инструкции по отбору проб и проведению испытаний; - качественные и количественные характеристики с указанием допустимых предельных значений; - условия хранения и меры предосторожности при использовании (где применимо) - срок годности. | п. 114. (4.16) Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| 110. | имеется промышленный регламент на каждое производимое лекарственное средство и каждый объем серии | п. 115, п. 116. (4.17) Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| 111. | имеются технологические инструкции на каждое производимое лекарственное средство и каждый объем серии | п. 115 Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| 112. | технологические инструкции содержат следующую информацию: - данные о месте осуществления процесса и об основном оборудовании, которое должно при этом использоваться; - методы или ссылки на методы, которые используются для подготовки производственного оборудования (например, очистка, монтаж, калибровка, стерилизация); - инструкции по проверке того, что оборудование и рабочее место свободны от предыдущей продукции, ненужных для запланированного процесса документов и материалов, а также по проверке чистоты оборудования и его готовности к следующему процессу; - подробное описание каждого действия (например, проверки материалов, предварительной обработки, порядка загрузки сырья, критических параметров процесса (время, температура); - инструкции по видам контроля в процессе производства с указанием допустимых пределов контролируемых параметров; - требования к хранению нерасфасованной продукции, включая тару, маркировку и специальные условия хранения, где это требуется; - специальные меры предосторожности. | п. 117 (4.18) Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| 113. | имеются утверждены инструкции по упаковке для каждого лекарственного средства, размера и типа упаковки | п. 118 (4.19) Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| 114. | инструкции по упаковке содержат следующую информацию - наименование лекарственного препарата, включая номер серии нерасфасованной продукции и готовой продукции; - описание его лекарственной формы и дозировки (где применимо); - количество лекарственного средства в окончательной упаковке, выраженное в штуках, единицах массы или объема; - полный перечень всех необходимых упаковочных материалов, включая их количество, размеры и типы с указанием кода или номера, относящихся к спецификациям на каждый упаковочный материал; - где применимо, образец или копию соответствующих печатных упаковочных материалов и образцы, указывающие на место нанесения номера серии и срока годности продукции; - указания по проверке очистки используемого оборудования и рабочего места от предыдущей продукции, документов или материалов, которые не требуются для проведения запланированных операций по упаковке (чистота линии), а также чистоты и готовности данного оборудования к использованию; - меры предосторожности, включая тщательную проверку зоны упаковки и оборудования, гарантирующие очистку упаковочной линии перед началом работы; - описание процесса упаковки, включая все важные вспомогательные операции и используемое оборудование - описание контроля в процессе производства с указаниями по отбору проб и допустимых пределов. | п. 118 (4.19) Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| 115. | имеются записи на каждую произведенную серию по производству серии, которые основываются на промышленных регламентах и технологических инструкциях | п. 120 (4.20) Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| 116. | записи на каждую произведенную серию содержат следующую информацию - наименование и номер серии продукции; - даты и время начала и завершения технологического процесса, а также основных промежуточных стадий; - фамилию(и) и инициалы оператора(ов) каждой основной технологической операции и, при необходимости, лица, проверившего каждую из этих операций; - номер серии и (или) номер аналитического контроля, а также фактически отвешенное количество исходного сырья каждого вида (включая номер серии и количество любого добавленного регенерированного или переработанного сырья - основные технологические операции или действия, а также основное используемое оборудование; - записи по контролю в процессе производства с указанием исполнителей и полученных результатов; - выход продукции на различных стадиях производства; - описание отклонений от промышленного регламента и технологических инструкций, подписанное уполномоченным лицом с указанием даты - подпись лица, ответственного за технологический процесс, с указанием даты | п. 120 (4.20) Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| 117. | записи по производству серии продукции оформляются документально одновременно с выполнением соответствующей операции (в режиме реального времени) | п. 121 Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| 118. | имеются записи по упаковке каждой произведенной серии или части серии | п. 123 (4.21) Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| 119. | записи соответствуют разделам инструкций по упаковке | п. 123 (4.21) Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| 120. | записи по упаковке серии содержат следующую информацию - наименование и номер серии лекарственного средства; - дату (даты) и время проведения операций по упаковке; - фамилию(и) и инициалы оператора(ов) каждой основной технологической операции и, при необходимости, лица, проверившего каждую из этих операций; - записи проверок идентичности и соответствия инструкциям по упаковке, включая результаты контроля в процессе производства; - сведения об осуществленных операциях по упаковке, включая ссылки на использованное оборудование и упаковочные линии; - образцы использованного печатного упаковочного материала, включая образцы с нанесенными номером серии, сроком годности и прочими дополнительными маркировочными данными; - описание отклонений от инструкций по упаковке, подписанное уполномоченным лицом с указанием даты; - количество и ссылку на номер или наименование всех печатных упаковочных материалов и нерасфасованной продукции, выданных, использованных, уничтоженных или возвращенных на склад, а также количество готового продукта для составления материального баланса. Электронный контроль в процессе упаковки является основанием для невключения такой информации; - подпись лица, ответственного за процесс упаковки, с указанием даты. | п. 124. Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| 121. | имеются утвержденные производителем процедуры на приемку каждой поставки каждого вида исходного сырья (в том числе нерасфасованной, промежуточной или готовой продукции) | п. 125 (4.22) Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| 122. | имеются утвержденные производителем процедуры на приемку каждой поставки каждого вида первичных, вторичных и печатных упаковочных материалов | п. 125 (4.22) Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| 123. | записи по приемке содержат информацию - наименование материала в накладной и на таре; - внутризаводское наименование (если оно отличается от наименования, указанного в подпункте "a" настоящего пункта) и (или) код материала (при необходимости); - дату приемки; - наименование поставщика и наименование производителя; - номер серии производителя; - общее количество полученных материалов и число единиц упаковок; - номер серии, присвоенный после приемки, где применимо; - любые существенные замечания. | п. 126 (4.23) Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| 124. | имеются утвержденные производителем процедуры по внутризаводской маркировке, карантину и хранению исходного сырья, упаковочных | п. 127 (4.24) Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| 125. | имеются утвержденные производителем процедуры по отбору проб | п. 128 (4.25) Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| 126. | процедуры по отбору проб, содержат всю необходимую информацию (используемые методы и оборудование, количество, которое должно быть отобрано, соблюдение мер предосторожности во избежание контаминации материала или любого ухудшения его качества) | п. 128 (4.25) Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| 127. | имеются утвержденные производителем методики испытания исходного сырья, упаковочных материалов и продукции на различных стадиях производства с указанием используемых методов и оборудования | п. 129 (4.26) Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| 128. | имеются утвержденные производителем процедуры, устанавливающие порядок выпуска и забраковки сырья и продукции | п. 130 (4.27) Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| 129. | имеются утвержденные производителем процедуры, устанавливающие порядок выдачи уполномоченным(и) лицом(ами) разрешения на выпуск готовой продукции | п. 130 (4.27) Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| 130. | имеются записи у производителя по реализации каждой серии продукции (для организации отзыва этой серии в случае необходимости) | п. 131 (4.28) Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| 131. | имеются процедуры по валидации и квалификации процессов, планы, отчеты | п.132 (4.29) Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| 132. | имеются процедуры, планы, отчеты по монтажу и калибровке оборудования и систем | п.132 (4.29) Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| 133. | имеются процедуры, планы, отчеты и записи по переносу технологий | п.132 (4.29) Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| 134. | имеются процедуры, планы, отчеты и записи технического обслуживания, очистки и дезинфекции систем | п.132 (4.29) Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| 135. | имеются процедуры, отчеты и записи по обучению персонала правилам переодевания и гигиеническим требованиям включая идентификацию подписей и проверку эффективности обучения | п.132 (4.29) Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| 136. | имеются процедуры, планы, отчеты и записи мероприятий, направленных на осуществление контроля появления и распространения вредителей | п.132 (4.29) Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| 137. | имеются процедуры, планы, отчеты и записи предпринятых действий или сделанных заключений при получении претензий, отзывов и возвратов продукции | п.132 (4.29) Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| 138. | имеются процедуры, отчеты и записи по контролю изменений | п.132 (4.29) Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| 139. | имеются процедуры, планы, отчеты и записи расследования отклонений и несоответствий | п.132 (4.29) Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| 140. | имеются процедуры, планы, отчеты и записи по проведению внутреннего аудита качества | п.132 (4.29) Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| 141. | имеются процедуры, отчеты по составлению обзора качества продукции | п.132 (4.29) Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| 142. | имеются процедуры, планы, отчеты и записи по оценке поставщика | п.132 (4.29) Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| 143. | имеются утвержденные инструкции по эксплуатации основных единиц производственного и контрольно- аналитического оборудования. | п. 133. (4.30) Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| 144. | имеются регистрационные журналы для наиболее важного или критического технологического и контрольно- аналитического оборудования | п.134. (4.31) Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| 145. | документально подтверждена регистрация любого использования оборудования и методов, проведения калибровки, технического обслуживания, очистки или ремонта с указанием дат и лиц, выполнивших эти работы | п.134. (4.31) Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| 146. | имеются регистрационные журналы для помещений, где производилась продукция. | п.134. (4.31) Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| 147. | в журналах регистрируется любое использование этих помещений с указанием дат и лиц, выполнивших эти работы | п.134. (4.31) Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| 148. | ведется учет документов в рамках системы управления качеством | п.134. (4.32) Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| Производство | ||||||
| 149. | записи в маршрутных картах подтверждают проведение технологических операций в соответствии с утвержденными процедурами | п. 135 Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| 150. | квалификация персонала позволяет осуществлять и контролировать производственный процесс | п. 136 (5.1) Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| 151. | документально подтверждено, что все действия, проводимые с исходными сырьем, упаковочными материалами и продукцией, осуществляются согласно процедурам или инструкциям, утвержденным производителем | п. 137 (5.2) Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| 152. | имеются записи о проверке каждого поступающего исходного сырья и упаковочного материала в соответствии с заказом поставки | п. 138 (5.3) Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| 153. | визуально подтверждено, что тарные места очищены и имеется маркировка | п. 138 (5.3) Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| 154. | факты повреждения тары и упаковки и любые другие проблемы, оформлены документально, расследованы и информация о них доложена в подразделение контроля качества | п. 139 (5.4) Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| 155. | поступающие исходное сырье и упаковочные материалы и произведенная готовая продукция немедленно помещается в карантин, и содержится в нем до получения разрешения на использование исходного сырья или разрешения на выпуск готовой продукции | п. 140 (5.5) Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| 156. | приемка закупаемой промежуточной и нерасфасованной продукции проводится в соответствии с утвержденными документами для исходного сырья | п. 141 (5.6) Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| 157. | все исходное сырье, упаковочные материалы и продукция хранится в соответствующих условиях, установленных производителем, в определенном порядке, обеспечивающем разделение по сериям и установленную очередность использования | п. 142 (5.7) Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| 158. | имеются записи о проведении проверки выходов и материального баланса. Любое существенное отклонение от ожидаемого выхода продукции оформлено документально и расследовано | п. 143 (5.8), п. 174 (5.39) Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| 159. | документально и визуально подтверждено, что не допускается одновременное или последовательное проведение операций с различными продуктами в одном и том же помещении, при возможности риска перепутывания или перекрестной контаминации | п. 144 (5.9) Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| 160. | продукция, исходное сырье и упаковочные материалы защищены от микробной и другой контаминации на всех стадиях производства следующими техническими или организационными мерами - производство в выделенных зонах (обязательное для таких продуктов, как пенициллины, живые вакцины, лекарственные препараты, содержащие живые микроорганизмы, и некоторые другие биологические лекарственные препараты) или производство по принципу производственных циклов (кампаний с разделением во времени) с последующей соответствующей очисткой; - обеспечение воздушными шлюзами и вытяжными устройствами; - сведение к минимуму риска контаминации, вызываемого рециркуляцией или повторным поступлением необработанного или недостаточно обработанного воздуха - хранение защитной одежды внутри помещений, в которых обрабатывается продукция, создающая особенно большой риск перекрестной контаминации; - применение методов очистки и деконтаминации с известной эффективностью, так как неэффективно очищенное оборудование обычно является источником перекрестной контаминации; - использование "закрытых систем" производства; - контроль наличия остатков и применение этикеток, указывающих статус очистки оборудования. | п. 145 (5.10), п. 153 (5.18), п.154 (5.19) Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| 161. | основные единицы оборудования, помещения, контейнеры, все используемое исходное сырье, упаковочные материалы, тара для нерасфасованной продукции маркированы этикетками или иным способом с указанием производимой продукции или обрабатываемого исходного сырья и упаковочных материалов, а также дозировки и номера серии производимой продукции в течение всего времени процесса производства | п. 147 (5.12), п. 148 (5.13) Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| 162. | документально подтверждено проведение контроля правильности соединения трубопроводов и других частей оборудования, применяемых для транспортировки продукции из одной зоны в другую | п. 149 (5.14) Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| 163. | документально и визуально подтверждено, что в помещениях и на оборудовании, предназначенных для производства лекарственных средств, не допускается производство продукции, не являющейся лекарственными средствами | п. 152 (5.17) Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| 164. | производитель документально подтверждает периодическое проведение мероприятий по предотвращению перекрестной контаминации и их эффективность в соответствии с утвержденными процедурами | п. 155 (5.20) Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| 165. | мероприятия по валидации проводятся в соответствии с утвержденными процедурами. Полученные результаты представлены в виде протоколов и отчетов | п. 156 (5.21), п. 172 (5.37) Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| 166. | при введении нового промышленного регламента или нового метода производства документально доказано, что данный процесс производства при использовании предусмотренных исходного сырья, упаковочных материалов и оборудования позволяет постоянно производить продукцию требуемого качества | п. 157 (5.22) Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| 167. | на существенные изменения процесса производства, включая любое изменение оборудования или исходного сырья и упаковочных материалов, которые могут повлиять на качество продукции и (или) воспроизводимость процесса имеются протоколы и отчеты по валидации | п. 158 (5.23) Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| 168. | процессы и процедуры подвергаются периодической ревалидации (повторной валидации) имеются протоколы и отчеты по валидации | п. 159 (5.24) Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| 169. | имеется перечень утвержденных поставщиков. Исходное сырье закупается только у утвержденных поставщиков, указанных в соответствующих спецификациях | п. 161 (5.26) Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| 170. | документально подтверждено, что в каждой поставке проверяется целостность упаковки и пломб, соответствие указанных в накладной сведений этикеткам поставщика | п. 162 (5.27) Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| 171. | документально подтверждено, что отбор проб, проведение испытаний и выдача разрешения на использование проводится от каждой серии при поставке исходного сырья | п. 163 (5.28) Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| 172. | исходное сырье находящееся в складской зоне маркировано этикетками содержащими информацию: наименование продукции или код, номер серии, статус содержимого, срок годности | п. 164 (5.29) Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| 173. | утверждена процедура гарантирующая проверку подлинности содержимого каждого контейнера исходного сырья | п. 165 (5.30), п. 3 (2) Приложение № 8 Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| 174. | производитель использует исходное сырье, в соответствии с разрешением выданным подразделением контроля качества и имеет не истекший срок годности | п. 166 (5.31) Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| 175. | документально подтверждено, что исходное сырье выдаётся специально назначенными лицами в соответствии с утвержденной процедурой | п. 167 (5.32) Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| 176. | имеются записи о проведении независимой проверки (контроль) каждого выданного исходного сырья, а также его массы или объема | п. 168 (5.33) Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| 177. | исходное сырье, выданное со склада для каждой серии, хранится вместе и четко маркируется | п. 169 (5.34) Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| 178. | перед началом технологической операции приняты меры, гарантирующие, что рабочая зона и оборудование очищены и освобождены от любого исходного сырья, продукции, остатков продукции или документации, не имеющих отношения к запланированной операции, имеется документальное и визуальное подтверждение | п. 170 (5.35) Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| 179. | проводится и документально оформляется контроль в процессе производства и контроль производственной среды в соответствии с нормативной документацией | п. 173 (5.38) Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| 180. | Документально подтверждено, что разрешение на использование упаковочных материалов выдаются только специально назначенными лицами в соответствии с утвержденной процедурой | п. 176 (5.41) Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| 181. | каждой поставке или серии первичных или печатных упаковочных материалов присвоен идентификационный номер или идентификационный знак | п.177 (5.42) Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| 182. | просроченные или непригодные к использованию печатные или первичные упаковочные материалы уничтожены с документальным оформлением. Представлены протоколы, акты об уничтожении | п. 178 (5.43) Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| 183. | документально и организационно подтверждено, что при составлении планов операций по упаковке исключена перекрестная контаминация, перепутывания или подмены | п. 179 (5.44), п. 184 (5.49) Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| 184. | документально и визуально подтверждено, что перед началом операций по упаковке предприняты меры, гарантирующие, что рабочая зона, упаковочные линии, печатные машины и другое оборудование являются чистыми и не содержат любые использовавшиеся ранее лекарственные средства, упаковочные материалы или документы, если они не требуются для запланированной операции | п. 180 (5.45) Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| 185. | имеются записи о проведении очистки линии согласно утвержденной процедуре | п. 180 (5.45) Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| 186. | наименование и номер серии упаковываемой продукции указаны на каждом упаковочном месте или линии | п. 181 (5.46) Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| 187. | при поступлении продукции и упаковочных материалов на участок упаковки проверяется их количество, идентичность и соответствие инструкциям по упаковке. Представлены документы | п. 182 (5.47) Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| 188. | документально подтверждено, что материалы первичной упаковки перед началом операции наполнения проверяются на чистоту | п. 183 (5.48) Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| 189. | имеются записи о правильности выполнения любых печатных операций (например, нанесения номеров серий, срока годности), осуществляемых либо как отдельная технологическая операция, либо в процессе упаковки | п. 185 (5.50), п. 186 (5.51), п. 188 (5.53) Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| 190. | имеются записи, что производитель проводит проверки, гарантирующие, что все электронные устройства считывания кода, счетчики этикеток и аналогичные устройства работают правильно | п. 187 (5.52) Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| 191. | документально подтверждено, что при контроле процесса упаковки продукции на линии проверяются все необходимые параметры | п. 189 (5.54) Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| 192. | имеются записи, что образцы, взятые с упаковочной линии, не возвращаются повторно на линию | п. 190 Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| 193. | документально подтверждено, что при возникновении непредвиденных обстоятельств при упаковке продукции, она возвращена в производство только после специальной проверки, проведения расследования и с разрешения лица, имеющего соответствующие полномочия. Действия оформлены в виде протокола, который хранится в установленном порядке | п. 191 (5.55) Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| 194. | документально подтверждено, что при существенном или необычном расхождении, установленном во время составления материального баланса, между количеством нерасфасованной продукции, печатного упаковочного материала и числом произведенных единиц готовой продукции проведено расследование и установлена причина этого расхождения до выдачи разрешения на выпуск | п. 192 (5.56) Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| 195. | после завершения операций по упаковке любые оставшиеся упаковочные материалы с нанесенным на них номером серии уничтожены с последующим документальным оформлением | п. 193 (5.57) Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| 196. | имеются записи, что возврат на склад немаркированных упаковочных материалов производят в соответствии с утвержденной процедурой | п. 193 (5.57) Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| 197. | документально подтверждено, что до выдачи разрешения на выпуск готовая продукция содержится в карантине в условиях, установленных производителем согласно нормативной документации | п. 194 (5.58) Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| 198. | документально подтверждено, что до момента получения разрешения на выпуск проведена оценка качества готовой продукции и необходимой документации | п. 195 (5.59) Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| 199. | документально подтверждено, что после выдачи разрешения на выпуск готовая продукция хранится как пригодная для реализации в условиях, установленных производителем | п. 196 (5.60) Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| 200. | отклоненные материалы и продукция имеют четкую маркировку и хранятся раздельно в зонах с ограниченным доступом. Любые выполненные действия с отклоненными материалами и продукцией подлежащей возврату поставщику, переработке (если это допустимо) или уничтожению оформлены документально | п. 197 (5.61) Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| 201. | переработка осуществляется в соответствии с утвержденным промышленным регламентом после оценки возможного риска с последующим документальным оформлением | п. 198 (5.62) Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| 202. | повторное использование всей серии или части ранее произведенных серий соответствующего качества путем объединения с серией такой же продукции на определенной стадии производства, предусмотренной промышленным регламентом, санкционировано заранее с учетом оценки возникающих рисков, включая любое возможное влияние на срок годности. Имеются документы (протоколы, отчеты, записи и др.) | п. 199 (5.63), п. 200 (5.64) Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| 203. | возвращенная с рынка продукция, над которой был утрачен контроль со стороны производителя, должна быть уничтожена, если не подтверждено соответствие ее качества установленным требованиям. Действия оформлены документально | п. 201 (5.65) Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| 204. | решение о повторной продаже, перемаркировке или повторном использовании принимается только после специального анализа, проведенного подразделением контроля качества в соответствии с утвержденной процедурой. При этом учитывается характер продукции, ее предысторию и состояние, соблюдение специальных условий хранения и время, прошедшее с даты выпуска. Действия оформлены документально | п. 201 (5.65) Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| 205. | все выполняемые действия по возвращенной продукции, оформлены документально | п. 201 (5.65) Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| Контроль качества | ||||||
| 206. | в структуре производителя имеется подразделение контроля качества, независимое от других подразделений | п. 203. (6.1) Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| 207. | подразделение контроля качества обеспечено соответствующими помещениями, оборудованием, персоналом, чтобы гарантировать, что все мероприятия по контролю качества проводятся эффективно и надежно | п. 203. (6.1) Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| 208. | для выдачи разрешения на выпуск, при оценке качества готовой продукции, рассматриваются условия производства, результаты контроля в процессе производства, обзор производственной документации (включая документацию на упаковку), соответствие спецификациям на готовую продукцию и проверку окончательной упаковки готовой продукции | п. 205. (6.3) Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| 209. | персонал подразделения контроля качества имеет доступ в необходимые производственные зоны для отбора проб и проведения исследований (электронные коды, список допущенных лиц) | п. 206 (6.4) Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| 210. | в подразделении контроля качества имеется и легко доступна следующая документация: спецификации, процедуры отбора проб, методики и документы по проведенным испытаниям, аналитические отчеты и (или) документы подтверждающие качество, результаты мониторинга производственной среды, протоколы валидации методик испытаний, процедуры и протоколы калибровки приборов и техобслуживания оборудования | п. 210, п. 213 (6.10) Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| 211. | документации по контролю качества, относящейся к записям по производству серий продукции хранится в течение одного года после истечения срока годности серии и в течение не менее пяти лет после оценки соответствия серии уполномоченным лицом в установленном порядке | п. 211 (6.8) Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| 212. | представлены записи по хранению результатов аналитических испытаний, выхода готовой продукции, параметров производственной среды в виде, позволяющем оценивать тенденции изменения параметров | п. 212 (6.9) Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| 213. | имеется утвержденная процедура по отбору проб, которая содержит информацию: способ отбора проб, используемое оборудование, количество образца, которое должно быть отобрано, тип и состояние тары используемой для отбора проб, идентификацию тары с отобранными пробами и тары из которой были пробы отобраны, меры предосторожности, которые необходимо соблюдать, условия хранения, процедуры по очистке и хранению оборудования и отбора проб | п. 214 (6.11) Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| 214. | отобранные контрольные образцы представляют собой представительную выборку серии исходного сырья, упаковочных материалов или готовой продукции | п. 215 (6.12) Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| 215. | этикетка тары с отобранными образцами содержит необходимую информацию | п. 216 (6.13) Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| 216. | все методики контроля качества валидированы | п. 218 (6.15) Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| 217. | все испытания, приведенные в регистрационном досье, проведены в соответствии с утвержденными методиками | п. 218 (6.15) Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| 218. | полученные результаты испытаний документально оформлены и проверены | п. 219 (6.16) Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| 219. | регистрирующие записи испытаний содержат всю необходимую информацию | п. 220 (6.17) Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| 220. | все операции по контролю в процессе производства, осуществляются в соответствии с методиками, утвержденными подразделением контроля качества, а их результаты документально оформляются | п. 221 (6.18) Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| 221. | приготовление и подготовка лабораторных реактивов, мерной лабораторной посуды и титрованных растворов, стандартных образцов и питательных сред соответствуют требованиям утвержденных инструкций | п. 222 (6.19) Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| 222. | лабораторные растворы реактивов имеют маркировку с информацией о дате приготовления, наименовании, сроке годности, условии хранения, подпись исполнителя, а для титрованных растворов дату последнего установления титра и поправочный коэффициент | п. 223 (6.20) Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| 223. | после выпуска в обращение проводится мониторинг стабильности лекарственного препарата в соответствии с документально оформленная программа | п. 226 (6.23) Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| 224. | имеется документально оформленная программа последующего изучения стабильности | п. 229 (6.26) Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| 225. | оборудование, используемое для изучения стабильности (в частности, климатические камеры), квалифицировано, подвергается обслуживанию | п. 229 (6.26) Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| 226. | отчет о работе по программе последующего изучения стабильности включает в себя весь период до истечения срока годности продукции и содержит необходимые данные | п. 230 (6.27) Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| 227. | В случае отличия отчета о первоначальном длительном испытании стабильности, представленного в регистрационном досье (в том числе отличия в периодичности испытаний имеется документально оформленное обоснование | п. 231 (6.28) Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| 228. | в программу последующего изучения ежегодно включают как минимум одна серия произведенного лекарственного препарата в каждой дозировке и в каждом виде первичной упаковки. | п. 232 (6.29) Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| 229. | результаты последующего изучения стабильности доступны ответственному персоналу и особенно уполномоченному(ым) лицу (лицам). Если последующее изучение стабильности осуществляется не на месте производства между участвующими сторонами оформлено соответствующее соглашение | п. 234 (6.31) Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| 230. | результаты последующего изучения стабильности находятся на месте производства. | п. 234 (6.31) Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| 231. | все выходы за пределы спецификации или существенные негативные тенденции доводят до сведения уполномоченного федерального органа исполнительной власти. | п. 235 (6.32) Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| 232. | заключения по изучению стабильности, в том числе промежуточные выводы, оформляются документально. | п. 236 (6.33) Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| 233. | данные по стабильности подвергают периодическому обзору | п. 236 (6.33) Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| Деятельность, передаваемая для выполнения другой организации (аутсорсинг) | ||||||
| 234. | в договоре между заказчиком и исполнителем четко определенны обязанности каждой из сторон и предусмотрен порядок действий и ответственность уполномоченного лица за выдачу разрешения на выпуск каждой серии продукции, договор соответствует законодательству Российской Федерации и регистрационному досье на соответствующую продукцию | п. 237, п. 240 (7.2) Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| 235. | заключены соглашения в случае, если юридическое лицо, на имя которого выдано регистрационное удостоверение, и производитель не являются одной организацией | п. 241 (7.3) Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| 236. | фармацевтическая система качества заказчика включает в себя контроль и проверку деятельности, переданной на аутсорсинг | п. 242 (7.4) Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| 237. | документально подтверждено, что заказчик до передачи деятельности на аутсорсинг убедился в правоспособности исполнителя (в том числе в наличии у него необходимой в соответствии с законодательством Российской Федерации лицензии) в его компетентности и наличии у него возможности выполнить обязательства по договору надлежащим образом в соответствии с требованиями настоящих Правил | п. 243. (7.5) Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| 238. | заказчик гарантирует, что исполнитель полностью осведомлен обо всех факторах, связанных с продукцией или деятельностью, передаваемой на аутсорсинг, которые могут представлять опасность для его помещений, оборудования, персонала, исходного сырья или другой продукции. | п. 244. (7.6) Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| 239. | заказчик контролирует и проверяет действия исполнителя. | п. 245. (7.7) Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| 240. | заказчик самостоятельно или на основании подтверждения уполномоченного лица исполнителя убедился, что вся продукция и материалы, поставленные ему исполнителем, были произведены в соответствии с требованиями Правил и регистрационным досье. | п. 246. (7.8) Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| 241. | исполнитель имеет необходимые знания, опыт и компетентный персонал, а также располагает соответствующими помещениями, оборудованием для надлежащего исполнения обязательств по договору. | п. 247. (7.9) Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| 242. | исполнитель удостоверился, что вся предоставленная ему продукция, исходное сырье, упаковочные материалы и сведения пригодны для использования по назначению. | 248. (7.10) Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| 243. | исполнитель передает третьей стороне работы или услуги, порученные ему по договору, по предварительному рассмотрению и согласованию с заказчиком. | п. 249. (7.11) Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| 244. | исполнитель не производит несанкционированные изменения, выходящие за рамки договора. | п. 250. (7.12) Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| 245. | заключен договор между заказчиком и исполнителем, в котором определены их взаимные обязательства и процедуры передачи информации, связанные с деятельностью, передаваемой на аутсорсинг. | п. 252. (7.14) Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| 246. | технические аспекты договора составляются лицами, имеющими соответствующие знания, связанные с деятельностью, передаваемой на аутсорсинг, и настоящими Правилами. | п. 252. (7.14) Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| 247. | условия договора и все связанные с договором технические и иные соглашения соответствуют законодательству Российской Федерации и регистрационному досье. | п. 252. (7.14) Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| 248. | в договоре указывается ответственность сторон отвечает за каждый этап деятельности, передаваемой на аутсорсинг | п. 253. (7.15) Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| 249. | в процедурах производителя определен порядок хранения записей, связанных с деятельностью, передаваемой на аутсорсинг | п. 254. (7.16) Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| Претензии и отзывы продукции | ||||||
| 250. | документально подтверждено, что все претензии и информация, касающиеся потенциально недоброкачественных лекарственных средств, расследуются в соответствии с утвержденными процедурами, в которых описана система быстрого и эффективного отзыва с рынка продукции с выявленными или предполагаемыми нарушениями качества | п. 256, пп. 258 (8.2) - 262 (8.6) Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| 251. | представлены документы о назначении работника, ответственного за рассмотрение претензий и принятие решений, имеющего право привлекать необходимый персонал | п. 257. (8.1) Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| 252. | документально подтверждено, что соответствующий уполномоченный федеральный орган исполнительной власти проинформирован, в случае если предпринимаются действия, являющиеся следствием возможных ошибок в производстве, ухудшения качества продукции, выявления фальсифицированной продукции или других серьезных проблем, связанных с качеством продукции | п. 264 (8.8) Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| 253. | представлены документы о назначении работника, ответственного за своевременный отзыв продукции и принятие решений, имеющего право привлекать необходимый персонал | п. 265 (8.9) Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| 254. | порядок отзыва продукции регламентирован, имеется утвержденная процедура, документально оформлена последовательность действий при отзыве продукции | п. 266 (8.10), п. 267 (8.11) - 272 (8.16) Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| 255. | проинформированы компетентные органы всех стран, куда была направлена продукция, о принятии решения об отзыве продукции в связи с подозрением или обнаружением несоответствия ее качества | п. 268 (8.12) Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| Самоинспекция | ||||||
| 256. | проводится самоинспекция с целью проверки выполнения производителем требований настоящих Правил и предложения необходимых корректирующих действий, представлены документы | п. 273. Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| 257. | анализируются вопросы, касающиеся персонала, помещений, оборудования, документации, технологического процесса, контроля качества, реализации лекарственных средств, мероприятий по работе с претензиями, отзывов продукции, а также деятельности по проведению самоинспекций для проверки их соответствия принципам фармацевтической системы качества, имеются записи. Утверждена программа и график проведения самоинспекции | п. 274 (9.1) Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| 258. | проводиться самоинспекция специально назначенными квалифицированными лицами, состоящими в штате производителя. Представлены документы о назначении комиссии | п. 275 (9.2) Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| 259. | результаты самоинспекций оформлены документально и включают в себя всю полученную информацию и необходимые корректирующие действия | п. 276 (9.3) Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| Приложение №4 Особенности производства лекарственных средств для ветеринарного применения (кроме иммунобиологических лекарственных средств для ветеринарного применения) | ||||||
| 260. | В случае производства лекарственных препаратов против эктопаразитов, которые относятся к лекарственным средствам для ветеринарного применения в зоне производства пестицидов имеются документы, подтверждающие разделение циклов производства по времени. | п. 2 (5) Приложение №4 Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| 261. | при использовании общих помещений производство продукции, содержащей пенициллины, организовано по принципам разделенных во времени циклов производства и сопровождается соответствующими валидированными методиками деконтаминации и очистки. Предприняты все необходимые меры по предотвращению перекрестной контаминации и обеспечению безопасности персонала | п. 3 (6), п. 4. (7) Приложение №4 Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| 262. | обеспечено хранение архивных образцов каждой серии, упаковка для хранения архивных образцов произведена из того же материала, что и первичная упаковка, в которой этот продукт реализуется на рынке | п. 5. (8), п. 6. (9) Приложение №4 п. 9 (3.1) Приложение №18(19)Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| Приложение № 8 Отбор проб исходного сырья и упаковочных материалов | ||||||
| 263. | разработана процедура, прошедшая валидацию, допускающая отбирать пробы только из части емкостей с исходным сырьем | п. 3 (2), п. 5, п.6 Приложение № 8 Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| 264. | при проведении валидации процедуры допускающей отбирать пробы только из части емкостей с исходным сырьем учтены аспекты: данные о производителе и поставщике (их тип и текущее состояние), наличие системы обеспечения качества у производителя исходного сырья; условия производства, при которых исходное сырье производят и контролируют; характер и свойства исходного сырья и лекарственных препаратов, для производства которых оно будет использоваться | п. 4 (3) Приложение № 8 Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| 265. | имеется план по отбору проб исходного сырья, количество отбираемых проб исходного сырья определено статистически и указано количество пробы, определено количество отдельных проб, для формирования средней пробы, с учетом вида сырья, сведений о поставщике и однородности средней пробы | п. 7(4) Приложение № 8 Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| 266. | имеется план по отбору проб упаковочных материалов, содержащий информацию: полученное количество, требуемое качество, характер материала (например, первичные упаковочные материалы и (или) печатные упаковочные материалы), методы производства, а также сведения о системе обеспечения качества производителя упаковочных материалов, основанные на результатах проведения аудитов. Количество отбираемых проб должно быть определено статистически и указано в плане по отбору проб | п. 8(5) Приложение № 8 Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| Приложение № 11 Компьютеризированные системы | ||||||
| 267. | управление рисками применяется в течение жизненного цикла компьютеризированной системы. Объем валидационных испытаний и проведение контролей целостности данных основывается на обоснованной и документально оформленной оценке рисков компьютеризированной системы | п. 5, п. 15. (4.4), п. 21 Приложение №11 Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| 268. | при привлечении третьих лиц для поставки, установки, настройки, задания конфигурации, интегрирования, валидации, технического обслуживания, модификации или поддержания компьютеризированных систем, оказания связанных с ними услуг или обработки данных, то между производителем и указанными третьими лицами заключаются договоры, поддерживается тесное сотрудничество между всем значимым персоналом, вовлеченным в данный процесс, Такими договорами устанавливается ответственность третьих лиц за надлежащее исполнение своих обязанностей | п. 6, п. 7 (3.1) Приложение №11 Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| 269. | необходимость оценки поставщика основывается на оценке рисков, компетентность и надежность поставщиков являются ключевыми условиями выбора поставщика программного продукта или услуг | п. 8 (3.2) Приложение №11 Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| 270. | документация, прилагаемая к коммерчески выпускаемым готовым для использования программным продуктам, рассмотрена уполномоченными работниками производителя на предмет соответствия требованиям производителя и доступна для предоставления лицам, осуществляющим проверку, по их требованию | п. 9 (3.3), п.10 (3.4) Приложение №11 Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| 271. | проведена валидация систем. Валидационная документация и отчеты охватывают соответствующие стадии жизненного цикла компьютеризированной системы, включает записи контроля изменений и отчеты о любых отклонениях, выявленных в ходе процесса валидации. Производитель обосновал свои стандарты, протоколы, критерии приемлемости, процедуры и записи на основе оценки рисков | п. 11 (4.1), п.12 (4.2), п. 17 (4.6), п. 19 (4.8), п. 23 (7.2) Приложение №11 Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| 272. | в наличии текущий перечень (реестр) всех используемых компьютеризированных систем с указанием их функциональности. Для критических компьютеризированных систем в наличии подробное текущее описание физических и логических взаимосвязей, потоков данных и интерфейсов с другими системами или процессами, требуемые ресурсы всего компьютерного оборудования и программного обеспечения, доступные меры безопасности | п.13 (4.3), п. 14 Приложение №11 Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| 273. | производитель предпринял все меры, гарантирующие, что компьютеризированная система разработана в соответствии с надлежащей системой управления качеством. Поставщик оценен соответствующим образом | п. 16 (4.5) Приложение №11 Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| 274. | представлены доказательства соответствия методов и схем тестирования компьютеризированной системы. Рассмотрены пределы параметров системы (процесса), границы данных и обработка ошибок. Документально оформлена оценка соответствия применения автоматизированных средств тестирования и режимов их работы | п. 18 (4.7) Приложение №11 Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| 275. | компьютеризированные системы, осуществляющие электронный обмен данных с другими системами, включают соответствующие встроенные средства контроля правильного и безопасного ввода и обработки данных с целью минимизации рисков | п. 20 Приложение №11 Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| 276. | для критических данных, вводимых вручную, предусмотрен дополнительный контроль точности ввода данных | п. 21 Приложение №11 Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| 277. | данные защищены от повреждений как физическими, так и электронными мерами. Сохраненные данные проверяются на доступность, читаемость и точность. Доступ к данным обеспечен на протяжении всего периода их хранения | п. 22 (7.1) Приложение №11 Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| 278. | имеется возможность получения четких печатных копий данных, хранящихся в электронном виде. Для записей, сопровождающих разрешение на выпуск серии, предусмотрена возможность получения распечаток, указывающих, изменялись ли какие-либо данные с момента их первоначального ввода | п. 24 (8.1), п. 25 (8.2) Приложение №11 Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| 279. | на основе оценки рисков уделяется внимание встраиванию в систему возможности создания записей всех существенных изменений и удалений, связанных с областью действия Правил (система, создающая "контрольные следы"). Причины таких связанных с Правилами изменений или удалений данных оформлены документально. Контрольные следы доступны, имеют возможность их преобразования в понятную для пользователей форму, регулярно проверяются | п. 26, п. 27, п. 31 (12.3), п. 32 (12.4), п. 37 Приложение №11 Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| 280. | документально подтверждено, что компьютеризированные системы периодически оцениваются для подтверждения того, что они остаются в валидированном состоянии | п. 28 Приложение №11 Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| 281. | для обеспечения доступа к компьютеризированной системе только лицами, имеющими на это право, используются физические и (или) логические элементы контроля | п. 29 (12.1) Приложение №11 Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| 282. | все инциденты (непредвиденные случаи), включая системные сбои и ошибки данных, записываются и оцениваются. Установлена основная причина критических сбоев и эта информация используется в качестве основы корректирующих и предупреждающих действий | п. 33 Приложение №11 Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| 283. | электронные подписи отвечают необходимым требованиям пункта 34 а) (а)-в) (с) | п. 34 Приложение №11 Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| 284. | компьютеризированная система для регистрации процедуры одобрения и выпуска серии, предоставляет доступ для выпуска серии только уполномоченному лицу, с идентификацией и регистрацией. Эти действия осуществляются с использованием электронной подписи | п. 35 Приложение №11 Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| 285. | с целью обеспечения работоспособности компьютеризированных систем, сопровождающих критические процессы, приняты меры предосторожности для гарантии непрерывности поддержки этих процессов в случае выхода системы из строя. Эти меры надлежащим образом оформлены документально и проверены | п. 36 Приложение №11 Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производстве нной практики» | ||||
| 286. | данные проверяются на доступность, удобство чтения и целостность. При необходимости провести существенные изменения в компьютеризированной системе, обеспечена и проверена возможность восстановления данных | Приложение №11 Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| Приложение № 15. Квалификация и валидация. | ||||||
| 287. | проводится валидация процессов и оборудования, используемых при производстве лекарственных средств, а также при существенных изменениях в помещениях, оборудовании и процессах, которые могут оказать влияние на качество продукции | п. 1 приложение №15 Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| 288. | проводится оценка рисков для определения состава и объема работ по валидации | п. 1 приложение №15 Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| 289. | имеется основной план валидации | п. 2 приложение №15 Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| 290. | основной план валидации содержит следующую информацию: - цель проведения валидации; - организационную схему деятельности по валидации; - перечень всех помещений, систем, оборудования и процессов,; - форму документации в виде формы, которую следует использовать для протоколов и отчетов; - планирование и график выполнения работ; - контроль измерений; -ссылки на документы по производству | п. 4 приложение №15 Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| 291. | разработан и утвержден письменный протокол, в котором указаны критические этапы и критерии приемлемости | п. 6 приложение №15 Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| 292. | подготовлены отчеты о валидации (квалификации) всех критических процессов и оборудования | п. 7 приложение №15 Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| 293. | Имеется отчет с перекрестными ссылками на протокол квалификации и валидации , обобщающий полученные результаты, содержащий комментарии относительно всех замечаний и отклонений и выводы, включая рекомендуемые изменения, необходимые для устранения отклонений. | п. 7 приложение №15 Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| 294. | после успешного завершения квалификации оформлены официальные письменные разрешения для перехода к следующему этапу квалификации и валидации | п. 8 приложение №15 Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| 295. | проведены все этапы квалификации (квалификация проекта, квалификация монтажа, квалификация функционирования, квалификация эксплуатации, квалификация установленных технических средств, помещений и оборудования) | п. 11, 13,16 приложение №15 Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| 296. | Имеется документально оформленная квалификация монтажа, которая содержит: - проверку монтажа оборудования, трубопроводов, вспомогательных систем и приборов по утвержденному проекту, включая техническую документацию, чертежи, спецификации; - оценку полноты и сопоставление инструкций поставщика по эксплуатации и требований к техническому обслуживанию; - оценку требований к калибровке; - проверку материалов | п. 12 приложение №15 Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| 297. | Имеется документально оформленная квалификация проекта | п. 9 приложение №15 Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| 298. | Имеется документально оформленная квалификация функционирования, которая содержит: - испытания, исходя из знаний о процессах, оборудовании, системах; - испытания функционирования оборудования при рабочих параметрах, равных верхним и нижним допустимым пределам, то есть в условиях "наихудшего случая" | п. 14 приложение №15 Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| 299. | Имеется документально оформленные квалификация эксплуатации, которая содержит: - испытания с использованием материалов, применяемых в производстве, выбранных заменителей с аналогичными свойствами или моделирующего препарата, разработанные на основании знаний о процессе, а также о технических средствах, системах или оборудовании; - испытания при рабочих параметрах, равных верхним и нижним допустимым предельным значениям. | п. 17 приложение №15 Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| 300. | Имеется документально оформленная квалификация установленных технических средств, помещений и оборудования, которая содержит: - данные, обосновывающие и подтверждающие соответствие рабочих критических параметров заданным требованиям. - инструкции по калибровке, очистке, профилактическому техническому обслуживанию и эксплуатации, а также по обучению операторов и ведению отчетов. | п. 19 приложение №15 Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| 301. | Представлены документы подтверждающие, что используемые помещения, системы и оборудование квалифицированы, аналитические методики испытаний - валидированы, персонал, принимающий участие в проведении валидации, соответствующим образом обучен | п. 22 приложение №15 Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| 302. | проводится периодическая оценка помещений, систем, оборудования и процессов с целью подтверждения их работы в соответствии с заданными требованиями | п. 23 приложение №15 Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| 303. | Перспективная валидация процессов содержит: - краткое описание процесса; - перечень критических стадий процесса, подлежащих исследованию; - перечень используемых помещений и оборудования (включая измерительное, контрольное, регистрирующее оборудование) с указанием сведений об их калибровке; - спецификации на готовую продукцию при выпуске; - при необходимости перечень аналитических методик; - предлагаемые точки контроля в процессе производства и критерии приемлемости; - при необходимости дополнительные испытания, которые необходимо провести, вместе с критериями приемлемости и валидацией аналитических методик; - план отбора проб; - методы регистрации и оценки результатов; - функции и обязанности; - предполагаемый график выполнения работ. | п. 24 приложение №15 Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| 304. | валидация выполнена на трех последовательные серии или цикла, при которых параметры находятся в заданных пределах | п. 25 приложение №15 Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| 305. | размер серии при валидации равен размеру серии при промышленном выпуске продукции | п. 26 приложение №15 Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| 306. | решение о проведении сопутствующей валидации обосновано, документально оформлено и утверждено лицами, имеющими соответствующее полномочие | п. 29 приложение №15 Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| 307. | ретроспективная валидация проведена на отработанных процессах с соблюдением условия, что в состав продукции, технологический процесс или оборудование не вносились изменения | п. 31 приложение №15 Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| 308. | при проведении ретроспективной валидации выполнен анализ данных не менее чем на 10 последовательно произведенных серий для оценки стабильности процесса. | п. 35 приложение №15 Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| 309. | валидация очистки подтверждает эффективность процедуры очистки с учетом пределов для переносимых остатков продукта, моющих средств, а также микробной контаминации | п. 36 приложение №15 Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| 310. | для обнаружения остатков или контаминантов используются валидированные аналитические методики. Предел обнаружения для каждой аналитической методики достаточен для того, чтобы обнаружить установленный допустимый уровень остатка или контаминанта | п. 37 приложение №15 Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| 311. | проведена валидация длительности интервалов времени между окончанием процесса и очисткой, а также между очисткой и началом следующего процесса, а также интервалы времени между проведением очистки. | п. 38 приложение №15 Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| 312. | валидация очистки проведена с использованием подхода "наихудший случай» | п. 39 приложение №15 Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| 313. | валидация процедуры очистки проведена на трех последовательных циклах очистки | п. 40 приложение №15 Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| 314. | проводится периодическую оценку помещений, систем, оборудования и процессов, включая процедуры очистки, для подтверждения их соответствия заданным требованиям | п. 45 приложение №15 Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| Приложение №16. Подтверждение уполномоченным лицом соответствия серии продукции с целью ее выпуска. | ||||||
| 315. | Уполномоченное лицо подтверждает соответствие серии готовой продукции установленным требованиям перед выдачей разрешения на выпуск и основывает свое решение на личном знании либо на заключение со стороны одного или более уполномоченных лиц о соответствии промежуточных стадий производства установленным требованиям. Такое заключение, выдаваемое другими уполномоченными лицами, имеется, оформлено документально и четко определяет предмет подтверждения соответствия. Порядок подтверждения оформлен документально. | п. 12 (4.3), 13 приложение №16 Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| 316. | представлен договор между производителями различных стадий (этапов) производства по подтверждению соответствия, предусматривает информирование обо всех отклонениях, результатах, выходящих за рамки спецификаций, несоответствиях, расследованиях, претензиях или других событиях, которые должно принимать во внимание уполномоченное лицо, ответственное за подтверждение соответствия серии готовой продукции всем установленным требованиям | п. 15 (4.5) приложение №16 Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| Приложение № 18 (19) Контрольные и архивные образцы | ||||||
| 317. | Имеются контрольные и (или) архивные образцы, характеризующие серию готовой продукции или исходных сырья и материалов, являющиеся приложением к досье на серию с целью оценки, в случае предъявления претензий к качеству лекарственного препарата и в случае проверки маркировки и упаковки | п. 7. (2.3) Приложение № 18 (19) Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| 318. | имеются записи для обеспечения прослеживаемости образцов. Записи доступны уполномоченным федеральным органам исполнительной власти. | п. 8. (2.4) Приложение № 18 (19) Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| 319. | контрольные и архивные образцы каждой серии готовой продукции хранятся в течение срока годности серии и одного года после истечения срока годности. | п. 9. (3.1) Приложение № 18 (19) Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| 320. | образцы исходного сырья (кроме растворителей, газов или воды, предназначенных для технологических целей) хранятся в течение не менее двух лет после выпуска лекарственного препарата, если более длительный период не предусмотрен соответствующими нормативными правовыми актами Российской Федерации. Указанный период может быть сокращен, если в спецификации указан более короткий период стабильности сырья, упаковочные материалы хранятся в течение срока годности соответствующего готового продукта | п.10. (3.2) Приложение № 18 (19) Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| 321. | количество контрольных образцов достаточно для проведения не менее чем двукратного полного аналитического контроля серии продукции в соответствии с требованиями, установленными при государственной регистрации. Для каждого вида аналитического контроля используются невскрытые упаковки. Любые исключения из этого требования обоснованы и согласованы с уполномоченным федеральным органом исполнительной власти. | п.11. (4.1) Приложение № 18 (19) Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| 322. | контрольные образцы являются представительными для серии исходного сырья, промежуточной или готовой продукции, из которой они отобраны. При проведении процесса упаковки серии в ходе двух и более отдельных операций по упаковке, отбирается не менее одного архивного образца после каждой из этих операций | п.13 (4.3) Приложение № 18 (19) Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| 323. | имеются аналитические материалы и оборудование приведенные в спецификации для проведения испытаний в течение одного года после истечения срока годности последней произведенной серии | п.14 (4.4) Приложение № 18 (19) Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| 324. | условия хранения соответствуют требованиям, установленным при государственной регистрации лекарственного средства | п. 16 (5.2) Приложение № 18 (19) Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| 325. | В случае, если лицо, на имя которого выдано регистрационное удостоверение, не является одновременно юридическим лицом, ответственным за выпуск серии продукции в Российской Федерации в наличии имеется соглашение между сторонами на деятельность ( аутсортинг) в котором указано обязанность по отбору и хранению контрольных и архивных образцов. | п. 17 (6.1) Приложение № 18 (19) Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| 326. | обязанность по отбору и хранению контрольных и архивных образцов определена в соглашении между сторонами, соглашение содержит всю необходимую информацию | п. 17 (6.1), п. 19 (6.3), п.23 (8.2), п.25 (8.4) Приложение № 18 (19) Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| 327. | документально подтверждено, что обеспечена доступность всех соответствующих контрольных и архивных образцов в течение приемлемого времени | п. 18 (6.2) Приложение № 18 (19) Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| 328. | образцы исходного сырья и образцы готовой продукции хранятся на площадке, на которой осуществляется производство готовых лекарственных препаратов | п. 20 (7.1) Приложение № 18 (19) Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| 329. | порядок обращения с контрольными образцами готовых лекарственных средств, производимых в других странах производится согласно пункту 21 а)-в) | п. 21 (7.2) Приложение № 18 (19) Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| 330. | архивные образцы представляют собой серию готовых лекарственных препаратов в том виде, в котором они реализуются в Российской Федерации, хранится на площадке, на которой находится уполномоченное лицо, выдавшее разрешение на выпуск продукции. | п. 22 (8.1) Приложение № 18 (19) Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| 331. | архивные образцы находятся на производственной площадке, принадлежащей производителю, имеющему лицензию на производство лекарственных средств | п. 24 (8.3) Приложение № 18 (19) Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
| 332. | документально разработан порядок, позволяющий быстро определить виновного в перепутывании (производитель или организация оптовой торговли лекарственными средствами) | п. 26. (9.1), п. 27. (9.2) Приложение № 18 (19) Приказа Минпромторга России от 14.06.2013 №916 «Об утверждении Правил надлежащей производственной практики» | ||||
Подписи лиц, проводивших проверку:
________________________________________________________________________________________________________
________________________________________________________________________________________________________
________________________________________________________________________________________________________
С результатами проверки ознакомлен(а), копию проверочного листа получил(а):
________________________________________________________________________________________________________
________________________________________________________________________________________________________
(фамилия, имя, отчество (последнее - при наличии), должность руководителя, иного должностного лица или уполномоченного представителя юридического лица, индивидуального предпринимателя, его уполномоченного представителя)
| “ | ” | 20 | 1 | г. |
|---|
(подпись)
Рекомендации по заполнению контрольного листа (списка контрольных вопросов):
в позиции «ДА» проставляется отметка, если предъявляемое требование реализовано в полном объеме;
в позиции «НЕТ» проставляется отметка, если предъявляемое требование не реализовано или реализовано не в полном объеме;
в позиции «Не требуется» проставляется отметка, если предъявляемое требование не подлежит реализации проверяемым субъектом и (или) контролю (надзору) применительно к данному проверяемому субъекту);
в позиции «Примечание» отражаются поясняющие записи, если предъявляемое требование реализовано не в полном объеме, и иные пояснения.
Утверждено
приказом Россельхознадзора
от ________________N_____
Федеральная служба по ветеринарному и фитосанитарному надзору
____________________________________________________________________________________________
наименование органа государственного контроля (надзора)
Государственный контроль (надзор) в сфере обращения лекарственных средств для ветеринарного применения
(Производство жидкостей, кремов и мазей)
____________________________________________________________________________________________
вид государственного контроля (надзора
Проверочный лист (список контрольных вопросов)
По адресу/адресам:
_____________________________________________________________________________________________
_____________________________________________________________________________________________
(место проведения проверки)
_____________________________________________________________________________________________
_____________________________________________________________________________________________
На основании:
_____________________________________________________________________________________________
_____________________________________________________________________________________________
(вид документа с указанием реквизитов (номер, дата))
_____________________________________________________________________________________________
была проведена плановая проверка в отношении:
_____________________________________________________________________________________________
(наименование юридического лица, фамилия, имя, отчество (последнее - при наличии) индивидуального предпринимателя)
_____________________________________________________________________________________________
(учетный номер проверки и дата присвоения учетного номера проверки в едином реестре проверок)
Лицо(а), проводившее проверку:
_____________________________________________________________________________________________
_____________________________________________________________________________________________
_____________________________________________________________________________________________
_____________________________________________________________________________________________
_____________________________________________________________________________________________
(фамилия, имя, отчество (последнее - при наличии), должность должностного лица (должностных лиц), проводившего(их) проверку; в случае привлечения к участию в проверке экспертов, экспертных организаций указываются фамилии, имена, отчества (последнее - при наличии), должности экспертов и/или наименования экспертных организаций с указанием реквизитов свидетельства об аккредитации и наименование органа по аккредитации, выдавшего свидетельство)
При проведении проверки присутствовали:
_____________________________________________________________________________________________
_____________________________________________________________________________________________
_____________________________________________________________________________________________
_____________________________________________________________________________________________
(фамилия, имя, отчество (последнее - при наличии), должность руководителя, иного должностного лица (должностных лиц) или уполномоченного представителя юридического лица, уполномоченного представителя индивидуального предпринимателя, уполномоченного представителя саморегулируемой организации (в случае проведения проверки члена саморегулируемой организации), присутствовавших при проведении мероприятий по проверке)
| № п/п | Перечень предъявляемых требований | Структурные элементы нормативных правовых актов и технических нормативных правовых актов | Да | Нет | Не требуется | Способ подтверждения соблюдения обязательных требований*(1) | Примечание |
|---|---|---|---|---|---|---|---|
| 1. | Для защиты от контаминации при производстве и перемещении продукции используются закрытые системы | п.2 (1) Приложение № 9 Правил Приказ Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | |||||
| 2. | Производственные зоны, в которых находится открытая продукция или открытые чистые упаковки, вентилируются отфильтрованным воздухом. | п.2 (1) Приложение № 9 Правил Приказ Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | |||||
| 3. | Конструкция и расположение реакторов, емкостей, трубопроводов и насосов предусматривает удобство их очистки и санитарной обработки | п. 3 (2) Приложение № 9 Правил Приказ Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | |||||
| 4. | Части оборудования, контактирующие с продукцией, изготовлены из высококачественной нержавеющей стали | п. 4 (3) Приложение № 9 Правил Приказ Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | |||||
| 5. | Документально подтверждено проведение обслуживания систем подготовки воды и контроль качества используемой воды | п.5 (4) Приложение № 9 Правил Приказ Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | |||||
| 6. | Имеется документированная процедура о проведении санитарной обработки систем подготовки воды | п.5 (4) Приложение № 9 Правил Приказ Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | |||||
| 7. | Проведена валидация процесса санитарной обработки систем подготовки воды |
п.5 (4) Приложение № 9 Правил Приказ Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" |
|||||
| 8. | Качество сырья проверяется до его перемещения в емкости для хранения, что подтверждено документально. | п.6 (5) Приложение № 9 Правил Приказ Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | |||||
| 9. | Передача сырья по трубопроводам контролируется | п.7 (6) Приложение № 9 Правил Приказ Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | |||||
| 10. | Отсутствует возможность контаминации в помещениях, где содержится открытая продукция или открытые чистые упаковки | п.8 (7) Приложение № 9 Правил Приказ Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | |||||
| 11. | Обеспечено сохранение однородности смесей, суспензий и иных нерасфасованных продуктов во время фасовки | п.9 (8) Приложение № 9 Правил Приказ Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | |||||
| 12. | Обеспечено сохранение однородности смеси в начале, после остановок и в конце процесса наполнения | п.9 (8) Приложение № 9 Правил Приказ Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | |||||
| 13. | Проведена валидация процессов смешивания и фасовки | п.9 (8) Приложение № 9 Правил Приказ Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | |||||
| 14. | В документах установлено допустимое время хранения готового продукта до его упаковки | п.10 (9)Приложение № 9 Правил Приказ Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" |
Подписи лиц, проводивших проверку:
_____________________________________________________________________________________________
_____________________________________________________________________________________________
_____________________________________________________________________________________________
_____________________________________________________________________________________________
С результатами проверки ознакомлен(а), копию проверочного листа получил(а):
_____________________________________________________________________________________________
_____________________________________________________________________________________________
(фамилия, имя, отчество (последнее - при наличии), должность руководителя, иного должностного лица или уполномоченного представителя юридического лица, индивидуального предпринимателя, его уполномоченного представителя)
«____»____________________20____г
(подпись)
Рекомендации по заполнению контрольного листа (списка контрольных вопросов):
в позиции «ДА» проставляется отметка, если предъявляемое требование реализовано в полном объеме;
в позиции «НЕТ» проставляется отметка, если предъявляемое требование не реализовано или реализовано не в полном объеме;
в позиции «Не требуется» проставляется отметка, если предъявляемое требование не подлежит реализации проверяемым субъектом и (или) контролю (надзору) применительно к данному проверяемому субъекту);
в позиции «Примечание» отражаются поясняющие записи, если предъявляемое требование реализовано не в полном объеме, и иные пояснения.
-------------------------------------------
*(1) Используется следующие способы: 1) документарный; 2) визуальный; 3) дополнительные исследования/испытания (при необходимости)
Утверждено
приказом Россельхознадзора
от ________________N_____
Федеральная служба по ветеринарному и фитосанитарному надзору
__________________________________________________________________________________
наименование органа государственного контроля (надзора)
Государственный контроль (надзор) в сфере обращения лекарственных средств для ветеринарного применения
(в части производства иммунобиологических лекарственных средств для ветеринарного применения)
__________________________________________________________________________________
вид государственного контроля (надзора
Проверочный лист (список контрольных вопросов)
По адресу/адресам:
__________________________________________________________________________________
__________________________________________________________________________________
(место проведения проверки)
На основании:
__________________________________________________________________________________
__________________________________________________________________________________
(вид документа с указанием реквизитов (номер, дата)
была проведена плановая проверка в отношении:
__________________________________________________________________________________
(наименование юридического лица, фамилия, имя, отчество (последнее - при наличии) индивидуального предпринимателя)
__________________________________________________________________________________
(учетный номер проверки и дата присвоения учетного номера проверки в едином реестре проверок)
Лицо(а), проводившее проверку:
__________________________________________________________________________________
__________________________________________________________________________________
__________________________________________________________________________________
__________________________________________________________________________________
__________________________________________________________________________________
(фамилия, имя, отчество (последнее - при наличии), должность должностного лица (должностных лиц), проводившего(их) проверку; в случае привлечения к участию в проверке экспертов, экспертных организаций указываются фамилии, имена, отчества (последнее - при наличии), должности экспертов и/или наименования экспертных организаций с указанием реквизитов свидетельства об аккредитации и наименование органа по аккредитации, выдавшего свидетельство)
При проведении проверки присутствовали:
__________________________________________________________________________________
__________________________________________________________________________________
__________________________________________________________________________________
__________________________________________________________________________________
(фамилия, имя, отчество (последнее - при наличии), должность руководителя, иного должностного лица (должностных лиц) или уполномоченного представителя юридического лица, уполномоченного представителя индивидуального предпринимателя, уполномоченного представителя саморегулируемой организации (в случае проведения проверки члена саморегулируемой организации), присутствовавших при проведении мероприятий по проверке
| № п/п | Перечень предъявляемых требований | Структурные элементы нормативных правовых актов и технических нормативных правовых актов | Да | Нет | Не требуется | Способ подтверждения соблюдения обязательных требований*(1) | Примечание |
|---|---|---|---|---|---|---|---|
| II. ПЕРСОНАЛ | |||||||
| 1. | Проводится и документально оформляется ( с результатами) обучение по личной гигиене и микробиологии и дополнительное обучение в соответствии со спецификой производимой продукции. с работниками (включая персонал, занимающийся очисткой и обслуживанием помещений и оборудования), работающими в зонах производства иммунобиологической продукции, | п. 4. (1) приложения №5 Правил Приказ Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | |||||
| 2. | Документально закреплены лица, ответственные за производство и контроль качества, в соответствии с выполняемыми ими функциями. Указанные лица имеют соответствующую подготовку по таким предметам, как: бактериология, биология, биометрия, химия, иммунология, медицина, паразитология, фармация, фармакология, вирусология и ветеринария. | п. 5. (2) приложения №5 Правил Приказ Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | |||||
| 3. | документально оформлены результаты мероприятий, которые принимают на предприятии с целью особых мер по защите персонала, работающего с микроорганизмами или экспериментальными животными, которые являются возбудителями болезней человека. | п. 6. (3) приложения №5 Правил Приказ Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | |||||
| 4. | Документально закреплено и осуществляется в зависимости от вида микроорганизмов полное переодевание и обязательное принятие душа перед выходом из производственной зоны. | п. 8. (4) приложения №5 Правил Приказ Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | |||||
| 5. | Документально оформлены мероприятия по предотвращению риска контаминации и перекрестной контаминации, вызываемой персоналом; выполняют мероприятия для предотвращения контаминации, вызываемой персоналом; используется защитная одежда персоналом на различных стадиях технологического процесса; соответствует ли защитная одежда требованиям для различных стадий технологического процесса; имеется процедура, описывающая правила переодевания, ношения, замены, стирки и т.д. защитной одежды; ведется учет количества стирок; | п. 9. (5) приложения №5 Правил Приказ Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | |||||
| 6. | имеется инструкция для персонала по соблюдению правил перемещения в производственных зонах с целью предотвращения перекрестной контаминации, в том числе по смене одежды, обуви, и по принятию душа. | п. 10. приложения №5 Правил Приказ Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | |||||
| III. ПОМЕЩЕНИЯ | |||||||
| 7. | Документально подтверждено, что предусмотрена защита продукции и производственной среды при проектировании помещений | п. 12. (6) приложения №5 Правил Приказ Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | |||||
| 8. | используются изолированные, чистые, чистые изолированные или контролируемые зоны при операциях с инактивированными микроорганизмами. | п. 12. (6) приложения №5 Правил Приказ Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | |||||
| 9. | при работе с неинфицированными клетками, выделенными из многоклеточных организмов, и в некоторых случаях при работе со средами, прошедшими стерилизующую фильтрацию используются чистые зоны. | п. 14. (8) приложения №5 Правил Приказ Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | |||||
| 10. | предусмотрены боксы (установки) с однонаправленным (ламинарным) потоком воздуха класса A, находящиеся в зоне класса B для проведения операций с открытыми продуктами или компонентами первичной упаковки, которые не подлежат дальнейшей стерилизации. | п. 15. (9) приложения №5 Правил Приказ Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | |||||
| 11. | предусмотрена изоляция помещений, если производство иммунобиологических лекарственных средств для ветеринарного применения находится в том же здании, где осуществляются операции с живыми микроорганизмами (в частности, контроль качества, исследования и диагностика). | п. 16. (10) приложения №5 Правил Приказ Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | |||||
| 12. | степень изоляции соответствует всем предусмотренным рискам. | п. 16. (10) приложения №5 Правил Приказ Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | |||||
| 13. | изолированные помещения соответствуют требованиям: а) (a) отсутствие прямого выхода вентилируемого воздуха наружу; б) (b) наличие вентиляции с обеспечением отрицательного перепада давления (разрежения). в) (c) наличие двух последовательно установленных HEPA-фильтра для воздуха, выходящего из производственных зон, в которых проводится работа с экзотическими микроорганизмами. г) (d) наличие системы сбора и дезинфекции жидких отходов, включая контаминированный конденсат из стерилизаторов, биореакторов. д) (e) предусмотрено наличие умывальников и душевых кабин в комнатах для переодевания и воздушных шлюзов для персонала. е) (f) предусмотрено наличие воздушных шлюзов для перемещения оборудования ж) (g) предусмотрено наличие проходного автоклава с двумя дверями для безопасного удаления отходов и подачи стерильных предметов. | п. 17. (11) приложения №5 Правил Приказ Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | |||||
| 14. | оборудованы передаточные шлюзы и комнаты для переодевания блокирующими или другими подходящими устройствами, препятствующими одновременному открыванию более чем одной двери. | п. 18. (12) приложения №5 Правил Приказ Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | |||||
| 15. | подается в шлюзы и комнаты отфильтрованный воздух той же степени очистки, что и для производственных зон. | п. 18. (12) приложения №5 Правил Приказ Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | |||||
| 16. | предусмотрены отдельные зоны для технологического процесса, при которых может произойти контаминация продукции (например, хранение клеток, приготовление сред, культивирование вирусов). | п. 19. (13) приложения №5 Правил Приказ Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | |||||
| 17. | выполняются операции с микроорганизмами, проявляющими высокую устойчивость к дезинфекции (например, спорообразующие бактерии), до их инактивации в специально предназначенных для проведения таких операций в изолированных зонах. | п. 20. (14) приложения №5 Правил Приказ Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | |||||
| 18. | предусмотрено в производственной зоне одновременно проводить работы с микроорганизмами только одного вида, за исключением процессов смешивания и последующей фасовки. | п. 21. (15) приложения №5 Правил Приказ Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | |||||
| 19. | предусмотрена возможность проведения дезинфекции производственных зон в промежутках между производственными циклами с использованием валидированных методов. | п. 22. (16) приложения №5 Правил Приказ Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | |||||
| 20. | валидированы процессы стерилизации оборудования, соединений, используемых в работе с микроорганизмами (для всех используемых микроорганизмов) к которым предъявляются особые требования изоляции. | п. 23. (17) приложения №5 Правил Приказ Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | |||||
| 21. | поддерживается режим изолированной и (или) чистой зоны в помещениях для содержания животных, предназначенных для использования (или используемых) в производстве и контроле качества. | п. 24. (18) приложения №5 Правил Приказ Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | |||||
| 22. | предусмотрена инструкция, допускающая в производственные зоны работников, имеющих на это разрешение. | п. 25. (19) приложения №5 Правил Приказ Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | |||||
| 23. | разработана документация описания производственных участков и зданий (путем включения планов помещений и их экспликации), назначения и условий использования всех помещений, а также видов биологических агентов, с которыми проводится работа, с четким обозначением направления движения персонала и продукции, с указанием видов животных, содержащихся в вивариях или других помещениях производственной площадки, а также видов работ, выполняемых вблизи производственного участка. | п. 27.(19) приложения №5 Правил Приказ Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | |||||
| IV. ОБОРУДОВАНИЕ | |||||||
| 24. | перед вводом в эксплуатацию проведена квалификация и валидация оборудования. | п. 30. приложения №5 Правил Приказ Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | |||||
| 25. | проводится регулярное техническое обслуживание и повторная валидация оборудования. |
п. 30. приложения №5 Правил Приказ Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" |
|||||
| 26. | обеспечивает оборудование удовлетворительную первичную изоляцию биологических агентов. | п. 31. (22) приложения №5 Правил Приказ Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | |||||
| 27. | предусматривает предотвращение утечек, образования капель и аэрозолей конструкция и монтаж закрытого оборудования, используемого для первичной изоляции биологических агентов. | п. 32. (23) приложения №5 Правил Приказ Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | |||||
| 28. | защищены вводы и выводы газов обеспечивающие нужную степень изоляции, например, путем использования стерилизующих гидрофобных фильтров. | п. 33. приложения №5 Правил Приказ Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | |||||
| 29. | для подачи или удаления материалов используется стерилизуемая закрытая система либо соответствующие условия ламинарного потока воздуха. | п. 34. приложения №5 Правил Приказ Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | |||||
| 30. | оборудование стерилизуется перед использованием. | п. 35. (24) приложения №5 Правил Приказ Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | |||||
| 31. | при переходе от использования одного вида продукта к другому с целью определения срока его эксплуатации учитывается влияние методов стерилизации на эффективность и валидационный статус оборудования, используемого для очистки, разделения или концентрирования. | п. 36. приложения №5 Правил Приказ Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | |||||
| 32. | валидированы все методы стерилизации. | п. 37. приложения №5 Правил Приказ Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | |||||
| 33. | маркированы трубопроводы, клапаны и фильтры в соответствии с их назначением с целью исключения возможности перепутывания различных организмов или продуктов. | п. 38. (25) приложения №5 Правил Приказ Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | |||||
| 34. | маркированы сосуды с культурами и прочим содержимым индивидуально. | п. 39. приложения №5 Правил Приказ Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | |||||
| 35. | в одном инкубаторе содержится не более одного типа организмов или типа клеток. | п. 39. приложения №5 Правил Приказ Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | |||||
| 36. | исключено любое возможное перепутывание конструкций и порядок эксплуатации оборудования, используемого для хранения биологических агентов или продуктов. | п. 40. приложения №5 Правил Приказ Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | |||||
| 37. | имеют четкую и однозначную маркировку все хранящиеся запасы посевных культур клеток и организмов. | п. 41. приложения №5 Правил Приказ Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | |||||
| 38. | организовано хранение образцов в контейнерах, защищенных от утечки. | п. 41. приложения №5 Правил Приказ Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | |||||
| 39. | Оборудование, требующее контроля температуры имеет регистрирующие устройства и (или) систему сигнализации. | п. 42. (26) приложения №5 Правил Приказ Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | |||||
| 40. | организована система профилактического обслуживания оборудования на основании анализов тенденций регистрируемых данных, что документально подтвержено. | п. 42. (26) приложения №5 Правил Приказ Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | |||||
| 41. | загрузка лиофильных сушильных установок происходит в чистой и (или) изолированной зоне. | п. 43. (27) приложения №5 Правил Приказ Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | |||||
| 42. | Документально подтверждено,что стерилизация двусторонних лиофильных сушильных установок осуществляется после каждого цикла производства. | п. 43. (27) приложения №5 Правил Приказ Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | |||||
| 43. | стерилизация лиофильных сушильных установок при организации работ по принципу отдельных циклов производства проводится после каждого цикла. Документально подтверждено. | п. 44. (27) приложения №5 Правил Приказ Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | |||||
| V. ЖИВОТНЫЕ И ВИВАРИИ | |||||||
| 44. | виварий изолирован от других производственных помещений. | п. 46. (29) приложения №5 Правил Приказ Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | |||||
| 45. | санитарное состояние животных, используемых в производстве оценивается, контролируется и регистрируется. | п. 47. (30) приложения №5 Правил Приказ Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | |||||
| 46. | предусмотрена система идентификации животных, биологических агентов и проводимых испытаний во избежание риска перепутывания и с целью контроля всех возможных видов опасностей. | п. 48. (31) приложения №5 Правил Приказ Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | |||||
| 47. | выполняется установленная система идентификации животных, биологических агентов и проводимых испытаний во избежание риска перепутывания и с целью контроля всех возможных видов опасностей. | п. 48. (31) приложения №5 Правил Приказ Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | |||||
| VI. ДЕЗИНФЕКЦИЯ. УДАЛЕНИЕ ОТХОДОВ | |||||||
| 48. | валидированы методы и оборудование используемое при проведении дезинфекции и (или) удалении твердых и жидких отходов для предотвращения загрязнения окружающей среды. | п. 49. (32) приложения №5 Правил Приказ Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | |||||
| VII. ПРОИЗВОДСТВО | |||||||
| 49. | валидированы все технологические процессы. | п. 50. (33) приложения №5 Правил Приказ Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | |||||
| 50. | соблюдаются требования выполнения всех валидированых технологических процессов. | п. 50. (33) приложения №5 Правил Приказ Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | |||||
| VIII. ИСХОДНОЕ СЫРЬЕ | |||||||
| 51. | содержит спецификация на исходное сырье данные о поставщике, методе производства, его месте расположения и видах животных, из которых получено это исходное сырье, а также о способах его контроля. | п. 51. (34) приложения №5 Правил Приказ Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | |||||
| 52. | результаты испытаний исходного сырья соответствуют спецификациям. | п. 52. (35) приложения №5 Правил Приказ Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | |||||
| 53. | проводится оценка данных о системе обеспечения качества поставщика при оценке соответствия источников сырья и материалов и объеме испытаний, требуемых при проведении входного контроля качества. | п. 53. (36) приложения №5 Правил Приказ Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | |||||
| 54. | используются валидированные методы стерилизации исходного сырья. | п. 54. (37) приложения №5 Правил Приказ Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | |||||
| Среды | |||||||
| 55. | проводятся испытания на ростовые свойства сред соответствующим образом. | п. 55. (38) приложения №5 Правил Приказ Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | |||||
| 56. | предусмотрена стерилизация среды на месте или на линии | п. 56. (39) приложения №5 Правил Приказ Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | |||||
| 57. | газы, среды, кислоты, щелочи, пеногасители и другие вещества, вводимые в стерильный биореактор стерилизуют, что подтверждено документально | п. 56. (39) приложения №5 Правил Приказ Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | |||||
| Система посевных культур и банков клеток | |||||||
| 58. | учитывается количество пересевов или большое число генераций в системе посевных культур или банков клеток, с целью предотвращения нежелательного изменения свойств, которое могут произойти вследствие многократных производств иммунобиологических лекарственных препаратов для ветеринарного применения, получаемых из культур микроорганизмов, культур клеток, тканей или размножением в эмбрионах и животных. | п. 57. (40) приложения №5 Правил Приказ Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | |||||
| 59. | выполняется соответствие требованиям регистрационного досье по количеству генераций (удвоений, пассажей) между посевной культурой или банком клеток и готовой продукцией. | п. 58. (41) приложения №5 Правил Приказ Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | |||||
| 60. | Установлены и документально закреплены критерии приемлемости для посевных культур и банков клеток для различия и контроля на отсутствие контаминантов. | п. 59. (42) приложения №5 Правил Приказ Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | |||||
| 61. | соблюдаются установленные требования к производственной среде для защиты посевных культур и банков клеток, а также работающего с ними персонала и охраны внешней окружающей среды. | п. 60. (43) приложения №5 Правил Приказ Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | |||||
| 62. | разработана соответствующая документация с описанием происхождения, формы и условий хранения посевных культур с доказательством стабильности и воспроизводимости посевных культур и клеток. | п. 61. (44) приложения №5 Правил Приказ Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | |||||
| 63. | производитель контролирует условия хранения посевных культур и клеток, ведет тщательный учет каждого хранящегося контейнера. | п. 61. (44) приложения №5 Правил Приказ Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | |||||
| 64. | предусмотрено ответственное лицо, контролирующее работу с посевными культуры и банками клеток | п. 62. (45) приложения №5 Правил Приказ Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | |||||
| Принципы работы | |||||||
| 65. | предусмотрено использование изолированных или чистых емкостей для процесса центрифугирования или смешивания, которые могут привести к образованию капель, или в чистых и (или) изолированных зонах во избежание переноса живых организмов. | п. 63. (46) приложения №5 Правил Приказ Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | |||||
| 66. | применяются валидированные процедуры деконтаминации в случае проливы жидкостей, особенно содержащих живые организмы. | п. 64. (47) приложения №5 Правил Приказ Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | |||||
| 67. | предусмотрены валидированные процедуры в случае использования различных штаммов бактерий. | п. 64. (47) приложения №5 Правил Приказ Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | |||||
| 68. | операции, включающие в себя перемещение таких материалов, как стерильные среды, культуры или продукты, проводятся в предварительно стерилизованных закрытых системах. | п. 65. (48) приложения №5 Правил Приказ Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | |||||
| 69. | контролируются условия при добавлении сред или культур в биореакторы и другие сосуды, обеспечивающие невозможность внесения контаминантов. | п. 66. (49) приложения №5 Правил Приказ Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | |||||
| 70. | стерилизуются отверстия для отбора проб, внесения добавок и соединительные элементы паром (после подсоединения, перед подачей продукта и перед отсоединением). | п. 67. (50) приложения №5 Правил Приказ Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | |||||
| 71. | осуществляется дезинфекция оборудования, лабораторной посуды, внешних поверхностей контейнеров с продукцией и других подобных материалов перед перемещением из изолированной зоны | п. 68. (51) приложения №5 Правил Приказ Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | |||||
| 72. | валидирован метод дезинфекции оборудования, лабораторной посуды, внешних поверхностей контейнеров с продукцией и других подобных материалов перед перемещением из изолированной зоны | п. 68. (51) приложения №5 Правил Приказ Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | |||||
| 73. | ведется учет за соответствием количества вносимых и выносимых предметов и материалов. | п. 70. (53) приложения №5 Правил Приказ Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | |||||
| 74. | предусмотрены проходные автоклавы или сухожаровые печи для передачи термостойких предметов и материалов в чистую или чистую изолированную зону. | п. 71. (54) приложения №5 Правил Приказ Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | |||||
| 75. | предусмотрены воздушные шлюзы с блокируемыми дверями для передачи чувствительных к нагреву предметов и материалов, где эти предметы и материалы подвергаются дезинфекции. Допускается стерилизация предметов и материалов в другом месте, если они поступают через шлюз в двойной оболочке с соблюдением необходимых. | п. 71. (54) приложения №5 Правил Приказ Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | |||||
| 76. | предусмотрена стерилизация предметов и материалов в другом месте, если они поступают через шлюз в двойной оболочке с соблюдением необходимых мер предосторожности. | п. 71. (54) приложения №5 Правил Приказ Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | |||||
| 77. | осуществляются соответствующие меры предосторожности во избежание контаминации или перепутывания культур клеток или микроорганизмов на протяжении периода инкубации. | п. 72. (55) приложения №5 Правил Приказ Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | |||||
| 78. | предусмотрено при инактивировании тщательное перемешивание продукта с инактиватором с последующим переносом во второй стерильный сосуд, за исключением случаев, когда форма и размер сосуда позволяют его легко переворачивать и встряхивать таким образом, чтобы все внутренние поверхности смачивались конечной смесью культуры и инактиватора. | п. 74. (57) приложения №5 Правил Приказ Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | |||||
| 79. | разработана процедура, определяющая правила при работе с живыми биологическими агентами и запрещающая открывание сосудов, содержащих инактивированный продукт, а также отбор проб в зонах, где содержатся живые биологические агенты. | п. 75. (58) приложения №5 Правил Приказ Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | |||||
| 80. | Емкости с нерасфасованной продукцией до начала операции наполнения герметично закрыты, соответствующим образом маркированы и хранятся при установленных температурных условиях. | п. 77. (60) приложения №5 Правил Приказ Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | |||||
| 81. | разработана система, обеспечивающая контроль целостности и герметичности упаковок после наполнения. | п. 78. (61) приложения №5 Правил Приказ Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | |||||
| 82. | разработана процедура описывающая порядок хранения немаркированных контейнеров для предотвращения возможности их перепутывания и обеспечивающие надлежащие условия хранения, с учетом хранения термолабильной и светочувствительной продукции и установлением требований к температуре хранения. | п. 80. (63) приложения №5 Правил Приказ Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | |||||
| 83. | определен промежуток времени между наполнением первичных упаковок, их маркировкой и упаковкой. | п. 80. (63) приложения №5 Правил Приказ Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | |||||
| 84. | проводится сопоставление фактического и ожидаемого выхода продукции на каждой технологической стадии. | п. 81. (64) приложения №5 Правил Приказ Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | |||||
| 85. | проводится расследование всех существенных отклонений. | п. 81. (64) приложения №5 Правил Приказ Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | |||||
| IX. КОНТРОЛЬ КАЧЕСТВА | |||||||
| 86. | осуществляется контроль в процессе производства с целью обеспечения стабильности качества иммунобиологических лекарственных средств. | п. 82. (65) приложения №5 Правил Приказ Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | |||||
| 87. | проводится контроль на отсутствие вирусов | п. 82. (65) приложения №5 Правил Приказ Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | |||||
| 88. | проводится контроль на отсутствие вирусов на одной из предшествующих стадий производства. | п. 82. (65) приложения №5 Правил Приказ Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | |||||
| 89. | хранится достаточный объем образцов промежуточных продуктов при соответствующих условиях для повторного проведения контроля качества серии продукции или подтверждения результатов в случае необходимости. | п. 83. (66) приложения №5 Правил Приказ Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | |||||
| 90. | предусмотрен непрерывный контроль параметров в ходе процесса производства (например, непрерывного контроля физических параметров в ходе ферментации) в случае необходимости. | п. 84. (67) приложения №5 Правил Приказ Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | |||||
| 91. | соблюдаются специальные требования к организации контроля качества продукции при непрерывном культивировании биологической продукции. | п. 85. (68) приложения №5 Правил Приказ Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | |||||
Подписи лиц, проводивших проверку:_______________________________________________________________________________________________________________
__________________________________________________________________________________
__________________________________________________________________________________
С результатами проверки ознакомлен(а), копию проверочного листа получил(а):
__________________________________________________________________________________
__________________________________________________________________________________
(фамилия, имя, отчество (последнее - при наличии), должность руководителя, иного должностного лица или уполномоченного представителя юридического лица, индивидуального предпринимателя, его уполномоченного представителя)
«____»_____________________ 20____г
(подпись)
Рекомендации по заполнению контрольного листа (списка контрольных вопросов):
в позиции «ДА» проставляется отметка, если предъявляемое требование реализовано в полном объеме;
в позиции «НЕТ» проставляется отметка, если предъявляемое требование не реализовано или реализовано не в полном объеме;
в позиции «Не требуется» проставляется отметка, если предъявляемое требование не подлежит реализации проверяемым субъектом и (или) контролю (надзору) применительно к данному проверяемому субъекту);
в позиции «Примечание» отражаются поясняющие записи, если предъявляемое требование реализовано не в полном объеме, и иные пояснения.
-------------------------------------------
*(1) Используется следующие способы: 1) документарный; 2) визуальный; 3) дополнительные исследования/испытания (при необходимости)
Утверждено
приказом Россельхознадзора
от ________________N_____
Федеральная служба по ветеринарному и фитосанитарному надзору
______________________________________________________________________________________________________________
наименование органа государственного контроля (надзора)
Государственный контроль (надзор) в сфере обращения лекарственных средств для ветеринарного применения
(в части производства дозированных аэрозольных лекарственных препаратов под давлением для ингаляций)
______________________________________________________________________________________________________________
вид государственного контроля (надзора
Проверочный лист (список контрольных вопросов)
По адресу/адресам:
______________________________________________________________________________________________________________
______________________________________________________________________________________________________________
(место проведения проверки)
На основании:
______________________________________________________________________________________________________________
______________________________________________________________________________________________________________
(вид документа с указанием реквизитов (номер, дата)
была проведена плановая проверка в отношении:
______________________________________________________________________________________________________________
(наименование юридического лица, фамилия, имя, отчество (последнее - при наличии) индивидуального предпринимателя)
______________________________________________________________________________________________________________
(учетный номер проверки и дата присвоения учетного номера проверки в едином реестре проверок)
Лицо(а), проводившее проверку:
______________________________________________________________________________________________________________
______________________________________________________________________________________________________________
______________________________________________________________________________________________________________
______________________________________________________________________________________________________________
______________________________________________________________________________________________________________
(фамилия, имя, отчество (последнее - при наличии), должность должностного лица (должностных лиц), проводившего(их) проверку; в случае привлечения к участию в проверке экспертов, экспертных организаций указываются фамилии, имена, отчества (последнее - при наличии), должности экспертов и/или наименования экспертных организаций с указанием реквизитов свидетельства об аккредитации и наименование органа по аккредитации, выдавшего свидетельство)
При проведении проверки присутствовали:
______________________________________________________________________________________________________________
______________________________________________________________________________________________________________
______________________________________________________________________________________________________________
______________________________________________________________________________________________________________
(фамилия, имя, отчество (последнее - при наличии), должность руководителя, иного должностного лица (должностных лиц) или уполномоченного представителя юридического лица, уполномоченного представителя индивидуального предпринимателя, уполномоченного представителя саморегулируемой организации (в случае проведения проверки члена саморегулируемой организации), присутствовавших при проведении мероприятий по проверке
| № п/п | Перечень предъявляемых требований | Структурные элементы нормативных правовых актов и технических нормативных правовых актов | Да | Нет | Не требуется | Способ подтверждения соблюдения обязательных требований*(1) |
|---|---|---|---|---|---|---|
| 1. | производство аэрозольных лекарственных препаратов под давлением с дозирующими клапанами, предназначенных для ингаляций, осуществляют в условиях, сводящих к минимуму контаминацию микроорганизмами и частицами | п. 1. Приложение №10 Правил Приказ Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | ||||
| 2. | производство и наполнение проводятся в закрытых системах | п. 3. (2) Приложение №10 Правил Приказ Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | ||||
| 3. | зона, в которой продукция или чистые компоненты содержатся открытыми, снабжена отфильтрованным воздухом и соответствует требованиям к производственной среде, по крайней мере, класса D. Вход в зону осуществляется через воздушные шлюзы | п. 4. (3) Приложение №10 Правил Приказ Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | ||||
| 4. | сложность дозирующих клапанов учтена в спецификациях на них, а также при отборе проб и испытаниях. Документально подтверждено проведение аудита фармацевтической системы качества у производителя дозирующих клапанов | п. 5. (4) Приложение №10 Правил Приказ Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | ||||
| 5. | Документально подтверждено, что все жидкости профильтрованы для удаления частиц, размер которых больше 0,2 мкм. Проведена дополнительная фильтрация непосредственно перед наполнением | п. 6. (5) Приложение №10 Правил Приказ Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | ||||
| 6. | контейнеры и клапаны очищаются согласно валидированной процедуре, которая соответствует назначению лекарственного препарата и обеспечивает отсутствие любой контаминации, что подтверждено документально | п. 7. (6) Приложение №10 Правил Приказ Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | ||||
| 7. | после очистки клапаны хранятся в чистых закрытых емкостях, приняты меры предосторожности, предотвращающие контаминацию во время последующих операций. Упаковки поступают на линию наполнения в чистом виде или очищаются на линии непосредственно перед наполнением | п. 7. (6) Приложение №10 Правил Приказ Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | ||||
| 8. | Подтверждена однородность суспензии в точке наполнения в ходе всего процесса наполнения | п. 8. (7) Приложение №10 Правил Приказ Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | ||||
| 9. | Производится 100%-ный контроль массы на каждой стадии при использовании метода двухстадийного наполнения для достижения правильного состава. | п. 9. (8) Приложение №10 Правил Приказ Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | ||||
| 10. | контроль после наполнения подтверждает отсутствие утечек. Проверка на наличие утечек проводится так, чтобы не допустить микробной контаминации или остаточной влаги | п. 10. (9) Приложение №10 Правил |
Подписи лиц, проводивших проверку:_______________________________________________________________________________________________________________
______________________________________________________________________________________________________________
______________________________________________________________________________________________________________
______________________________________________________________________________________________________________
С результатами проверки ознакомлен(а), копию проверочного листа получил(а):
______________________________________________________________________________________________________________
______________________________________________________________________________________________________________
(фамилия, имя, отчество (последнее - при наличии), должность руководителя, иного должностного лица или уполномоченного представителя юридического лица, индивидуального предпринимателя, его уполномоченного представителя)
«____»_____________________ 20____г
(подпись)
Рекомендации по заполнению контрольного листа (списка контрольных вопросов):
в позиции «ДА» проставляется отметка, если предъявляемое требование реализовано в полном объеме;
в позиции «НЕТ» проставляется отметка, если предъявляемое требование не реализовано или реализовано не в полном объеме;
в позиции «Не требуется» проставляется отметка, если предъявляемое требование не подлежит реализации проверяемым субъектом и (или) контролю (надзору) применительно к данному проверяемому субъекту);
в позиции «Примечание» отражаются поясняющие записи, если предъявляемое требование реализовано не в полном объеме, и иные пояснения.
-------------------------------------------
*(1) Используется следующие способы: 1) документарный; 2) визуальный; 3) дополнительные исследования/испытания (при необходимости)
утверждено
приказом Россельхоза
от ___________________N____
Федеральная служба по ветеринарному и фитосанитарному надзору
______________________________________________________________________________________________________________
наименование органа государственного контроля (надзора)
Государственный контроль (надзор) в сфере обращения лекарственных средств для ветеринарного применения
(в части производства лекарственных растительных препаратов)
______________________________________________________________________________________________________________
вид государственного контроля (надзора
Проверочный лист (список контрольных вопросов)
По адресу/адресам:
______________________________________________________________________________________________________________
______________________________________________________________________________________________________________
(место проведения проверки)
На основании:
______________________________________________________________________________________________________________
______________________________________________________________________________________________________________
(вид документа с указанием реквизитов (номер, дата)
была проведена плановая проверка в отношении:
______________________________________________________________________________________________________________
(наименование юридического лица, фамилия, имя, отчество (последнее - при наличии) индивидуального предпринимателя)
______________________________________________________________________________________________________________
(учетный номер проверки и дата присвоения учетного номера проверки в едином реестре проверок)
Лицо(а), проводившее проверку:
______________________________________________________________________________________________________________
______________________________________________________________________________________________________________
______________________________________________________________________________________________________________
______________________________________________________________________________________________________________
______________________________________________________________________________________________________________
(фамилия, имя, отчество (последнее - при наличии), должность должностного лица (должностных лиц), проводившего(их) проверку; в случае привлечения к участию в проверке экспертов, экспертных организаций указываются фамилии, имена, отчества (последнее - при наличии), должности экспертов и/или наименования экспертных организаций с указанием реквизитов свидетельства об аккредитации и наименование органа по аккредитации, выдавшего свидетельство)
При проведении проверки присутствовали:
______________________________________________________________________________________________________________
______________________________________________________________________________________________________________
______________________________________________________________________________________________________________
______________________________________________________________________________________________________________
(фамилия, имя, отчество (последнее - при наличии), должность руководителя, иного должностного лица (должностных лиц) или уполномоченного представителя юридического лица, уполномоченного представителя индивидуального предпринимателя, уполномоченного представителя саморегулируемой организации (в случае проведения проверки члена саморегулируемой организации), присутствовавших при проведении мероприятий по проверке
| № п/п | Перечень предъявляемых требований | Структурные элементы нормативных правовых актов и технических нормативных правовых актов | Да | Нет | Не требуется | Способ подтверждения соблюдения обязательных требований*(1) |
|---|---|---|---|---|---|---|
| 1. | Лекарственное сырье должно иметь качество, которое подтверждено соответствующими документами | п. 1 приложение №7 Правил Приказ Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | ||||
| 2. | хранение лекарственного растительного сырья осуществляется в отдельных зонах, защищённых от проникновения в них насекомых и животных | п. 4 (1) приложение №7 Правил Приказ Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | ||||
| 3. | зона хранения растительного сырья хорошо вентилируется. Порядок размещения упаковок не препятствует свободной циркуляции воздуха. | п. 5 (2) приложение №7 Правил Приказ Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | ||||
| 4. | обеспечены и контролируются (путем документальной или электронной) фиксации ) особые условия хранения в отношении влажности, температуры и защиты от света | п. 7 (4) приложение №7 Правил Приказ Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | ||||
| 5. | Для отбора проб, взвешивания, смешивания и других технологических операций с лекарственным растительным сырьем, сопровождающихся пылеобразованием имеются специальные помещения, предусмотрено переодическое удаление пыли. | п. 8 (5) приложение №7 Правил Приказ Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | ||||
| 6. | Документально подтверждено , что оборудование, фильтрующие и иные материалы, используемые в производственном процессе, совместимы с растворителем, используемым для экстракции. | п. 9 (6) приложение №7 Правил Приказ Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | ||||
| 7. | Производители лекарственных растительных препаратов используют только то растительное сырье, которое соответствует требованиям, указанным в досье либо произведено в соответствии с Руководство по правилам надлежащего выращивания и сбора исходного сырья растительного происхождения (GACP) | п. 10 (7) приложение №7 Правил Приказ Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | ||||
| 8. | спецификации на лекарственное растительное сырье или лекарственные растительные препараты содержат необходимую информацию | п. 11 (8) приложение №7 Правил Приказ Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | ||||
| 9. | имеются подробные сведения о процессе обработки для снижения грибковой и (или) микробной контаминации либо другой инвазии и испытаниях, а также предельные значения остаточной контаминации | п. 12 приложение №7 Правил Приказ Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | ||||
| 10. | имеются утвержденные инструкции и записи, которые гарантируют, что каждое тарное место с лекарственным растительным сырьем проверено с целью обнаружения какой-либо фальсификации, подмены, наличия посторонних материалов (таких как фрагменты металла или стекла, остатки животных или их экскременты, камни, песок) либо признаков гниения | п. 14 (10) приложение №7 Правил Приказ Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | ||||
| 11. | технологические инструкции содержат методы удаления посторонних материалов и соответствующие методики очистки и (или) отбора материала растительного происхождения перед его хранением в качестве разрешенного лекарственного растительного сырья или перед началом производства. | п. 15 (11) приложение №7 Правил Приказ Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | ||||
| 12. | инструкции по производству лекарственных растительных препаратов включают подробные сведения о растворителе, продолжительности и температуре экстрагирования, информацию о любых стадиях концентрирования и используемых способах | п. 16 (12) приложение №7 Правил Приказ Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | ||||
| 13. | отбор проб растительного сырья осуществляет персонал, обладающий специальными навыками | п. 17 (13) приложение №7 Правил Приказ Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | ||||
| 14. | сохраняют контрольные образцы лекарственного растительного сырья (при производстве - образцы неизмельченного лекарственного растительного сырья). | п. 18 (14) приложение №7 Правил Приказ Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | ||||
| 15. | определяют подлинность и качество лекарственного растительного сырья, промежуточных продуктов и лекарственных растительных препаратов в соответствии с требованиями Государственной фармакопеи Российской Федерации, нормативной документации или нормативного документа. | п. 19 (15) приложение №7 Правил Приказ Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" |
Подписи лиц, проводивших проверку:_______________________________________________________________________________________________________________
__________________________________________________________________________________________
__________________________________________________________________________________________
С результатами проверки ознакомлен(а), копию проверочного листа получил(а):
___________________________________________________________________________________________
__________________________________________________________________________________________
(фамилия, имя, отчество (последнее - при наличии), должность руководителя, иного должностного лица или уполномоченного представителя юридического лица, индивидуального предпринимателя, его уполномоченного представителя)
«____»_____________________ 20____г
(подпись)
Рекомендации по заполнению контрольного листа (списка контрольных вопросов):
в позиции «ДА» проставляется отметка, если предъявляемое требование реализовано в полном объеме;
в позиции «НЕТ» проставляется отметка, если предъявляемое требование не реализовано или реализовано не в полном объеме;
в позиции «Не требуется» проставляется отметка, если предъявляемое требование не подлежит реализации проверяемым субъектом и (или) контролю (надзору) применительно к данному проверяемому субъекту);
в позиции «Примечание» отражаются поясняющие записи, если предъявляемое требование реализовано не в полном объеме, и иные пояснения.
-------------------------------------------
*(1) Используется следующие способы: 1) документарный; 2) визуальный; 3) дополнительные исследования/испытания (при необходимости)
утверждено
приказом Россельхоза
от ___________________N____
Федеральная служба по ветеринарному и фитосанитарному надзору
______________________________________________________________________________________________________________
наименование органа государственного контроля (надзора)
Государственный контроль (надзор) в сфере обращения лекарственных средств для ветеринарного применения
(в части производства лекарственных растительных препаратов)
__________________________________________________________________________
вид государственного контроля (надзора
Проверочный лист (список контрольных вопросов)
По адресу/адресам:
____________________________________________________________________________________________________
____________________________________________________________________________________________________
(место проведения проверки)
На основании:
____________________________________________________________________________________________________
____________________________________________________________________________________________________
____________________________________________________________________________________________________
(вид документа с указанием реквизитов (номер, дата)
была проведена плановая проверка в отношении:
____________________________________________________________________________________________________
(наименование юридического лица, фамилия, имя, отчество (последнее - при наличии) индивидуального предпринимателя)
____________________________________________________________________________________________________
(учетный номер проверки и дата присвоения учетного номера проверки в едином реестре проверок)
Лицо(а), проводившее проверку:
____________________________________________________________________________________________________
____________________________________________________________________________________________________
____________________________________________________________________________________________________
____________________________________________________________________________________________________
____________________________________________________________________________________________________
(фамилия, имя, отчество (последнее - при наличии), должность должностного лица (должностных лиц), проводившего(их) проверку; в случае привлечения к участию в проверке экспертов, экспертных организаций указываются фамилии, имена, отчества (последнее - при наличии), должности экспертов и/или наименования экспертных организаций с указанием реквизитов свидетельства об аккредитации и наименование органа по аккредитации, выдавшего свидетельство)
При проведении проверки присутствовали:
____________________________________________________________________________________________________
____________________________________________________________________________________________________
____________________________________________________________________________________________________
____________________________________________________________________________________________________
(фамилия, имя, отчество (последнее - при наличии), должность руководителя, иного должностного лица (должностных лиц) или уполномоченного представителя юридического лица, уполномоченного представителя индивидуального предпринимателя, уполномоченного представителя саморегулируемой организации (в случае проведения проверки члена саморегулируемой организации), присутствовавших при проведении мероприятий по проверке
| № п/п | Перечень предъявляемых требований | Структурные элементы нормативных правовых актов и технических нормативных правовых актов | Да | Нет | Не требуется | Способ подтверждения соблюдения обязательных требований*(1) |
|---|---|---|---|---|---|---|
| 1. | Лекарственное сырье должно иметь качество, которое подтверждено соответствующими документами | п. 1 приложение №7 Правил Приказ Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | ||||
| 2. | хранение лекарственного растительного сырья осуществляется в отдельных зонах, защищённых от проникновения в них насекомых и животных | п. 4 (1) приложение №7 Правил Приказ Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | ||||
| 3. | зона хранения растительного сырья хорошо вентилируется. Порядок размещения упаковок не препятствует свободной циркуляции воздуха. | п. 5 (2) приложение №7 Правил Приказ Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | ||||
| 4. | обеспечены и контролируются (путем документальной или электронной) фиксации ) особые условия хранения в отношении влажности, температуры и защиты от света | п. 7 (4) приложение №7 Правил Приказ Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | ||||
| 5. | Для отбора проб, взвешивания, смешивания и других технологических операций с лекарственным растительным сырьем, сопровождающихся пылеобразованием имеются специальные помещения, предусмотрено переодическое удаление пыли. | п. 8 (5) приложение №7 Правил Приказ Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | ||||
| 6. | Документально подтверждено , что оборудование, фильтрующие и иные материалы, используемые в производственном процессе, совместимы с растворителем, используемым для экстракции. | п. 9 (6) приложение №7 Правил Приказ Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | ||||
| 7. | Производители лекарственных растительных препаратов используют только то растительное сырье, которое соответствует требованиям, указанным в досье либо произведено в соответствии с Руководство по правилам надлежащего выращивания и сбора исходного сырья растительного происхождения (GACP) | п. 10 (7) приложение №7 Правил Приказ Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | ||||
| 8. | спецификации на лекарственное растительное сырье или лекарственные растительные препараты содержат необходимую информацию | п. 11 (8) приложение №7 Правил Приказ Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | ||||
| 9. | имеются подробные сведения о процессе обработки для снижения грибковой и (или) микробной контаминации либо другой инвазии и испытаниях, а также предельные значения остаточной контаминации | п. 12 приложение №7 Правил Приказ Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | ||||
| 10. | имеются утвержденные инструкции и записи, которые гарантируют, что каждое тарное место с лекарственным растительным сырьем проверено с целью обнаружения какой-либо фальсификации, подмены, наличия посторонних материалов (таких как фрагменты металла или стекла, остатки животных или их экскременты, камни, песок) либо признаков гниения | п. 14 (10) приложение №7 Правил Приказ Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | ||||
| 11. | технологические инструкции содержат методы удаления посторонних материалов и соответствующие методики очистки и (или) отбора материала растительного происхождения перед его хранением в качестве разрешенного лекарственного растительного сырья или перед началом производства. | п. 15 (11) приложение №7 Правил Приказ Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | ||||
| 12. | инструкции по производству лекарственных растительных препаратов включают подробные сведения о растворителе, продолжительности и температуре экстрагирования, информацию о любых стадиях концентрирования и используемых способах | п. 16 (12) приложение №7 Правил Приказ Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | ||||
| 13. | отбор проб растительного сырья осуществляет персонал, обладающий специальными навыками | п. 17 (13) приложение №7 Правил Приказ Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | ||||
| 14. | сохраняют контрольные образцы лекарственного растительного сырья (при производстве - образцы неизмельченного лекарственного растительного сырья). | п. 18 (14) приложение №7 Правил Приказ Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | ||||
| 15. | определяют подлинность и качество лекарственного растительного сырья, промежуточных продуктов и лекарственных растительных препаратов в соответствии с требованиями Государственной фармакопеи Российской Федерации, нормативной документации или нормативного документа. | п. 19 (15) приложение №7 Правил Приказ Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" |
Подписи лиц, проводивших проверку:_______________________________________________________________________________________________________________
____________________________________________________________________________________________________
____________________________________________________________________________________________________
____________________________________________________________________________________________________
____________________________________________________________________________________________________
____________________________________________________________________________________________________
С результатами проверки ознакомлен(а), копию проверочного листа получил(а):
____________________________________________________________________________________________________
____________________________________________________________________________________________________
____________________________________________________________________________________________________
(фамилия, имя, отчество (последнее - при наличии), должность руководителя, иного должностного лица или уполномоченного представителя юридического лица, индивидуального предпринимателя, его уполномоченного представителя)
«____»_____________________ 20____г
(подпись)
Рекомендации по заполнению контрольного листа (списка контрольных вопросов):
в позиции «ДА» проставляется отметка, если предъявляемое требование реализовано в полном объеме;
в позиции «НЕТ» проставляется отметка, если предъявляемое требование не реализовано или реализовано не в полном объеме;
в позиции «Не требуется» проставляется отметка, если предъявляемое требование не подлежит реализации проверяемым субъектом и (или) контролю (надзору) применительно к данному проверяемому субъекту);
в позиции «Примечание» отражаются поясняющие записи, если предъявляемое требование реализовано не в полном объеме, и иные пояснения.
-------------------------------------------
*(1) Используется следующие способы: 1) документарный; 2) визуальный; 3) дополнительные исследования/испытания (при необходимости)
утверждено
приказом Россельхоза
от ___________________N____
Федеральная служба по ветеринарному и фитосанитарному надзору
_________________________________________________________________________________________
наименование органа государственного контроля (надзора)
Государственный контроль (надзор) в сфере обращения лекарственных средств для ветеринарного применения (хранение субъектами обращения лекарственных средств для ветеринарного применения (производители, организации, занимающиеся оптовой и розничной торговлей, индивидуальные предприниматели, организации осуществляющие разведение выращивание и лечение животных)
_________________________________________________________________________________________
вид государственного контроля (надзора
Проверочный лист (список контрольных вопросов)
По адресу/адресам:
_________________________________________________________________________________________
_________________________________________________________________________________________
_________________________________________________________________________________________
(место проведения проверки)
На основании:
_________________________________________________________________________________________
_________________________________________________________________________________________
_________________________________________________________________________________________
(вид документа с указанием реквизитов (номер, дата))
была проведена плановая проверка в отношении:
_________________________________________________________________________________________
(наименование юридического лица, фамилия, имя, отчество (последнее - при наличии) индивидуального предпринимателя)
_________________________________________________________________________________________
(учетный номер проверки и дата присвоения учетного номера проверки в едином реестре проверок)
Лицо(а), проводившее проверку:
_________________________________________________________________________________________
_________________________________________________________________________________________
_________________________________________________________________________________________
_________________________________________________________________________________________
_________________________________________________________________________________________
(фамилия, имя, отчество (последнее - при наличии), должность должностного лица (должностных лиц), проводившего(их) проверку; в случае привлечения к участию в проверке экспертов, экспертных организаций указываются фамилии, имена, отчества (последнее - при наличии), должности экспертов и/или наименования экспертных организаций с указанием реквизитов свидетельства об аккредитации и наименование органа по аккредитации, выдавшего свидетельство)
При проведении проверки присутствовали:
_________________________________________________________________________________________
_________________________________________________________________________________________
_________________________________________________________________________________________
_________________________________________________________________________________________
_________________________________________________________________________________________
(фамилия, имя, отчество (последнее - при наличии), должность руководителя, иного должностного лица (должностных лиц) или уполномоченного представителя юридического лица, уполномоченного представителя индивидуального предпринимателя, уполномоченного представителя саморегулируемой организации (в случае проведения проверки члена саморегулируемой организации), присутствовавших при проведении мероприятий по проверке)
Предметом плановой проверки юридических лиц и индивидуальных предпринимателей является соблюдение ими законодательства в сфере обращения лекарственных средств для ветеринарного применения, в части осуществления хранения лекарственных средств для ветеринарного применения
| № п/п | Перечень предъявляемых требований | Структурные элементы нормативных правовых актов и технических нормативных правовых актов | Да | Нет | Не требуется | Способ подтверждения соблюдения обязательных требований*(1) | Примечание |
|---|---|---|---|---|---|---|---|
| 1. | Лекарственные препараты для ветеринарного применения, находящиеся на реализации, имеют государственную регистрацию (наличие соответствующей записи в государственном реестре). | ст. 13 Федерального закона от 12.04.2010 г. «Об обращении лекарственных средств», Решение КТС № 317 | |||||
| 2. | Отсутствуют случаи продажи фальсифицированных лекарственных средств, недоброкачественных лекарственных средств, контрафактных лекарственных средств | соблюдение требований статьи 57 Федерального закона "Об обращении лекарственных средств" | |||||
| 3. | Внутренние поверхности ограждающих конструкций (стены, перегородки, потолки) в помещениях для хранения лекарственных средств гладкие, позволяющие проведение влажной уборки | п. 3 Приказа Минсельхоза России от 15.04.2015 № 145 «Об утверждении Правил хранения лекарственных средств для ветеринарного применения» | |||||
| 4. | Полы в помещениях для хранения лекарственных средств сплошные, твердые и ровные, имеют не образующее пыль покрытие, устойчивое к воздействию механической и влажной уборки с использованием дезинфицирующих средств, не имеют деревянных неокрашенных поверхностей | п. 3 Приказа Минсельхоза России от 15.04.2015 № 145 «Об утверждении Правил хранения лекарственных средств для ветеринарного применения» | |||||
| 5. | Хранение лекарственных средств осуществляется в соответствии с условиями хранения, предусмотренными инструкциями по применению лекарственных препаратов для ветеринарного применения | п. 4 Приказа Минсельхоза России от 15.04.2015 № 145 «Об утверждении Правил хранения лекарственных средств для ветеринарного применения» | |||||
| 6. | Помещения для хранения лекарственных средств оснащены системой электроснабжения, отопления, системой принудительной или естественной вентиляции. Не применяется обогревание помещений газовыми приборами с открытым пламенем или электронагревательными приборами с открытой электроспиралью. | п. 5 Приказа Минсельхоза России от 15.04.2015 № 145 «Об утверждении Правил хранения лекарственных средств для ветеринарного применения» | |||||
| 7. | Помещения для хранения лекарственных средств оборудованы стеллажами, шкафами, поддонами (подтоварниками). Отсутствует хранение лекарственных средств на полу без поддона. Поддоны располагаются: - на полу в один ряд; - на стеллажах в несколько ярусов. Отсутствует размещение поддонов с лекарственными средствами в несколько рядов по высоте без использования стеллажей. | п. 6 Приказа Минсельхоза России от 15.04.2015 № 145 «Об утверждении Правил хранения лекарственных средств для ветеринарного применения» | |||||
| 8. | В помещениях для хранения лекарственных средств стеллажи (шкафы) установлены таким образом, чтобы обеспечить свободный доступ к лекарственным средствам персонала и, при необходимости, погрузочных устройств, а также доступность стеллажей (шкафов), стен, пола для уборки. | п. 7 Приказа Минсельхоза России от 15.04.2015 № 145 «Об утверждении Правил хранения лекарственных средств для ветеринарного применения» | |||||
| 9. | Стеллажи для хранения лекарственных средств в помещениях площадью более 10 м2 установлены следующим образом: - расстояние до наружных стен - не менее 0,6 м; - расстояние до потолка - не менее 0,5 м; - расстояние от пола - не менее 0,25 м; - проходы между стеллажами - не менее 0,75 м. | п. 7 Приказа Минсельхоза России от 15.04.2015 № 145 «Об утверждении Правил хранения лекарственных средств для ветеринарного применения» | |||||
| 10. | Стеллажи, шкафы и полки в них, предназначенные для хранения лекарственных средств, пронумерованы и промаркированы. | п. 8 Приказа Минсельхоза России от 15.04.2015 № 145 «Об утверждении Правил хранения лекарственных средств для ветеринарного применения» | |||||
| 11. | Поддоны (подтоварники), предназначенные для хранения лекарственных средств, промаркированы. | п. 8 Приказа Минсельхоза России от 15.04.2015 № 145 «Об утверждении Правил хранения лекарственных средств для ветеринарного применения» | |||||
| № п/п | Перечень предъявляемых требований | Структурные элементы нормативных правовых актов и технических нормативных правовых актов | Да | Нет | Не требуется | Способ подтверждения соблюдения обязательных требований | Примечание |
| 12. | На стеллажах и шкафах прикреплена: стеллажная карта с указанием наименований лекарственных средств, номера серии, срока годности, количества единиц хранения; при использовании компьютерных технологий осуществляется идентификация хранимых лекарственных средств при помощи кодов и электронных устройств. | п. 8 Приказа Минсельхоза России от 15.04.2015 № 145 «Об утверждении Правил хранения лекарственных средств для ветеринарного применения» | |||||
| 13. | Лекарственные препараты во вторичной (потребительской) упаковке, фармацевтические субстанции в первичной упаковке хранятся в шкафах, на стеллажах или полках этикеткой (маркировкой) наружу. | п. 9 Приказа Минсельхоза России от 15.04.2015 № 145 «Об утверждении Правил хранения лекарственных средств для ветеринарного применения» | |||||
| 14. | Помещения для хранения лекарственных средств, требующих защиты от воздействия повышенной температуры, оснащены холодильным оборудо-ванием, укомплектованным термометрами (термографами, терморегистраторами). | п. 10 Приказа Минсельхоза России от 15.04.2015 № 145 «Об утверждении Правил хранения лекарственных средств для ветеринарного применения» | |||||
| 15. | Помещения для хранения лекарственных средств оснащены приборами для регистрации параметров воздуха (термометрами, гигрометрами (электронными гигрометрами) или психрометрами). | п. 11 Приказа Минсельхоза России от 15.04.2015 № 145 «Об утверждении Правил хранения лекарственных средств для ветеринарного применения» | |||||
| 16. | В помещениях для хранения лекарственных средств площадью более 10 м2 измерительные части приборов размещаются на расстоянии не менее 3 м от дверей, окон и отопительных приборов. | п. 11 Приказа Минсельхоза России от 15.04.2015 № 145 «Об утверждении Правил хранения лекарственных средств для ветеринарного применения» | |||||
| 17. | Приборы и (или) части приборов, с которых производится визуальное считывание показаний, располагаются в доступном для персонала месте на высоте 1,5 - 1,7 м от пола. | п. 11 Приказа Минсельхоза России от 15.04.2015 № 145 «Об утверждении Правил хранения лекарственных средств для ветеринарного применения» | |||||
| 18. | Показания приборов для регистрации параметров воздуха (термометров, гигрометров (электронных гигрометров) или психрометров) регистрируются оваться 2 раза в день: -в журнале (карте) регистрации параметров воздуха на бумажном носителе в электронном виде с архивацией (для электронных гигрометров),. | п. 12 Приказа Минсельхоза России от 15.04.2015 № 145 «Об утверждении Правил хранения лекарственных средств для ветеринарного применения» | |||||
| 19. | Журнал (карта) регистрации заводится на один календарный год. Журнал (карта) регистрации хранится в течение одного календарного года, следующего за годом ведения журнала (карты) регистрации. | п. 12 Приказа Минсельхоза России от 15.04.2015 № 145 «Об утверждении Правил хранения лекарственных средств для ветеринарного применения» | |||||
| 20. | Приборы для регистрации параметров воздуха имеют документы от производителя (сертификат, декларация, удостоверение и др.), документы о калибровке и проверке. | п. 12 Приказа Минсельхоза России от 15.04.2015 № 145 «Об утверждении Правил хранения лекарственных средств для ветеринарного применения» | |||||
| Наличие в системе учета и способах организации при хранении лекарственных средств для ветеринарного применения: | |||||||
| 21. | - наличие приказа руководителя организации или индивидуальным предпринимателем об организации хранения лекарственных средств; | п. 13 Приказа Минсельхоза России от 15.04.2015 № 145 «Об утверждении Правил хранения лекарственных средств для ветеринарного применения» | |||||
| 22. | Учет и систематизация лекарственных препаратов для ветеринарного применения осуществляются одним из способов: - по фармакологическим группам; - по способу применения (внутреннее, наружное); - в алфавитном порядке; - с учетом агрегатного состояния фармацевтических субстанций (жидкие, сыпучие, газообразные); -использование компьютерных технологий (по кодам); | п. 13 Приказа Минсельхоза России от 15.04.2015 № 145 «Об утверждении Правил хранения лекарственных средств для ветеринарного применения» | |||||
| 23. | учет и систематизация лекарственных средств с ограниченным сроком годности осуществляется: на бумажном носителе; в электронном виде с архивацией | ||||||
| 24. | Осуществляется контроль за своевременной реализацией лекарственных средств с ограниченным сроком годности путем - ведения учета лекарственных средств с ограниченным сроком годности с архивацией на бумажном носителе или в электронном виде с использованием компьютерных технологий; - стеллажных карт с указанием наименования лекарственного средства, серии, срока годности; - журналов учета сроков годности. | п. 13, п. 15 Приказа Минсельхоза России от 15.04.2015 № 145 «Об утверждении Правил хранения лекарственных средств для ветеринарного применения» | |||||
| 25. | Лекарственные средства с истекшим сроком годности, в поврежденной упаковке, недоброкачественные, фальсифицированных или контрафактные лекарственные средства хранятся не более 3 месяцев отдельно от других групп лекарственных средств: -в специально выделенной и обозначенной (карантинной) зоне; -в специальном контейнере. | п. 16 Приказа Минсельхоза России от 15.04.2015 № 145 «Об утверждении Правил хранения лекарственных средств для ветеринарного применения» | |||||
| 26. | Наличие договора об утилизации лекарственных средств с истекшим сроком годности, в поврежденной упаковке, недоброкачественных, фальсифицированных или контрафактных лекарственные средств организацией имеющей лицензию на вышеуказанный вид деятельности | п. 16 Приказа Минсельхоза России от 15.04.2015 № 145 «Об утверждении Правил хранения лекарственных средств для ветеринарного применения» | |||||
| 28. | Наличие инструкции по утилизации и акта об утилизации, подтверждающих проведение уничтожения недоброкачественных лекарственных средств и контрафактных лекарственных средств | Постановление Правительства Российской Федерации от 03. 09.2010 г. №674 «Об утверждении Правил уничтожения недоброкачественных лекарственных средств и контрафактных лекарственных средств» | |||||
| 27. | Соблюдается график ежедневного мытья с применением моющих средств помещения и оборудование для хранения лекарственных средств | п. 17 Приказа Минсельхоза России от 15.04.2015 № 145 «Об утверждении Правил хранения лекарственных средств для ветеринарного применения» | |||||
| Дополнительные требования при хранении пожаровзрывоопасных и пожароопасных лекарственных средств. | |||||||
| 29. | Имеются изолированные помещения для хранения пожаровзрывоопасных и пожароопасных лекарственных средств. | п. 25 Приказа Минсельхоза России от 15.04.2015 № 145 «Об утверждении Правил хранения лекарственных средств для ветеринарного применения» | |||||
| 30. | Лекарственные препараты, обладающие легковоспламеняющимися и горючими свойствами, в объеме до 10 кг вне помещений для хранения пожаровзрывоопасных и пожароопасных лекарственных средств хранятся во встроенных несгораемых шкафах. Шкафы удалены от тепловыводящих поверхностей и проходов, имеют двери шириной не менее 0,7 м и высоту не менее 1,2 м. | п. 28 Приказа Минсельхоза России от 15.04.2015 № 145 «Об утверждении Правил хранения лекарственных средств для ветеринарного применения» | |||||
| 31. | Складские помещения оборудованы несгораемыми шкафами, стеллажами и поддонами, рассчитанными на соответствующую нагрузку | п. 26 Приказа Минсельхоза России от 15.04.2015 № 145 «Об утверждении Правил хранения лекарственных средств для ветеринарного применения» | |||||
| 32. | . Стеллажи установлены: на расстоянии 0,25 м от пола; на расстоянии 0,6 м от стен, Ширина стеллажей не превышает 1 м; В случае хранения фармацевтических субстанций, отбортовки составляют не менее 0,25 м. Продольные проходы между стеллажами должны быть не менее 1,35 м. | п. 26 Приказа Минсельхоза России от 15.04.2015 № 145 «Об утверждении Правил хранения лекарственных средств для ветеринарного применения» | |||||
| 33. | Количество пожароопасных и пожаровзрывоопасных лекарственных средств, хранящихся в зданиях складского назначения не превышает 100 кг в нерасфасованном виде. | п. 29 Приказа Минсельхоза России от 15.04.2015 № 145 «Об утверждении Правил хранения лекарственных средств для ветеринарного применения» | |||||
| 34. | Пожаровзрывоопасные и пожароопасные лекарственные средства с весом свыше 100 кг хранятся в отдельно стоящем здании. | п. 30 Приказа Минсельхоза России от 15.04.2015 № 145 «Об утверждении Правил хранения лекарственных средств для ветеринарного применения» | |||||
| 35. | Фармацевтические субстанции хранятся в стеклянной или металлической таре изолированно от других групп лекарственных средств | ||||||
| 36. | Легковоспламеняющиеся лекарственные средства хранятся в герметически закрытой стеклянной или металлической таре. | п. 54 Приказа Минсельхоза России от 15.04.2015 № 145 «Об утверждении Правил хранения лекарственных средств для ветеринарного применения | |||||
| 37. | Емкости объемом более 5 литров с легковоспламеняющимися и легкогорючими лекарственными средствами хранятся на полках стеллажей в один ряд по высоте. | п. 55 Приказа Минсельхоза России от 15.04.2015 № 145 «Об утверждении Правил хранения лекарственных средств для ветеринарного применения | |||||
| 38. | Пожароопасные лекарственные средства размещены на расстоянии более 1 метра от отопительных приборов. | п. 56 Приказа Минсельхоза России от 15.04.2015 № 145 «Об утверждении Правил хранения лекарственных средств для ветеринарного применения | |||||
| 39. | Эфир медицинскоий и эфир для наркоза в промышленной упаковке, хранится в помещении с температурой воздуха не выше +15 °C в защищенном от света месте, на расстоянии не менее 1 метра от отопительных приборов. | п. 60 Приказа Минсельхоза России от 15.04.2015 № 145 «Об утверждении Правил хранения лекарственных средств для ветеринарного применения | |||||
| 40. | Нерасфасованный калия перманганата хранится в специальном отсеке складских помещений в жестяных барабанах. . | п. 63 Приказа Минсельхоза России от 15.04.2015 № 145 «Об утверждении Правил хранения лекарственных средств для ветеринарного применения | |||||
| 41. | Калия перманганат в хранится штангласах с притертыми пробками. Штангласы располагаются отдельно от других веществ | п. 63 Приказа Минсельхоза России от 15.04.2015 № 145 «Об утверждении Правил хранения лекарственных средств для ветеринарного применения | |||||
| 42. | Нерасфасованный раствор нитроглицерина хранится в герметически закрытой, стеклянной или металлической таре, в помещении с температурой воздуха не выше +15 °C в защищенном от света месте, с соблюдением мер предосторожности от огня. | п. 64 Приказа Минсельхоза России от 15.04.2015 № 145 «Об утверждении Правил хранения лекарственных средств для ветеринарного применения | |||||
| Дополнительные требования при хранении лекарственных средств, требующих защиты от действия света | |||||||
| 43. | Хранение лекарственных препаратов, требующих защиты от действия света, упакованных в первичную и вторичную (потребительскую) упаковку, в шкафах или на стеллажах при условии принятия мер для предотвращения попадания на указанные лекарственные препараты прямого солнечного света или иного яркого направленного света (использование светоотражающей пленки, жалюзи, козырьков и др.). | п. 35 Приказа Минсельхоза России от 15.04.2015 № 145 «Об утверждении Правил хранения лекарственных средств для ветеринарного применения» | |||||
| 44. | Фармацевтические субстанции, требующих защиты от действия света, хранятся в таре из светозащитных материалов (стеклянной таре из темного стекла, металлической таре, упаковке из алюминиевой фольги или полимерных материалов, окрашенных в темный цвет). | п. 33 Приказа Минсельхоза России от 15.04.2015 № 145 «Об утверждении Правил хранения лекарственных средств для ветеринарного применения» | |||||
| 45. | Особо чувствительных к свету фармацевтические субстанции хранятся в черной светонепроницаемой таре. | п. 34 Приказа Минсельхоза России от 15.04.2015 № 145 «Об утверждении Правил хранения лекарственных средств для ветеринарного применения» | |||||
| Дополнительные требования при хранении лекарственных средств, требующих защиты от воздействия влаги | |||||||
| 46. | Лекарственные средства, требующие защиты от воздействия влаги, хранятся: в помещении с температурой воздуха не выше +15 °C, в герметичной таре из материалов, непроницаемых для паров воды. | п. 36 Приказа Минсельхоза России от 15.04.2015 № 145 «Об утверждении Правил хранения лекарственных средств для ветеринарного применения» | |||||
| 47. | Фармацевтические субстанции с выраженными гигроскопическими свойствами хранятся в стеклянной таре с герметичной крышкой. | п. 36 Приказа Минсельхоза России от 15.04.2015 № 145 «Об утверждении Правил хранения лекарственных средств для ветеринарного применения» | |||||
| 48. | Условия хранения лекарственных препаратов для ветеринарного применения соответствуют требованиям, предусмотренными инструкциями по применению лекарственных препаратов, или условиями хранения, указанными на первичной упаковке фармацевтических субстанций. | п. 36 Приказа Минсельхоза России от 15.04.2015 № 145 «Об утверждении Правил хранения лекарственных средств для ветеринарного применения» | |||||
| Дополнительные требования при хранении лекарственных средств, требующих защиты от улетучивания и высыхания | |||||||
| 49. | Лекарственные средства, требующих защиты от улетучивания и высыхания, хранятся в соответствии с инструкциями по применению лекарственных препаратов, и условиями, указанными на вторичной (потребительской) упаковке - для лекарственных препаратов, на первичной упаковке - для фармацевтических субстанций. в помещении с температурой воздуха не выше +15 °C; в герметичной таре из непроницаемых для улетучивающихся веществ материалов | п. 37 Приказа Минсельхоза России от 15.04.2015 № 145 «Об утверждении Правил хранения лекарственных средств для ветеринарного применения» | |||||
| 50. | Фармацевтические субстанции, содержащие кристаллизационную воду, хранятся в помещении с температурой воздуха не выше +15 °C при относительной влажности воздуха 50 - 65%. | п. 38 Приказа Минсельхоза России от 15.04.2015 № 145 «Об утверждении Правил хранения лекарственных средств для ветеринарного применения» | |||||
| Дополнительные требования при хранении лекарственных средств, требующих защиты от воздействия повышенной температуры | |||||||
| 51. | Лекарственных средств, требующих защиты от воздействия повышенной температуры (термолабильные лекарственные средства), хранятся в соответствии с условиями хранения, предусмотренными инструкциями по применению лекарственных препаратов, или условиями хранения, указанными на первичной упаковке фармацевтических субстанций | п. 39 Приказа Минсельхоза России от 15.04.2015 № 145 «Об утверждении Правил хранения лекарственных средств для ветеринарного применения» | |||||
| 52. | Биологические лекарственные препараты одного и того же наименования хранятся по сериям с учетом срока их годности. | п. 40 Приказа Минсельхоза России от 15.04.2015 № 145 «Об утверждении Правил хранения лекарственных средств для ветеринарного применения» | |||||
| 53. | Отсутствует хранение биологических лекарственных препаратов на дверной панели холодильника. | п. 40 Приказа Минсельхоза России от 15.04.2015 № 145 «Об утверждении Правил хранения лекарственных средств для ветеринарного применения» | |||||
| 54. | Антибиотики в промышленной упаковке хранятся при комнатной температуре (20 +/- 2 °C) ( если отсутствуют другие указания в инструкции по применению лекарственных препаратов или на первичной упаковке фармацевтических субстанций. | п. 41 Приказа Минсельхоза России от 15.04.2015 № 145 «Об утверждении Правил хранения лекарственных средств для ветеринарного применения» | |||||
| 55. | Органопрепараты в хранятся в защищенном от света, сухом месте при температуре от 0 до +15 °C, если отсутствуют другие указания в инструкции по применению лекарственного препарата. | п. 42 Приказа Минсельхоза России от 15.04.2015 № 145 «Об утверждении Правил хранения лекарственных средств для ветеринарного применения» | |||||
| 56. | Масла хранятся при температуре от +4 до +12 °C, если отсутствуют другие указания в инструкции по применению лекарственных препаратов или на первичной упаковке фармацевтических субстанций. | п. 43 Приказа Минсельхоза России от 15.04.2015 № 145 «Об утверждении Правил хранения лекарственных средств для ветеринарного применения» | |||||
| Дополнительные требования при хранении лекарственных средств, требующих защиты от воздействия пониженной температуры | |||||||
| 57. | Хранение лекарственных средств, требующих защиты от воздействия пониженной температуры, осуществляется в соответствии с температурным режимом, указанным в инструкциях по применению лекарственных препаратов, на вторичной (потребительской) упаковке - для лекарственных препаратов, на первичной упаковке - для фармацевтических субстанций. | п. 45 Приказа Минсельхоза России от 15.04.2015 № 145 «Об утверждении Правил хранения лекарственных средств для ветеринарного применения» | |||||
| Дополнительные требования при хранении лекарственных средств, требующих защиты от воздействия газов, содержащихся в окружающей среде | |||||||
| 58. | Лекарственные средства, требующие защиты от воздействия газов, находящихся в окружающей среде (вещества, реагирующие с кислородом воздуха; вещества, реагирующие с углекислым газом воздуха), хранятся в герметически закрытой таре из материалов, непроницаемых для газов, по возможности заполненной доверху. | п. 46 Приказа Минсельхоза России от 15.04.2015 № 145 «Об утверждении Правил хранения лекарственных средств для ветеринарного применения» | |||||
| Дополнительные требования при хранении пахучих и красящих лекарственных средств | |||||||
| 59. | Пахучие лекарственные средства хранятся в герметически закрытой таре, непроницаемой для запаха, раздельно по наименованиям. | п. 47 Приказа Минсельхоза России от 15.04.2015 № 145 | |||||
| 60. | Красящие лекарственные средства (оставляющих окрашенный след, не смываемый обычной санитарно-гигиенической обработкой, на таре, укупорочных средствах, оборудовании и инвентаре) хранятся в специальном шкафу в плотно укупоренной таре, раздельно по наименованиям. | п. 48 Приказа Минсельхоза России от 15.04.2015 № 145 «Об утверждении Правил хранения лекарственных средств для ветеринарного применения» | |||||
| Дополнительные требования при хранении антисептических лекарственных средств | |||||||
| 61. | Хранение антисептических лекарственных средств в герметичной таре осуществляется изолированно от мест хранения пластмассовых, резиновых и металлических изделий и мест получения дистиллированной воды. | п. 49 Приказа Минсельхоза России от 15.04.2015 № 145 «Об утверждении Правил хранения лекарственных средств для ветеринарного применения» | |||||
| Дополнительные требования при хранении лекарственного растительного сырья | |||||||
| 62. | Хранение лекарственного растительного сырья (предварительно высушенного) осуществляется в сухом, хорошо вентилируемом помещении, в герметически закрытой таре. | п. 50 Приказа Минсельхоза России от 15.04.2015 № 145 «Об утверждении Правил хранения лекарственных средств для ветеринарного применения» | |||||
| 63. | Лекарственное растительное сырье, содержащее эфирные масла, хранится изолированно и в герметически закрытой таре. | п. 51 Приказа Минсельхоза России от 15.04.2015 № 145 | |||||
| 64. | Наличие учета по периодическому контролю в форме оценки по органолептическим показателям лекарственного растительного сырья. (Трава, корневища, семена, плоды, утратившие свойственную им окраску, запах, а также пораженные плесенью, вредителями, не допускаются к дальнейшему хранению и использованию. | п. 52 Приказа Минсельхоза России от 15.04.2015 № 145 «Об утверждении Правил хранения лекарственных средств для ветеринарного применения» | |||||
Подписи лиц, проводивших проверку:
_________________________________________________________________________________________
_________________________________________________________________________________________
_________________________________________________________________________________________
_________________________________________________________________________________________
_________________________________________________________________________________________
_________________________________________________________________________________________
С результатами проверки ознакомлен(а), копию проверочного листа получил(а):
__________________________________________________________________________________________
_________________________________________________________________________________________
(фамилия, имя, отчество (последнее - при наличии), должность руководителя, иного должностного лица или уполномоченного представителя юридического лица, индивидуального предпринимателя, его уполномоченного представителя)
| “ | ” | 20 | 1 | г. |
|---|
(подпись)
Рекомендации по заполнению контрольного листа (списка контрольных вопросов):
в позиции «ДА» проставляется отметка, если предъявляемое требование реализовано в полном объеме;
в позиции «НЕТ» проставляется отметка, если предъявляемое требование не реализовано или реализовано не в полном объеме;
в позиции «Не требуется» проставляется отметка, если предъявляемое требование не подлежит реализации проверяемым субъектом и (или) контролю (надзору) применительно к данному проверяемому субъекту);
в позиции «Примечание» отражаются поясняющие записи, если предъявляемое требование реализовано не в полном объеме, и иные пояснения.
-------------------------------------------
*(1) Используется следующие способы: 1) документарный; 2) визуальный; 3) дополнительные исследования/испытания (при необходимости)
утверждено
приказом Россельхоза
от ___________________N____
Федеральная служба по ветеринарному и фитосанитарному надзору
__________________________________________________________
наименование органа государственного контроля (надзора)
Государственный контроль (надзор) в сфере обращения лекарственных средств для ветеринарного применения
(в части производства стерильных лекарственных средств)
_______________________________________________
вид государственного контроля (надзора
Проверочный лист (список контрольных вопросов)
По адресу/адресам:
___________________________________________________________________________
___________________________________________________________________________
(место проведения проверки)
На основании:
___________________________________________________________________________
___________________________________________________________________________
(вид документа с указанием реквизитов (номер, дата)
была проведена плановая проверка в отношении:
___________________________________________________________________________
(наименование юридического лица, фамилия, имя, отчество (последнее - при наличии) индивидуального предпринимателя)
___________________________________________________________________________
(учетный номер проверки и дата присвоения учетного номера проверки в едином реестре проверок)
Лицо(а), проводившее проверку:
___________________________________________________________________________
___________________________________________________________________________
___________________________________________________________________________
___________________________________________________________________________
___________________________________________________________________________
(фамилия, имя, отчество (последнее - при наличии), должность должностного лица (должностных лиц), проводившего(их) проверку; в случае привлечения к участию в проверке экспертов, экспертных организаций указываются фамилии, имена, отчества (последнее - при наличии), должности экспертов и/или наименования экспертных организаций с указанием реквизитов свидетельства об аккредитации и наименование органа по аккредитации, выдавшего свидетельство)
При проведении проверки присутствовали:
___________________________________________________________________________
___________________________________________________________________________
___________________________________________________________________________
___________________________________________________________________________
(фамилия, имя, отчество (последнее - при наличии), должность руководителя, иного должностного лица (должностных лиц) или уполномоченного представителя юридического лица, уполномоченного представителя индивидуального предпринимателя, уполномоченного представителя саморегулируемой организации (в случае проведения проверки члена саморегулируемой организации), присутствовавших при проведении мероприятий по проверке
| № п/п | Перечень предъявляемых требований | Структурные элементы нормативных правовых актов и технических нормативных правовых актов | Да | Нет | Не требуется | Способ подтверждения соблюдения обязательных требований*(1) | Примечание |
|---|---|---|---|---|---|---|---|
| Производство стерильных лекарственных средств | |||||||
| 1. | стерильная продукция производится в чистых зонах, в которые доступ персонала и поступление оборудования, исходного сырья и упаковочных материалов осуществляется через воздушные шлюзы. | п. 3 (1) Приложение № 1 приказа Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | |||||
| 2. | операции по подготовке компонентов, приготовлению продукции и наполнению осуществляются в отдельных зонах (помещениях) внутри чистой зоны (помещения). | п. 4 (2) Приложение № 1 приказа Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | |||||
| 3. | чистые зоны (помещения) для производства стерильной продукции классифицированы в соответствии с требуемыми характеристиками производственной среды. | п. 5 (3) Приложение № 1 приказа Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | |||||
| 4. | уровень чистоты производственной среды в эксплуатируемом состоянии соответствует заявленному. | п. 5 (3) Приложение № 1 приказа Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | |||||
| 5. | требования к "оснащенному" и "эксплуатируемому" состояниям установлены для каждого чистого помещения. | п. 6 Приложение № 1 приказа Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | |||||
| 6. | зоны (помещения) наполнения, укупорки, зоны, где ампулы и флаконы находятся в открытом состоянии и выполняются соединения частей оборудования в асептических условиях являются чистыми зонами (помещениями) класса А. | п. 10 Приложение № 1 приказа Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | |||||
| 7. | системы ламинарного потока воздуха обеспечивают равномерную скорость воздуха в диапазоне 0,36 - 0,54 м/с на рабочей поверхности, находящейся в открытой чистой зоне. | п. 10 Приложение № 1 приказа Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | |||||
| 8. | поддержание ламинарности потока воздуха доказано и провалидировано. | п. 10 Приложение № 1 приказа Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | |||||
| 9. | все зоны(помещения) класса A, предназначенную для асептического приготовления и наполнения, непосредственно окружены чистой зоной класса В | п. 10 Приложение № 1 приказа Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | |||||
| Классификация чистых помещений и чистых зон | |||||||
| 10. | максимально допустимая концентрация аэрозольных частиц в 1 м3 для каждого класса чистых помещений и чистых зон соответствует следующим показателям: а) в оснащенном состоянии - класс А - 3520 (частицы 0,5 мкм); 20 (частицы 5 мкм); - класс В - 3520 (частицы 0,5 мкм); 29 (частицы 5 мкм); - класс С - 352 000 (частицы 0,5 мкм); 2900 (частицы 5 мкм); - класс D - 3 520 000 (частицы 0,5 мкм); 29000 (частицы 5 мкм); б) в эксплуатируемом состоянии - класс А - 3520 (частицы 0,5 мкм); 20 (частицы 5 мкм); - класс В - 352 000 (частицы 0,5 мкм); 2900 (частицы 5 мкм); - класс С - 3 520 000 (частицы 0,5 мкм); 29000 (частицы 5 мкм); - класс D - не регламентируется (частицы 0,5 и 5 мкм); | п. 11 (4) Приложение № 1 приказа Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | |||||
| 11. | при классификации в зонах класса А минимальный объем отбираемой пробы воздуха составляет не менее 1 м3 для каждой точки отбора проб. | п. 12 (5) Приложение № 1 приказа Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | |||||
| 12. |
класс А соответствует классу исо 4.8 по показателю предельного количества частиц в воздухе размером  5,0 мкм.
5,0 мкм.
|
п. 12 (5) Приложение № 1 приказа Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | |||||
| 13. | класс B (в оснащенном состоянии) по количеству аэрозольных частиц соответствует классу исо 5 по количеству частиц обоих указанных размеров. | п. 12 (5) Приложение № 1 приказа Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | |||||
| 14. | класс C (в оснащенном и эксплуатируемом состояниях) по количеству аэрозольных частиц соответствует классу исо 7 и исо 8 соответственно. | п. 12 (5) Приложение № 1 приказа Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | |||||
| 15. | класс D (в оснащенном состоянии) по количеству аэрозольных частиц соответствует классу исо 8. | п. 12 (5) Приложение № 1 приказа Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | |||||
| 16. |
для подтверждения класса чистоты минимальное количество точек для отбора проб рассчитано по формуле 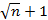 , где n - площадь помещения (зоны)
, где n - площадь помещения (зоны)
|
п. 12 (5) Приложение № 1 приказа Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | |||||
| 17. | для подтверждения класса чистоты использовались портативные счетчики частиц с короткими трубками для отбора проб. | п. 13 (6) Приложение № 1 приказа Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | |||||
| 18. | для подтверждения класса чистоты для систем однонаправленного потока воздуха использовались изокинетические насадки для отбора проб. | п. 13 (6) Приложение № 1 приказа Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | |||||
| 19. | подтверждение класса в эксплуатируемом состоянии проведено во время работы или при моделировании рабочих операций, при котором имитируются предельно допустимые параметры ведения технологического процесса при самых неблагоприятных факторах и условиях. | п. 14 (7) Приложение № 1 приказа Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | |||||
| Мониторинг чистых помещений и чистых зон | |||||||
| 20. | проводится текущий мониторинг чистых помещений и чистых зон в период их эксплуатации. | п. 15 (8) Приложение № 1 приказа Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | |||||
| 21. | Представлены документы по анализу рисков при выборе точек отбора проб для текущего мониторинга чистых помещений и (или) чистых зон. | п. 15 (8) Приложение № 1 приказа Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | |||||
| 22. | для зон класса А проводится непрерывный мониторинг частиц на всем протяжении критического процесса, включая сборку оборудования. В случае применения загрязняющих веществ (живые микроорганизмы, радиоактивные вещества) мониторинг осуществляется во время операций по настройке оборудования до момента появления риска. | п. 16 (9) Приложение № 1 приказа Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | |||||
| 23. | для зон класса А проводится мониторинг частиц во время моделирования операций. | п. 16 (9) Приложение № 1 приказа Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | |||||
| 24. | допустимое количество частиц для чистых помещений в оснащенном состояния достигается после короткого периода очистки продолжительностью 15 - 20 минут при отсутствии персонала после завершения работы. | п. 21 (14) Приложение № 1 приказа Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | |||||
| 25. | при выполнении асептических процессов постоянно проводится микробиологический мониторинг с использованием седиментационного и аспирационного методов отбора проб воздуха, отбора проб с поверхностей методом смывов тампоном и с использованием контактных пластин. | п. 25 (18) Приложение № 1 приказа Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | |||||
| 26. | результаты мониторинга учитывается при проведении обзора досье на серию для выдачи разрешения на выпуск готовой продукции. | п. 25 (18) Приложение № 1 приказа Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | |||||
| 27. | после выполнения критических операций проводится мониторинг рабочих поверхностей оборудования и персонала. | п. 25 (18) Приложение № 1 приказа Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | |||||
| 28. | проводиться дополнительный микробиологический мониторинг вне технологического процесса после валидации систем, после очистки и дезинфекции | п. 25 (18) Приложение № 1 приказа Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | |||||
| 29. | по результатам мониторинга частиц и микроорганизмов в чистых помещениях установлены уровень тревоги и уровень действия. | п. 27 (20) Приложение № 1 приказа Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | |||||
| 30. | в операционных процедурах предусмотрены и подробно описаны корректирующие действия в случае превышения уровня тревоги и уровня действия. | п. 27 (20) Приложение № 1 приказа Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | |||||
| Изолирующая технология | |||||||
| 31. | изолятор обеспечивает в соответствую необходимое качество воздуха | п. 28. (21) Приложение №1 Приказа Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | |||||
| 32. | чистота воздуха в среде, окружающей изолятор контролируется, и для асептического производства соответствует классу чистоты D или выше | п. 30 (23) Приложение №1 Приказа Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | |||||
| 33. | проведена валидация работы в изоляторе с учетом качества воздуха внутри и снаружи изолятора, порядока дезинфекции изолятора, процессов передачи и целостности изолятора | п. 31 (24) Приложение №1 Приказа Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | |||||
| 34. | проводится непрерывный мониторинг, включающий в себя частые испытания герметичности изолятора и узлов "перчатки - рукава" | п. 32 (25) Приложение №1 Приказа Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | |||||
| Технология «Выдувание-наполнение-герметизация» | |||||||
| 35. | устройство "выдувание - наполнение - герметизация", используемое в асептическом производстве и имеющее зону класса A с эффективным потоком воздуха, установлено, по крайней мере, в зоне класса C при условии использования одежды, применяемой в зонах для классов A и (или) B | п. 33 (26) Приложение №1 Приказа Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | |||||
| 36. | устройство "выдувание - наполнение - герметизация", используемое в производстве продукции, подлежащей финишной стерилизации, установлено, по крайней мере, в зоне класса D | п. 33 (26) Приложение №1 Приказа Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | |||||
| Продукция, подвергаемая финишной стерилизации | |||||||
| 37. | подготовка компонентов первичной упаковки и других материалов и производство продукции проводится в производственной среде, по крайней мере, класса D | п. 35 (28) Приложение №1 Приказа Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | |||||
| 38. | в случаях когда продукция является хорошей питательной средой для роста микроорганизмов, либо ее стерилизации предшествует длительный период времени, либо технологический процесс ведется по большей части в открытых емкостях приготовление осуществляется в производственной среде класса C | п. 35 (28) Приложение №1 Приказа Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | |||||
| 39. | наполнение проводится в производственной среде, по крайней мере, класса C | п. 36 (29) Приложение №1 Приказа Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | |||||
| 40. | если операции наполнения проходят медленно или упаковки имеют широкое горло, или их необходимо держать открытыми более нескольких секунд до герметизации, наполнение проводится в зоне класса A с окружающей средой, по крайней мере, класса C | п. 37 (30) Приложение №1 Приказа Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | |||||
| 41. | приготовление и фасовку мазей, кремов, суспензий и эмульсий перед финишной стерилизацией осуществляют в производственной среде класса C | п. 37 (30) Приложение №1 Приказа Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | |||||
| Асептическое производство | |||||||
| 42. | операции с компонентами первичной упаковки и другими материалами после мойки проводятся в производственной среде класса D | п. 38 (31) Приложение №1 Приказа Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | |||||
| 43. | обработка стерильного исходного сырья и компонентов, осуществляют в рабочей зоне класса A с производственной средой класса B | п. 38 (31) Приложение №1 Приказа Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | |||||
| 44. | приготовление растворов, которые подлежат стерилизующей фильтрации, проводится в производственной среде класса C | п. 39 (32) Приложение №1 Приказа Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | |||||
| 45. | если стерилизующая фильтрация не проводится, подготовка материалов и производство продукции осуществляется в рабочей зоне класса A с производственной средой класса B | п. 39 (32) Приложение №1 Приказа Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | |||||
| 46. | обработка и наполнение продукции, приготовленной в асептических условиях, проводится в рабочей зоне класса A с производственной средой класса B | п. 40 (33) Приложение №1 Приказа Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | |||||
| 47. | передача (транспортировка) не окончательно укупоренных первичных упаковок с продукцией, осуществляется в зоне класса A, находящейся в производственной среде класса B, или в герметичных передаточных контейнерах в производственной среде класса B | п. 41 (34) Приложение №1 Приказа Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | |||||
| 48. | приготовление и наполнение стерильных мазей, кремов, суспензий и эмульсий осуществляют в зоне класса A, находящейся в производственной среде класса B. | п. 42 (35) Приложение №1 Приказа Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | |||||
| Персонал | |||||||
| 49. | персонал, занятый в производстве стерильных лекарственных средств, проинструктирован о необходимости сообщать о любых обстоятельствах, которые могут быть причиной распространения недопустимых контаминантов | п.46(39) приложения №1 Приказа Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | |||||
| 50. | в чистых зонах отсутствуют сотрудники с наручными часами и ювелирными украшениями, а также использующие косметику. | п.47(40) приложения №1 Приказа Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | |||||
| 51. | персонал переодевается и моется в соответствии с утвержденными производителем инструкциями | п.48(41) приложения №1 Приказа Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | |||||
| 52. | уличная одежда не вносится в комнаты для переодевания, которые ведут в помещения классов B и C. | п.51(44) приложения №1 Приказа Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | |||||
| 53. | все работники в зоне класса A/B обеспечены чистой стерильной защитной одеждой на каждую рабочую смену. | п.51(44) приложения №1 Приказа Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | |||||
| 54. | перчатки во время работы дезинфицируются с периодичностью, предусмотренной на предприятии. Маски и перчатки меняются, не реже 1 раза в смену | п.51(44) приложения №1 Приказа Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | |||||
| 55. | не используется в чистых помещениях одежда с поврежденными волокнами ткани | п.52(45) приложения №1 Приказа Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | |||||
| Помещения для стерильных лекарственных средств. | |||||||
| 56. | в чистых зонах все открытые поверхности гладкие, непроницаемые, неповрежденные и позволяют многократно применять моющие и дезинфицирующие средства. | п. 53 (46) Приложение № 1 Приказа Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | |||||
| 57. | в чистых помещениях отсутствуют углубления, недоступные для очистки. | п. 54 (47) Приложение № 1 Приказа Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | |||||
| 58. | подвесные потолки герметичны. | п. 55 (48) Приложение № 1 Приказа Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | |||||
| 59. | монтаж трубопроводов, воздуховодов и другого оборудования выполнен без углублений и незакрытых отверстий | п. 56 (49) Приложение № 1 Приказа Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | |||||
| 60. | отсутствуют раковины и сливы в зонах класса А и В, используемых для асептического производства | п. 57 (50) Приложение № 1 Приказа Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | |||||
| 61. | в зонах А, В, не используемых для асептического производства, а также зонах C и D предусмотрен разрыв струи между оборудованием и канализационной трубой (воронкой). | п. 57 (50) Приложение № 1 Приказа Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | |||||
| 62. | стоки в полу чистых помещений с более низким классом чистоты обеспечены сифонами или гидрозатворами для предотвращения обратного потока. | п. 57 (50) Приложение № 1 Приказа Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | |||||
| 63. | комнаты для переодевания сконструированы как воздушные шлюзы для обеспечения физического разделения разных этапов смены одежды. | п. 58 (51) Приложение № 1 Приказа Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | |||||
| 64. | зона перед выходом из комнаты (помещения) для переодевания в оснащенном состоянии имеет тот же класс чистоты, что и зона, в которую она ведет | п. 58 (51) Приложение № 1 Приказа Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | |||||
| 65. | двери воздушного шлюза оснащены блокировочной системой или системой визуального и (или) звукового предупреждения для предотвращения одновременного открытия обеих дверей, которая находится в рабочем состоянии | п. 59 (52) Приложение № 1 Приказа Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | |||||
| 66. | подача отфильтрованного воздуха поддерживает положительный перепад давления относительно производственных зон с более низким классом | п. 60 (53) Приложение № 1 Приказа Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | |||||
| 67. | установлены датчики перепада давления между двумя помещениями с критичной разницей давления. | п. 62 (55) Приложение № 1 Приказа Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | |||||
| 68. | смежные помещения с разными классами чистоты имеют разницу в давлении в пределах 10 - 15 Па. | п. 60 (53) Приложение № 1 Приказа Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | |||||
| 69. | значения перепада давления регулярно записываются или оформляются документально иным способом. | п. 62 (55) Приложение № 1 Приказа Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | |||||
| 70. | документально подтверждено, что направление воздушных потоков не представляет рисков для контаминации продукта. | п. 61 (54) Приложение № 1 Приказа Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | |||||
| 71. | имеется в рабочем состоянии система аварийного оповещения об отказе системы вентиляции. | п. 62 (55) Приложение № 1 Приказа Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | |||||
| Оборудование для стерильных лекарственных средств | |||||||
| 72. | исключено прохождение ленты конвейера через перегородку, отделяющую зону класса А или В от производственной зоны с более низкой чистотой воздуха или сама лента подвергается непрерывной стерилизации. | п. 63 (56) Приложение № 1 Приказа Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | |||||
| 73. | стерилизация оборудования после обслуживания проводится после максимально полной сборки. | п. 64 (57) Приложение № 1 Приказа Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | |||||
| 74. | имеется документальное подтверждение очищения, дезинфекции и стерилизация до возобновления процесса после технического обслуживания оборудования, если обслуживание проводилось внутри чистой зоны. | п. 65 (58) Приложение № 1 Приказа Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | |||||
| 75. | вода для инъекций постоянно циркулирует при температуре выше 700 С. | п. 66 (59) Приложение № 1 Приказа Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | |||||
| 76. | стерилизаторы, системы обработки и фильтрации воздуха, воздушные и газовые фильтры, системы обработки, получения, хранения и распределения воды валидированы иподвергаются плановому техническому обслуживанию в соответствии с рекомендациями производителя оборудования и планом предприятия. | п. 67 (60) Приложение № 1 Приказа Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | |||||
| 77. | на повторное введение оборудования, указанного в п.76, в эксплуатацию выдано разрешение должностным лицом, имеющим соответствующие полномочия. | п. 67 (60) Приложение № 1 Приказа Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | |||||
| Санитарная обработка | |||||||
| 78. | зоны тщательно очищаются в соответствии с утвержденной производителем инструкцией. Факт проведения очистки фиксируется в регистрирующей документации | п. 68 (61) Приложение № 1 Приказа Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | |||||
| 79. | при дезинфекции применяются несколько типов дезинфицирующих средств, | п. 68 (61) Приложение № 1 Приказа Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | |||||
| 80. | проводится регулярный контроль для выявления резистентных к дезсредствам микроорганизмов с предусмотренной на предприятии периодичностью | п. 68 (61) Приложение № 1 Приказа Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | |||||
| 81. | проводится контроль моющих и дезинфицирующих средств в отношении микробиологической чистоты. | п. 69 (62) Приложение № 1 Приказа Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | |||||
| 82. | сроки хранения растворы моющих и дезинфицирующих средств соблюдаются. | п. 69 (62) Приложение № 1 Приказа Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | |||||
| 83. | в зонах классов А и В используются стерильные моющие и дезинфицирующие средства. | п. 69 (62) Приложение № 1 Приказа Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | |||||
| 84. | в недоступных местах чистых зон проводится фумигация. | п. 70 (63) Приложение № 1 Приказа Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | |||||
| Технологический процесс | |||||||
| 85. | не допускается производство лекарственных средств микробиологического происхождения или наполнение ими в зонах, используемых для производства других лекарственных средств за исключением инактивированных вакцин или бактериальных экстрактов. | п. 72 (65) Приложение №1 Приказа Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | |||||
| 86. | моделирование процесса точно имитирует серийный процесс асептического производства и включает в себя все его последовательные критические стадии с учетом различных вмешательств, которые могут возникнуть во время обычного производственного процесса, а также ситуации "наихудшего случая" | п. 74 (67) Приложение №1 приказа Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | |||||
| 87. | моделирование процесса при первоначальной валидации включает три последовательных удовлетворительных испытания для каждой смены операторов | п. 75 (68) Приложение №1 приказа Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | |||||
| 88. | моделирующие процесс испытания повторяются дважды в год для каждой смены операторов и каждого процесса, а также после любого существенного изменения в системе вентиляции и кондиционирования воздуха, в оборудовании, процессе или количестве смен | п. 75 (68) Приложение №1 приказа Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | |||||
| 89. | при выпуске небольших серий количество первичных упаковок, предназначенных для фасовки питательных сред при моделировании процесса, соответствует размеру серии | п. 76 (69) Приложение №1 приказа Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | |||||
| 90. | имеется документальное подтверждение успешного проведения моделирования процесса наполнения питательными средами | п. 76 (69) Приложение №1 приказа Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | |||||
| 91. | представлен отчет о расследовании возможного влияния на стерильность серий, выпущенных после проведения последних успешных испытаний с наполнением питательными средами, при обнаружении значительной микробной контаминации рассмотрено | п. 77 (70) Приложение №приказа Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | |||||
| 92. | источники водоснабжения, оборудование для подготовки воды и приготовленная вода подвергаются регулярному мониторингу на наличие химических и биологических контаминантов и на эндотоксины, результаты мониторинга оформлены документально | п. 79 (72) Приложение №1 приказа Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | |||||
| 93. | спецификации на исходное сырьё и материалы для производства стерильной продукции включают в себя требования к микробиологической чистоте | п. 81 (74) Приложение №1 приказа Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | |||||
| 94. | в чистых зонах отсутствуют контейнеры и материалы, от которых возможно отделение волокон | п. 82 (75) Приложение №1 приказа Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | |||||
| 95. | приняты меры по предотвращению контаминации готовой продукции частицами | п. 83 (76) Приложение №1 приказа Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | |||||
| 96. | интервалы времени между мойкой, сушкой и стерилизацией компонентов, контейнеров и оборудования, а также между их стерилизацией и последующим использованием имеют установленное ограничение по времени и соблюдаются | п. 85 (78) Приложение №1 приказа Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | |||||
| 97. | максимально допустимое время между началом приготовления раствора и его стерилизацией или стерилизующей фильтрацией установлено для каждого вида продукции и соблюдается | п. 86 (79) Приложение №1 приказа Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | |||||
| 98. | уровень микробной контаминации количественно определяется для каждой серии как продукции, наполненной в асептических условиях, так и продукции, подвергаемой финишной стерилизации | п. 87 (80) Приложение №1 приказа Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | |||||
| 99. | компоненты, контейнеры, оборудование и любые другие предметы, необходимые в чистой зоне, особенно при работе в асептических условиях, стерилизуются и передаются туда через проходной стерилизатор с двусторонним доступом | п. 88 (81) Приложение №1 приказа Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | |||||
| 100. | в чистую зону негорючие газы поступают через фильтры, задерживающие микроорганизмы. | п.88 (81) Приложение №1 Правил Приказа Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | |||||
| Стерилизация | |||||||
| 101. | все процессы стерилизации валидированы для каждого вида загрузки | п. 90 (83), 91 (84), 93 (86) Приложение №1 приказа Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | |||||
| 102. | методы стерилизации соответствуют имеющейся лицензии и регистрационному досье на лекарственный препарат | п. 90 (83) Приложение №1 приказа Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | |||||
| 103. | валидация процесса повторяется не реже одного раза в год, а также в случае внесения существенных изменений в оборудование | п. 91 (84) Приложение №1 приказа Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | |||||
| 104. | биологические индикаторы хранятся и используются в соответствии с инструкциями производителя, а их качество контролируется методами позитивного контроля | п. 94 (87) Приложение №1 Правил Приказа Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | |||||
| 105. | четко определены меры, обеспечивающие разделение продукции, прошедшей и не прошедшей стерилизацию | п.95 (88) Приложение №1 Правил Приказа Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | |||||
| 106. | для каждого цикла стерилизации составляются записи, которые утверждены в рамках процедуры выдачи разрешения на выпуск серии | п. 96 (89) Приложение №1 Правил Приказа Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | |||||
| 107. | имеются записи каждого цикла термической стерилизации в виде диаграммы в координатах время-температура | п. 97 (90) Приложение №1 Правил Приказа Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | |||||
| 108. | место расположения температурных датчиков при термической стерилизации, используемых для контроля и (или) записи, определено во время валидации | п. 97 (90) Приложение №1 Правил Приказа Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | |||||
| 109. | для подтверждения качества проведения стерилизации использованы физические измерения | п. 98 (91) Приложение №1 Правил Приказа Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | |||||
| 110. | при термической стерилизации предусмотрено достаточное время, чтобы весь объем загрузки достиг необходимой температуры до того, как будет начат отсчет времени стерилизации. Этот период определен для каждого типа стерилизуемой загрузки | п. 99 (92) Приложение №1 Правил Приказа Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | |||||
| 111. | после завершения высокотемпературной фазы цикла термической стерилизации приняты меры предосторожности, предотвращающие контаминацию простерилизованной загрузки во время охлаждения | п. 100 (93) Приложение №1 Правил Приказа Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | |||||
| 112. | при стерилизации паром контролируется температура и давление. Средства управления независимы от средств контроля и записывающих устройств автоматические системы управления и контроля, прошли валидацию. Нарушения в ходе процесса регистрируются системой и находятся под надзором оператора | п. 101 (94) Приложение №1 Правил Приказа Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | |||||
| 113. | в ходе процесса стерилизации паром показания независимого датчика температуры постоянно сверяются с данными диаграммы записывающего устройства | п. 101 (94) Приложение №1 Правил Приказа Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | |||||
| 114. | при цикле стерилизации паром с этапом вакуумирования, регулярно проводится проверка камеры на герметичность | п. 101 (94) Приложение №1 Правил Приказа Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | |||||
| 115. | стерилизуемые предметы, не находящиеся в герметичных упаковках, завернуты в материал, пропускающий воздух и пар, но предотвращающий повторную контаминацию этих предметов после стерилизации. | п. 102. (95) Приложение №1 Правил Приказа Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | |||||
| 116. | обеспечен контакт всех частей загрузки со стерилизующим агентом при заданных температуре и времени | п. 102. (95) Приложение №1 Правил Приказа Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | |||||
| 117. | для стерилизации применяется пар надлежащего качества, не содержащий такого количества примесей, которое могло бы вызывать контаминацию продукции или оборудования | п. 103. (96) Приложение №1 Правил Приказа Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | |||||
| 118. | при сухожаровой стерилизации предусмотрены циркуляция воздуха внутри камеры и поддержание избыточного давления для предотвращения попадания внутрь нее нестерильного воздуха | п. 104. (97) Приложение №1 Правил Приказа Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | |||||
| 119. | при сухожаровой стерилизации поступающий внутрь воздух проходит через фильтры высокой эффективности (HEPA-фильтр) | п. 104. (97) Приложение №1 Правил Приказа Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | |||||
| 120. | при сухожаровой стерилизации, предусматривающей устранение пирогенов, частью валидации являются испытание с преднамеренным использованием эндотоксинов | п. 104. (97) Приложение №1 Правил Приказа Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | |||||
| 121. | радиационную стерилизацию используют после экспериментального подтверждения отсутствия вредного влияния на продукцию | п. 105. (98) Приложение №1 Правил Приказа Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | |||||
| 122. | во время процесса стерилизации проводится измерение поглощенной дозы ионизирующего излучения. Дозиметры размещены среди загрузки в достаточном количестве и на достаточно близком расстоянии друг от друга. Пластмассовые дозиметры применяются лишь в пределах срока действия их калибровки. Показания дозиметров снимаются в течение короткого отрезка времени после облучения | п. 106. (99) Приложение №1 Правил Приказа Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | |||||
| 123. | в качестве средства дополнительного контроля используются биологические индикаторы | п. 107. (100) Приложение №1 Правил Приказа Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | |||||
| 124. | процедуры валидации гарантируют, что учтено влияние разной плотности укладки стерилизуемой продукции | п. 108. (101) Приложение №1 Правил Приказа Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | |||||
| 125. | процедуры обращения с материалами предотвращают перепутывание между облученными и необлученными материалами | п. 109. (102) Приложение №1 Правил Приказа Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | |||||
| 126. | суммарная поглощенная доза излучения набрана в течение времени, отведенного на процесс стерилизации | п. 110. (103) Приложение №1 Правил Приказа Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | |||||
| 127. | при стерилизация оксидом этилена во время валидации процесса доказано, что отсутствует повреждающее влияние на продукцию, а предусмотренные для дегазации условия и время таковы, что количество остаточного газа и продуктов реакции будет находиться в допустимых пределах, установленных для данного вида продукции или материала | п. 111. (104) Приказа Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" Приложение №1 Правил | |||||
| 128. | при стерилизация оксидом этилена приняты меры предосторожности от включения микроорганизмов в материал | п. 112. (105) Приложение №1 Правил Приказа Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | |||||
| 129. | при стерилизация оксидом этилена перед обработкой газом обеспечено соответствие влажности и температуры материалов требованиям процесса | п. 113. (106) Приложение №1 Правил Приказа Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | |||||
| 130. | каждый цикл стерилизации оксидом этилена контролируется с помощью соответствующих биологических индикаторов, необходимое количество которых равномерно распределено по всей загрузке. Полученная при этом информация составляет часть досье на серию готовой продукции | п. 114. (107) Приложение №1 Правил Приказа Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | |||||
| 131. | для каждого цикла стерилизации оксидом этилена оформлены записи с указанием времени полного завершения цикла, давления, температуры и влажности в камере во время процесса, а также концентрации и общего количества использованного газа. Давление и температура регистрируется на протяжении всего цикла на диаграмме. Эти записи составляют часть досье на серию готовой продукции | п. 115. (108) Приложение №1 Правил Приказа Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | |||||
| 132. | загрузки после стерилизации оксидом этилена хранятся под контролем в условиях вентиляции. Этот процесс прошел валидацию | п. 116. (109) Приложение №1 Правил Приказа Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | |||||
| Фильтрация лекарственных средств, которые не могут быть простерилизованы в окончательной упаковке | |||||||
| 133. | растворы или жидкости профильтрованы через стерильный фильтр с номинальным размером пор 0,22 мкм (или менее) или через фильтр с аналогичной способностью задерживать микроорганизмы в предварительно простерилизованные контейнеры (упаковки) | п. 117. (110) Приложение №1 Правил Приказа Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | |||||
| 134. | перед фасовкой проводится повторная фильтрация через дополнительный стерилизующий фильтр, задерживающий микроорганизмы | п. 118. (111) Приложение №1 Правил Приказа Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | |||||
| 135. | используются фильтры с минимальным отделением волокон | п. 119. (112) Приложение №1 Правил Приказа Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | |||||
| 136. | перед использованием стерилизующего фильтра и сразу после его использования проверяется его целостность таким методом, как "точка пузырька", методом диффузионного потока или испытанием под давлением | п. 120. (113) Приложение №1 Правил Приказа Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | |||||
| 137. | при валидации определяется время, необходимое для фильтрации раствора заданного объема, и перепад давлений на фильтре | п. 120. (113) Приложение №1 Правил Приказа Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | |||||
| 138. | любые существенные отклонения от указанных параметров во время текущего производства регистрируются и исследуются | п. 120. (113) Приложение №1 Правил Приказа Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | |||||
| 139. | результаты проверок включены в досье на серию продукции. Сразу после использования подтверждается целостность критических газовых и воздушных фильтров. Целостность других фильтров подтверждается через соответствующие интервалы времени | п. 120. (113) Приложение №1 Правил Приказа Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | |||||
| 140. | не допускается использование одного и того же фильтра в течение более одного рабочего дня, без возможности более длительного его использования подтвержденной валидацией | п. 121. (114) Приложение №1 Правил Приказа Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | |||||
| 141. | фильтры не оказывают влияние на продукцию, не задерживают ее ингредиенты не выделяют в нее какие-либо вещества | п. 122. (115) Приложение №1 Правил Приказа Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | |||||
| 142. | частично укупоренные флаконы после завершения лиофильного высушивания находятся в зоне класса A до их окончательного укупоривания пробкой | п. 123. (116) Приложение №1 Правил Приказа Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | |||||
| 143. | контейнеры (первичные упаковки) укупорены соответствующими способами, которые прошли валидаци | п. 124. (117) Приложение №1 Правил Приказа Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | |||||
| 144. | при использовании метода запайки, стеклянных или пластмассовых ампул, вся продукция подвергается 100%-ному контролю на целостность | п. 124. (117) Приложение №1 Правил Приказа Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | |||||
| 145. | обжим колпачка после укупоривания пробкой выполняется как можно раньше | п. 125. (118) Приложение №1 Правил Приказа Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | |||||
| 146. | оборудование для обжима размещается отдельно и снабжено системой вытяжки воздуха | п. 126. (119) Приложение №1 Правил Приказа Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | |||||
| 147. | обжим колпачков на флаконах проводится как часть асептического процесса с использованием простерилизованных колпачков | п. 127. (120) Приложение №1 Правил Приказа Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | |||||
| 148. | обжим колпачков на флаконах проводится в условиях чистого помещения вне асептической зоны с защитой флаконов зоной класса A, пока не покинут асептическую зону, и в дальнейшем укупоренные пробками флаконы защищены путем подачи чистого воздуха класса A, пока на них не будут обжаты колпачки | п. 127. (120) Приложение №1 Правил Приказа Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | |||||
| 149. | флаконы без пробки или со смещенной пробкой удаляются до обжима колпачка | п. 128. (121) Приложение №1 Правил Приказа Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | |||||
| 150. | первичные упаковки, герметизированные под вакуумом (вакуумные упаковки), проверяются на сохранение вакуума после заранее определенного промежутка времени | п. 130. (123) Приложение №1 Правил Приказа Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | |||||
| 151. | первичные упаковки с продукцией для парентерального введения проверяют индивидуально (поштучно) на наличие посторонних включений или других несоответствий по качеству | п. 131. (124) Приложение №1 Правил Приказа Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | |||||
| 152. | визуальный контроль проводится при установленных уровнях освещенности и фоне рабочего поля | п. 131. (124) Приложение №1 Правил Приказа Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | |||||
| 153. | зрение операторов, выполняющих визуальный контроль регулярно проверяется (если операторы используют очки, то проверка зрения проводится в очках). В ходе визуального контроля продукции организованы перерывы в работе операторов достаточно часто | п. 131. (124) Приложение №1 Правил Приказа Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | |||||
| 154. | процесс визуального контроля с помощью оборудования валидирован, состояние оборудования периодически проверяется | п. 131. (124) Приложение №1 Правил Приказа Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | |||||
| 155. | результаты визуального контроля оформлены документально | п. 131. (124) Приложение №1 Правил Приказа Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | |||||
| 156. | методика испытания на стерильность валидирована для каждого продукта | п. 132 (125) приложение №1 Правил Приказа Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | |||||
| 157. | выборка образцов продукции, отобранных для проведения испытания на стерильность, сделана из тех частей серии, для которых предполагается наибольший риск контаминации | п. 133 (126) приложение №1 Правил Приказа Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | |||||
Подписи лиц, проводивших проверку:_______________________________________________________________________________________________________________
___________________________________________________________________________
___________________________________________________________________________
С результатами проверки ознакомлен(а), копию проверочного листа получил(а):
___________________________________________________________________________
___________________________________________________________________________
___________________________________________________________________________
(фамилия, имя, отчество (последнее - при наличии), должность руководителя, иного должностного лица или уполномоченного представителя юридического лица, индивидуального предпринимателя, его уполномоченного представителя)
«____»_____________________ 20____г
(подпись)
Рекомендации по заполнению контрольного листа (списка контрольных вопросов):
в позиции «ДА» проставляется отметка, если предъявляемое требование реализовано в полном объеме;
в позиции «НЕТ» проставляется отметка, если предъявляемое требование не реализовано или реализовано не в полном объеме;
в позиции «Не требуется» проставляется отметка, если предъявляемое требование не подлежит реализации проверяемым субъектом и (или) контролю (надзору) применительно к данному проверяемому субъекту);
в позиции «Примечание» отражаются поясняющие записи, если предъявляемое требование реализовано не в полном объеме, и иные пояснения.
-------------------------------------------
*(1) Используется следующие способы: 1) документарный; 2) визуальный; 3) дополнительные исследования/испытания (при необходимости)
утверждено
приказом Россельхоза
от ___________________N____
Федеральная служба по ветеринарному и фитосанитарному надзору
_____________________________________________________________________________________
наименование органа государственного контроля (надзора)
Государственный контроль (надзор) в сфере обращения лекарственных средств для ветеринарного применения
(в части производство биологических (в том числе иммунобиологических) фармацевтических субстанций и лекарственных препаратов)
_____________________________________________
вид государственного контроля (надзора
Проверочный лист (список контрольных вопросов)
По адресу/адресам:
_____________________________________________________________________________________
_____________________________________________________________________________________
_____________________________________________________________________________________
(место проведения проверки)
На основании:
_____________________________________________________________________________________
_____________________________________________________________________________________
_____________________________________________________________________________________
(вид документа с указанием реквизитов (номер, дата)
была проведена плановая проверка в отношении:
_____________________________________________________________________________________
_____________________________________________________________________________________
(наименование юридического лица, фамилия, имя, отчество (последнее - при наличии) индивидуального предпринимателя)
_____________________________________________________________________________________
(учетный номер проверки и дата присвоения учетного номера проверки в едином реестре проверок)
Лицо(а), проводившее проверку:
_____________________________________________________________________________________
_____________________________________________________________________________________
_____________________________________________________________________________________
_____________________________________________________________________________________
_____________________________________________________________________________________
_____________________________________________________________________________________
(фамилия, имя, отчество (последнее - при наличии), должность должностного лица (должностных лиц), проводившего(их) проверку; в случае привлечения к участию в проверке экспертов, экспертных организаций указываются фамилии, имена, отчества (последнее - при наличии), должности экспертов и/или наименования экспертных организаций с указанием реквизитов свидетельства об аккредитации и наименование органа по аккредитации, выдавшего свидетельство)
При проведении проверки присутствовали:
_____________________________________________________________________________________
_____________________________________________________________________________________
_____________________________________________________________________________________
_____________________________________________________________________________________
_____________________________________________________________________________________
_____________________________________________________________________________________
(фамилия, имя, отчество (последнее - при наличии), должность руководителя, иного должностного лица (должностных лиц) или уполномоченного представителя юридического лица, уполномоченного представителя индивидуального предпринимателя, уполномоченного представителя саморегулируемой организации (в случае проведения проверки члена саморегулируемой организации), присутствовавших при проведении мероприятий по проверке)
наименование органа государственного контроля (надзора)
| № п/п | Перечень предъявляемых требований | Структурные элементы нормативных правовых актов и технических нормативных правовых актов | Да | Нет | Не требуется | Способ подтверждения соблюдения обязательных требований*(1) |
|---|---|---|---|---|---|---|
| 1. | принципы управления рисками для качества соблюдаются при разработке методов контроля на всех стадиях производства | п. 8. Приложение №2 Правил Приказ Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | ||||
| 2. | для сведения к минимуму возможности контаминации производитель уделяет основное внимание планированию технологического процесса, конструкции оборудования, помещений, систем обеспечения, условиям приготовления и добавления буферов и реагентов, отбору проб и обучению персонала | п. 9. Приложение №2 Правил Приказ Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | ||||
| 3. | спецификации на продукцию определяют, могут ли вещества и материалы иметь определенный уровень бионагрузки или же они должны быть стерильными | п. 10. Приложение №2 Правил Приказ Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | ||||
| 4. | производство соответствует требованиям изложенным в регистрационном досье либо протоколу клинического исследования (например, количеству генераций (удвоений, пассажей) между просевной культурой или банком клеток) | п. 10. Приложение №2 Правил Приказ Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | ||||
| 5. | для биологических материалов, которые не могут быть простерилизованы, производство проводится в асептических условиях для минимизации риска внесения контаминантов производство биологических материалов, которые не подвергаются финишной стерилизации, осуществляется в асептических условиях для минимизации риска внесения контаминантов | п. 11. Приложение №2 Правил Приказ Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | ||||
| 6. | для регламентации производственных методов, руководствуются соответствующими используются утвержденные процедуры, регламентирующие определенные производственные методы (например, для удаления или инактивации вирусов) | п. 11. Приложение №2 Правил Приказ Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | ||||
| 7. | контроль включает в себя биологические аналитические методы, которые характеризуются более высокой степенью вариабельности, чем физико-химические методы используются биологические аналитические методы, которые характеризуются более высокой степенью вариабельности, чем физико-химические методы. Уделяется особое значение контролю в процессе производства биологических фармацевтических субстанций и лекарственных препаратов | п. 12. Приложение №2 Правил Приказ Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | ||||
| 8. | биологические лекарственные препараты, в состав которых входят донорские ткани или клетки, как например, определенные высокотехнологичные лекарственные препараты, соответствуют требованиям законодательства Российской Федерации в части прослеживаемости, уведомления уполномоченного федерального органа исполнительной власти о неблагоприятных реакциях и клинических случаях в ходе терапии, а также в части технических требований по идентификации, обработке, предохранению, хранению и транспортировке донорских тканей и клеток. Забор материалов и проведение испытаний проводятся в соответствии с системой качества, для которой определены стандарты и технические требования | п. 13. Приложение №2 Правил Приказ Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | ||||
| 9. | биологические фармацевтические субстанции и лекарственные препараты соответствуют требованиям нормативных правовых актов Российской Федерации в отношении уменьшения риска передачи возбудителя губчатой энцефалопатии животных и латентных вирусов через лекарственные препараты для медицинского применения и для применения в ветеринарии в отношении уменьшения риска передачи возбудителя губчатой энцефалопатии животных и латентных вирусов через лекарственные препараты для ветеринарного применения, используются только биологические фармацевтические субстанции и лекарственные препараты соответствующие требованиям нормативных правовых актов Российской Федерации | п. 14. Приложение №2 Правил Приказ Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | ||||
| 10. | персонал, работающий в зонах производства и контроля биологических фармацевтических субстанций и лекарственных препаратов (в том числе персонал, занятый очисткой, обслуживанием или контролем качества), проходит обучение и периодическое повторное обучение в соответствии со своими обязанностями и спецификой производимой продукции, включая все особые меры предосторожности для защиты продукции, персонала и охраны окружающей среды | п. 15. (1) Приложение №2 Правил Приказ Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | ||||
| 11. | для обеспечения безопасности продукции принимается во внимание здоровье персонала. Сотрудники, занятые в производстве, техническом обслуживании, проведении испытаний и уходе за животными (в том числе осуществляющие контроль), вакцинированы соответствующими специфическими вакцинами, а также проходят регулярные медицинские осмотры | п. 16. (2) Приложение №2 Правил Приказ Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | ||||
| 12. | любые заболевания персонала, которые могут неблагоприятно повлиять на качество продукта, препятствуют работе персонала в производственной зоне, а соответствующие записи сохраняться. | п. 17. (3) Приложение №2 Правил Приказ Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | ||||
| 13. | в производстве вакцины БЦЖ и лекарственных препаратов туберкулина могут заняты только сотрудники, которые регулярно проходят проверку иммунного статуса или рентгенологическое обследование грудной клетки. Сотрудники проходят медицинский осмотр с учетом риска, которому они подвержены | п. 17. (3) Приложение №2 Правил Приказ Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | ||||
| 14. | контролируется ограничение движения персонала на основе принципов управления рисками для качества. Не допускается переход сотрудников из зон, где возможен контакт с живыми микроорганизмами, генетически модифицированными организмами, токсинами или животными, в зоны, где проводятся работы с другой продукцией, инактивированной продукцией или другими организмами. При переходе из таких зон приняты меры для контроля контаминации согласно принципам управления рисками для качества | п. 18. (4) Приложение №2 Правил Приказ Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | ||||
| 15. | соответствует степень контроля производственной среды в отношении контаминации частицами и микроорганизмами в производственных помещениях виду фармацевтической субстанции, промежуточной и готовой продукции и стадии технологического процесса | п. 19. (5) приложения №2 Правил Приказ Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | ||||
| 16. | учитывается уровень контаминации исходных материалов и степень риска для готового продукта | п. 19. (5) приложения №2 Правил Приказ Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | ||||
| 17. | включены дополнительные методы в программу мониторинга производственной среды для определения присутствия специфических микроорганизмов (в частности, организма-хозяина, дрожжевых, плесневых грибов, анаэробных микроорганизмов), если на это указывает процесс управления рисками для качества | п. 19. (5) приложения №2 Правил Приказ Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | ||||
| 18. | разработан проект производственных и складских помещений с учетом требований к классам чистоты, а процессы спланированы таким образом, чтобы предотвратить контаминацию продукции посторонними веществами | п. 20. (6) приложения №2 Правил Приказ Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | ||||
| 19. | учитываются принципы при выборе последовательных классов чистоты в производственных помещениях и соответствующих методов контроля | п. 20. (6) приложения №2 Правил Приказ Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | ||||
| 20. | учитываются принципы управления рисками для качества, изложенные в соответствующих пунктах Приложения N 1 к Правилам | п. 20. (6) приложения №2 Правил Приказ Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | ||||
| 21. | используются только специально предназначенные производственные помещения при работе с живыми клетками, устойчивыми к среде производственных помещений | п. 21. (7) приложения №2 Правил Приказ Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | ||||
| 22. | используются специализированные помещений для финишной обработки (в частности, для приготовления, наполнения, упаковки) в отношении специфики биологического лекарственного препарата и характеристик другой продукции, включая любые небиологические продукты, производимые в тех же помещениях | п. 23. (9) приложения №2 Правил Приказ Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | ||||
| 23. | используются необходимые зоны для работы со стерильной продукцией с избыточным давлением, а в особых зонах в точках локализации патогенных микроорганизмов создан отрицательный перепад давления для предотвращения распространения контаминантов за пределы этих зон | п. 26. (12) приложения №2 Правил Приказ Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | ||||
| 24. | используются зоны с пониженным давлением или безопасные боксы для работы в асептических условиях с материалами, составляющими особый риск (например, с патогенными микроорганизмами), и окружены зонами соответствующего класса чистоты с избыточным давлением | п. 26. (12) приложения №2 Правил Приказ Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | ||||
| 25. | определены перепады давления и находятся под постоянным контролем с соответствующими настройками аварийной сигнализации | п. 26. (12) приложения №2 Правил Приказ Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | ||||
| 26. | исключена возможность контаминации во время проведения работы на конструкциях оборудования, используемого с живыми микроорганизмами и клетками, включая оборудование для отбора проб | п. 27. (13) приложения №2 Правил Приказ Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | ||||
| 27. | обеспечена первичная изоляция конструкций, и исключает риск утечки биологических агентов в непосредственное рабочее пространство, и подтверждаются результатами тестирования с определенной периодичностью | п. 28. (14) приложения №2 Правил Приказ Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | ||||
| 28. | определен срок службы воздушных фильтров в процессе валидации путем проверки целостности с определенной периодичностью согласно соответствующим принципам управления рисками для качества | п. 30. (16) приложения №2 Правил Приказ Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | ||||
| 29. | проводится эффективная нейтрализация и деконтаминация сточных вод для исключения риска перекрестной контаминаци с целью минимизации риска контаминации окружающей среды в соответствии с рисками, связанными с биологической опасностью отходов производства | п. 31. (17) приложения №2 Правил Приказ Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | ||||
| 30. | осуществляется хранение небольших запасов исходного сырья на протяжении срока, установленного на основании соответствующих критериев (например, длительность производства серии или длительность кампании), ввиду изменчивости свойств биологических лекарственных средств | п. 32. (18) приложения №2 Правил Приказ Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | ||||
| 31. | Особое внимание уделяется предотвращению и мониторингу инфекционных заболеваний у животных, которые используются в качестве сырья, и у животных-доноров. Принимаемые меры включают контроль источников, помещений, пастбищ, контроль биологической безопасности, режимов проведения испытаний, контроль вспомогательных материалов и кормов для животных. Особенную значимость имеют проверки животных, свободных от специфических патогенов. Определены требования к содержанию и мониторингу здоровья других животных (например, живущих в стаях или стадах) | п. 36. (21) Приложение №2 Правил Приказ Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | ||||
| 32. | для лекарственных препаратов, произведенных с использованием трансгенных животных, обеспечена отслеживаемость исходных животных, использованных для создания из них трансгенных животных | п. 37. (22) Приложение №2 Правил Приказ Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | ||||
| 33. | особое внимание уделено выполнению требований нормативных правовых актов Российской Федерации, регулирующих вопросы защиты животных, используемых в экспериментальных целях, в отношении вивариев, в которых содержатся животные, ухода за животными и карантина. Виварии, в которых содержатся животные, используемые для производства и контроля качества биологических фармацевтических субстанций и лекарственных препаратов, отделены от зон производства и контроля качества | п. 38. (23) Приложение №2 Правил Приказ Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | ||||
| 34. | для различных видов животных определены основные показатели, которые затем контролируют и регистрируют. Показатели включают возраст, пол, вес и состояние здоровья животных | п. 39. (24) Приложение №2 Правил Приказ Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | ||||
| 35. | для предотвращения риска перепутывания животных, биологических агентов и результатов проведенных испытаний и предотвращения возможных опасностей, существует система их идентификации | п. 40. (25) Приложение №2 Правил Приказ Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | ||||
| 36. | в отношении аутологичного лекарственного препарата и лекарственного препарата от специально подобранного донора, продукция рассматривается как одна серия | п. 42. (27) Приложение №2 Правил Приказ Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | ||||
| 37. | обеспечено на разных этапах жизненного цикла продукции повышение надежности и устойчивости процесса, снижая тем самым его вариабельность и повышая воспроизводимость. Повторная оценка проводится в процессе обзоров качества продукции | п. 44. (29) Приложение №2 Правил Приказ Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | ||||
| 38. | контролируется согласно установленным требованиям и процедурам риск перекрестной контаминации между клеточными лекарственными препаратами от разных доноров с различным состоянием здоровья для высокотехнологичных лекарственных препаратов на основе клеток | п. 45. (30) Приложение №2 Правил Приказ Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | ||||
| 39. | четко определяется источник, происхождение и пригодность биологических исходного сырья и исходных материалов для последующего их использования. Проводится идентификация всех исходных материалов | п. 46. (31) Приложение №2 Правил Приказ Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | ||||
| 40. | при оценке рисков контаминации исходного сырья и исходных материалов во время их прохождения по цепи поставок особое внимание уделяется риску, связанному с губчатой энцефалопатией животных и латентными вирусами, при этом уделено внимание исходным материалам, непосредственно контактирующим с технологическим оборудованием или продукцией (таким как питательные среды, используемые для симуляции асептического розлива, и смазочные материалы, которые могут контактировать с продуктом) | п. 47. (32) Приложение №2 Правил Приказ Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | ||||
| 41. | установление стратегии контроля для защиты продукции, приготовления растворов, буферов и добавляемых компонентов основывается на принципах и руководящих указаниях, содержащихся в соответствующих пунктах Приложения N 1 к Правилам с учетом важности контрольных мероприятий, необходимых для проверки качества исходных материалов, а также для процесса асептического производства продукции на клеточной основе, где финишная стерилизация не является возможной, а способность удаления микробных побочных продуктов ограничена | п. 48. (33) Приложение №2 Правил Приказ Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | ||||
| 42. | поддерживается установленный уровень бионагрузки | п. 48. (33) Приложение №2 Правил Приказ Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | ||||
| 43. | при необходимости стерилизации исходного сырья и материалов, стерилизация, стерилизация проводится термическим методом. или используются другие соответствующие методы для инактивации биологических материалов | п. 49. (34) Приложение №2 Правил Приказ Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | ||||
| 44. | при использовании антибиотиков на ранних этапах производства их применение в технологическом процессе прекращено на стадии, указанной в регистрационном досье или протоколе клинических исследований | п. 50. (35) Приложение №2 Правил Приказ Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | ||||
| 45. | для человеческих тканей и клеток, используемых в качестве исходных материалов для биологических лекарственных средств, учитываются необходимые требования | п. 51. (36) Приложение №2 Правил Приказ Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | ||||
| 46. | в отношении генной терапии учитываются необходимые требования | п. 52. (37) Приложение №2 Правил Приказ Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | ||||
| 47. | для предотвращения нежелательного изменения свойств, которое может произойти вследствие многократных пересевов или большого числа генераций, производство биологических фармацевтических субстанций и лекарственных препаратов, получаемых из культур микроорганизмов, культур клеток или размножением в эмбрионах, тканях и органах животных, основано на системе главной и рабочей вирусных посевных культур и (или) банков клеток | п. 54. (39) Приложение №2 Правил Приказ Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | ||||
| 48. | количество генераций (удвоений, пассажей) между посевной культурой или банком клеток и биологической фармацевтической субстанцией либо лекарственным препаратом соответствует требованиям спецификаций в регистрационном досье или протоколе клинических исследований | п. 55. (40) Приложение №2 Правил Приказ Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | ||||
| 49. | создание систем посевных культур и банков клеток, включая главные и рабочие посевные культуры, являются частью управления жизненным циклом продукции и проводится в надлежащих условиях. Производственная среда находится под соответствующим контролем для обеспечения безопасности систем посевных культур и банков клеток, а также персонала, работающего с ними | п. 56. (41) Приложение №2 Правил Приказ Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | ||||
| 50. | при создании посевных культур и банков клеток не допускается одновременная работа с другими живыми или инфицирующими материалами в одной и той же зоне или одного и того же персонала | п. 56. (41) Приложение №2 Правил Приказ Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | ||||
| 51. | доступна документация, позволяющая обеспечить прослеживаемость стадий, предшествующих генерации главной посевной культуры или главного банка клеток, где могут быть применены только принципы Правил. Документация включает информацию относительно компонентов, использовавшихся во время разработки и возможно влияющих на безопасность продукции, от начального источника и до главного клеточного или главного посевного банка | п. 56. (41) Приложение №2 Правил Приказ Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | ||||
| 52. | после формирования основного и рабочего банков клеток и посевных культур соблюдаются процедуры по карантину и разрешению банков к использованию. Проведены соответствующие квалификация и испытания в отношении контаминантов. Их дальнейшая пригодность впоследствии подтверждена стабильностью характеристик и качеством последующих серий продукции | п. 57. (42) Приложение №2 Правил Приказ Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | ||||
| 53. | доказательство стабильности и воспроизводимости посевных культур или банков клеток оформляется документально. Содержание записей позволяет проводить оценку тенденций | п. 57. (42) Приложение №2 Правил Приказ Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | ||||
| 54. | посевные культуры и банки клеток создают, хранят и используют таким образом, чтобы риск их контаминации или изменения минимальный. В случае хранения различных посевных культур и банков клеток в одних и тех же зонах или с использованием одного и того же оборудования приняты меры по предотвращению перепутывания и перекрестной контаминации с учетом инфекционной природы материалов | п. 58. (43) Приложение №2 Правил Приказ Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | ||||
| 55. | лекарственные препараты на основе клеток производятся из клеточного запаса, полученного из ограниченного количества пассажей. Количество производственных циклов на основе клеточного запаса ограничено количеством аликвот, полученных после роста, и не распространяется на весь жизненный цикл продукции. Протокол валидации учитывает изменения клеточного запаса | п. 59. (44) Приложение №2 Правил Приказ Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | ||||
| 56. | емкости для хранения герметично закрыты и четко маркированы; содержатся при соответствующей температуре. Ведется документальный учет хранящихся емкостей. Температуру хранения непрерывно регистрируется, а в установках с жидким азотом контролируют его уровень. Отклонения параметров хранения от установленных пределов и любые предпринятые корректирующие и предупреждающие действия оформлены документально | п. 60. (45) Приложение №2 Правил Приказ Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | ||||
| 57. | разделяют запасы на части и хранят раздельно во избежание полной утраты. Контроль месторасположения обеспечивает выполнение требований | п. 61. (46) Приложение №2 Правил Приказ Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | ||||
| 58. | условия хранения и обработки запасов определяются согласно процедурам и параметрам. После взятия контейнеров из хранилища посевной культуры или банка клеток не возвращают их в хранилище повторно | п. 62. (47) Приложение №2 Правил Приказ Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | ||||
| 59. | при управлении изменениями с установленной периодичностью рассматриваются эффекты, включая кумулятивные эффекты изменений, влияющие на качество, безопасность и эффективность готового лекарственного препарата | п. 63. (48) Приложение №2 Правил Приказ Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | ||||
| 60. | критические операционные (технологические) или другие исходные параметры, влияющие на качество лекарственного препарата, определены, валидированы, документированы и поддерживаются в соответствии с установленными требованиями | п. 64. (49) Приложение №2 Правил Приказ Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | ||||
| 61. | стратегия контроля поступления исходного сырья и исходных материалов в производственные зоны основывается на принципах управления рисками для качества. Для асептических процессов термостойкие исходное сырье и исходные материалы, попадающие в чистую или чистую и изолированную зону, при наличии возможности, поступают в них через проходной автоклав или сухожаровой шкаф. | п. 65. (50) Приложение №2 Правил Приказ Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | ||||
| 62. | нетермостойкие исходное сырье и исходные материалы вносятся через воздушные шлюзы с блокировкой дверей, подвергаясь процедурам эффективной санитарной обработки поверхности. | п. 65. (50) Приложение №2 Правил Приказ Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | ||||
| 63. | разрешается стерилизация предметов и материалов в другом месте при условии, что они содержат количество оберток, соответствующих числу стадий, необходимых для прохождения в чистую зону, и вносятся в нее через воздушный шлюз с соблюдением соответствующих мер предосторожности путем санитарной обработки поверхностей | п. 65. (50) Приложение №2 Правил Приказ Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | ||||
| 64. | подтверждены ростовые свойства питательных сред с целью доказательства их пригодности для предполагаемого использования. Питательные среды стерилизуются на месте. | п. 66. (51) Приложение №2 Правил Приказ Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | ||||
| 65. | при плановой подаче газов, питательных сред, кислот или щелочей, пеногасителей к ферментерам используются стерилизующие фильтры, встроенные в линии подачи | п. 66. (51) Приложение №2 Правил Приказ Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | ||||
| 66. | добавление веществ или культур в ферментеры и другие сосуды, а также отбор проб из них проводится в тщательно контролируемых условиях для предотвращения контаминации. При внесении добавок или отборе проб контролируется правильность подсоединения сосудов | п. 67. (52) Приложение №2 Правил Приказ Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | ||||
| 67. | осуществляется постоянный контроль некоторых производственных процессов с внесением результатов контроля в записи по производству серии. При производстве с использованием метода непрерывного культивирования соблюдаются специальные требования к контролю качества, подлежащие применению в результате выбора такого производственного метода | п. 68. (53) Приложение №2 Правил Приказ Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | ||||
| 68. | процессы центрифугирования и смешивания продуктов проводятся в изолированных зонах | п. 69. (54) Приложение №2 Правил Приказ Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | ||||
| 69. | при случайной утечке, в особенности живых микроорганизмов, приняты неотложные меры безопасности. Для каждого вида или группы микроорганизмов предусмотрены специальные мероприятия по деконтаминации. | п. 70. (55) Приложение №2 Правил Приказ Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | ||||
| 70. | материалы, использующиеся для производства и контроля, дезинфицированы, или информация передается другими способами | п. 71. (56) Приложение №2 Правил Приказ Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | ||||
| 71. | при инактивации или удалении вирусов в ходе производства принимаются меры против повторной контаминации обработанной продукции со стороны необработанной продукции | п. 72. (57) Приложение №2 Правил Приказ Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | ||||
| 72. | для продуктов, инактивируемых при помощи добавления реагентов, процесс гарантирует полную инактивацию живых микроорганизмов. После тщательного смешивания культуры и инактивирующего агента учитывается все контактирующие с продуктом поверхности, пребывавшие в контакте с культурой | п. 73. (58) Приложение №2 Правил Приказ Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | ||||
| 73. | при применении хроматографических методов используют разные виды оборудования. Принципы управления рисками для качества соблюдаются при разработке стратегии контроля сорбентов, корпусов колонок и другого оборудования при их использовании для производства в режиме кампаний или в производственной среде, предназначенной для производства нескольких типов продукции. Установлены критерии приемлемости, условия работы, методы восстановления, срок службы и методы стерилизации или дезинфекции колонок | п. 74. (59) Приложение №2 Правил Приказ Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | ||||
| 74. | существует система, гарантирующая целостность и герметичность контейнеров после их наполнения, и предусмотрены процедуры на случай любых утечек или просыпаний и проливов, в случае если продукт или промежуточный продукт представляют особый риск | п. 76. (61) Приложение №2 Правил Приказ Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | ||||
| 75. | для операций по розливу и упаковке существуют процедуры по соблюдению условий, обеспечивающих поддержание продукта в установленных пределах | п. 76. (61) Приложение №2 Правил Приказ Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | ||||
| 76. | работа с контейнерами, содержащими биологические агенты, проводится таким образом, чтобы избежать контаминации других лекарственных препаратов или проникновения живых агентов в производственную или окружающую среду. Для принятия решения относительно управления данными рисками приняты во внимание жизнеспособность таких организмов и их биологическая классификация (группа патогенности) | п. 77. (62) Приложение №2 Правил Приказ Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | ||||
| 77. | уделяется должное внимание подготовке, печати, хранению и нанесению этикеток на упаковку, в том числе нанесению на первичную и вторичную упаковку специфической информации для пациент-специфических продуктов или об использовании методов генетической инженерии | п. 78. (63) Приложение №2 Правил Приказ Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | ||||
| 78. | в случае если высокотехнологичные лекарственные препараты предназначены для аутологичного применения, на этикетке указываются уникальный идентификатор пациента и надпись "только для аутологичного применения". Если внешняя упаковка отсутствует, данная информация указывается на первичной упаковке | п. 78. (63) Приложение №2 Правил Приказ Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | ||||
| 79. | при использования сверхнизких температур хранения устойчивость маркировки к используемым температурам подтверждена | п. 79. (64) Приложение №2 Правил Приказ Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | ||||
| 80. | когда информация о состоянии здоровья донора (человека или животного), имеющая значение для качества продукции, становится доступной после закупки, это учитывается в процедурах отзыва | п. 80. (65) Приложение №2 Правил Приказ Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | ||||
| 81. | контроль в процессе производства является более важным для обеспечения стабильности качества биологических фармацевтических субстанций и лекарственных препаратов, чем для других лекарственных препаратов. Межоперационный контроль осуществляется на соответствующих стадиях производства с целью контроля условий, являющихся важными для качества готового продукта | п. 81. (66) Приложение №2 Правил Приказ Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | ||||
| 82. | в случае если промежуточные продукты могут храниться на протяжении длительного времени, рассмотрена возможность включения в текущую программу испытания стабильности таких серий готовой продукции, которые произведены из промежуточных продуктов с максимальным периодом хранения в процессе производства | п. 82. (67) Приложение №2 Правил Приказ Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | ||||
| 83. | для определенных типов клеток, которые могут быть доступны в ограниченных количествах, проведение испытаний и порядок хранения контрольных образцов оформляется документально | п. 83. (68) Приложение №2 Правил Приказ Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | ||||
| 84. | для клеточных высокотехнологичных лекарственных средств тесты на стерильность проводятся на культурах клеток или банках клеток, свободных от антибиотиков | п. 84. (69) Приложение №2 Правил Приказ Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | ||||
| 85. | осуществляется соответствующая стратегия контроля для производства биологических лекарственных препаратов с коротким сроком годности, до 14 дней. Проводится непрерывная оценка эффективности системы обеспечения качества, включая ведение записей, позволяющих оценивать тенденции. Предусмотрены альтернативные методы получения соответствующих результатов, позволяющих проводить предварительное подтверждение соответствия серий в случаях, если невозможно провести испытания готового лекарственного препарата из-за его короткого срока годности | п. 85. (70) Приложение №2 Правил Приказ Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | ||||
| 86. | предусмотрена процедура, описывающая необходимые мероприятия, в случае получения результатов испытаний, выходящих за границы спецификаций. Такие случаи расследуются в полном объеме, соответствующие корректирующие и предупреждающие действия, направленные на предотвращение возможности повторения таких случаев, регистрируются документально | п. 86. Приложение №2 Правил Приказ Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | ||||
| 87. | применяются средства контроля, основанные на принципах управления рисками для качества. При этом учитываются требования Государственной фармакопеи Российской Федерации, включая проведение соответствующих испытаний на определенных стадиях. Ведется соответствующая документация, обеспечивающая прослеживаемость цепи поставок с четким указанием роли каждого участника цепи поставок, включая, как правило, достаточно подробное описание схемы поставок | п. 87. Приложение №2 Правил Приказ Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | ||||
| 88. | имеется программа мониторинга опасных для человека болезней животных (ветеринарное освидетельствование). При оценке факторов риска приняты во внимание сообщения заслуживающих доверие источников относительно распространенности заболевания на территории государства, в том числе содержащие информацию о проверке состояния здоровья животных и программе(ах) контроля на государственном и местном уровнях, включая мероприятия контроля источников (например, фермы или загоны для скота), из которых получены животные, и контроль во время транспортировки животных на скотобойню. | п. 88. (1) Приложение №2 Правил Приказ Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | ||||
| 89. | скотобойни соответствуют требованиям, установленным нормативными правовыми актами Российской Федерации, при использовании их в качестве поставщиков тканей животных. Приняты во внимание сведения от уполномоченного федерального органа исполнительной власти, подтверждающие соблюдение требований безопасности и качества кормов, установленные нормативными правовыми актами Российской Федерации и (или) других стран, из которых сырье импортируется в Российскую Федерацию | п. 89. (2) Приложение №2 Правил Приказ Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | ||||
| 90. | мероприятия по контролю исходного сырья и исходных материалов на таких предприятиях, как скотобойни, включают определенные элементы системы управления качеством для обеспечения удовлетворительного уровня профессиональной подготовки персонала, прослеживаемости материалов, контроля и стабильности | п. 90. (3) Приложение №2 Правил Приказ Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | ||||
| 91. | предусмотрены мероприятия по контролю исходных материалов или исходного сырья, обеспечивающие предотвращение вмешательств, влияющих на качество указанных материалов или сырья, или, по меньшей мере, предоставляющие информацию о проведении таких мероприятий при продвижении исходных материалов или исходного сырья по производственной цепочке или цепочке поставки | п. 91. (4) Приложение №2 Правил Приказ Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | ||||
| 92. | проводятся постоянные оценки поставщиков исходного сырья и исходных материалов, подтверждающие соблюдение требований контроля исходного сырья и исходных материалов на разных стадиях производства. Производитель имеет полную документацию о расследованиях происшествий, проведенных с тщательностью, соответствующей значимости происшествий. Существуют системы, обеспечивающие проведение эффективных корректирующих и предупреждающих действий | п. 92. (5) Приложение №2 Правил Приказ Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | ||||
| 93. | клетки, ткани и органы, используемые для производства ксеногенных клеточных лекарственных препаратов, получены исключительно от животных, которые содержатся в неволе в условиях отсутствия контакта с другими животными и выращиваются специально для этих целей. Ни в коем случае не допускается использование клеток, тканей и органов диких животных или животных со скотобоен. Также не допускается использование тканей животных-основателей (животный организм, несущий чужеродный ген). Ведется наблюдение и документацию относительно состояния здоровья животных | п. 93. (6) Приложение №2 Правил Приказ Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | ||||
| 94. | при ксеногенной клеточной терапии и обращении ксеногенных лекарственных препаратов соблюдаются требования нормативных правовых актов Российской Федерации, касающиеся поставки и испытаний клеток животных | п. 94. (7) Приложение №2 Правил Приказ Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | ||||
| 95. | для гарантии соответствия поставки исходных материалов существует их описание, включающее необходимые детали, в частности, общепринятое и научное название, происхождение, природу, пределы содержания контаминантов, метод взятия таких материалов. Материалы животного происхождения получены от здоровых животных. Для колоний, которые используются для экстракции аллергенов, существует соответствующая система контроля, обеспечивающая биологическую безопасность. Лекарственные препараты аллергенов хранятся в соответствующих условиях, обеспечивающих их качество | п. 96. (1) Приложение №2 Правил Приказ Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | ||||
| 96. | стадии технологического процесса, включающие предварительную обработку, экстракцию, фильтрацию, диализ, концентрирование или лиофилизацию, детально описаны и валидированы | п. 97. (2) Приложение №2 Правил Приказ Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | ||||
| 97. | процессы модификации, используемые для производства модифицированных экстрактов аллергенов, описаны в соответствующей документации. Промежуточные продукты в технологическом процессе идентифицированы и проконтролированы | п. 98. (3) Приложение №2 Правил Приказ Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | ||||
| 98. | смеси экстрактов аллергенов приготовлены из отдельных экстрактов исходных материалов, полученных из одного источника. Каждый отдельный экстракт определен как отдельная фармацевтическая субстанция | п. 99. (4) Приложение №2 Правил Приказ Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | ||||
| 99. | производитель уделяет особое внимание контролю антигенов биологического происхождения для гарантии их качества, постоянства и отсутствия побочных агентов. Подготовка материалов, используемых для иммунизации животных и хранение таких материалов непосредственно перед иммунизацией производится в соответствии с документально оформленными процедурами | п. 100. (1) Приложение №2 Правил Приказ Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | ||||
| 100. | процедуры иммунизации, исследования крови и отбора крови должны проводятся в соответствии с регистрационным досье | п. 101. (2) Приложение №2 Правил Приказ Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | ||||
| 101. | условия производства лекарственных препаратов из субфрагментов антител и любые дальнейшие модификации соответствуют валидированным и утвержденным параметрам. Если ферменты, используемые при производстве, состоят из нескольких компонентов, обеспечена их стабильность | п. 102. (3) Приложение №2 Правил Приказ Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | ||||
| 102. | при использовании эмбрионов птиц обеспечено здоровье всех стай, используемых для их получения | п. 103. (1) Приложение №2 Правил Приказ Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | ||||
| 103. | проводится валидация целостности контейнеров, используемых для хранения промежуточных продуктов, и времени их хранения | п. 104. (2) Приложение №2 Правил Приказ Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | ||||
| 104. | в зонах, содержащих живые биологические агенты, запрещается открывание сосудов, содержащих инактивированные лекарственные препараты, и отбор проб из них | п. 105. (3) Приложение №2 Правил Приказ Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | ||||
| 105. | последовательность прибавления активных компонентов, адъювантов и вспомогательных веществ в процессе производства промежуточного или готового продукта соответствует технологическим инструкциям | п. 106. (4) Приложение №2 Правил Приказ Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | ||||
| 106. | в случае использования для производства или испытаний микроорганизмов, которым присвоен высший уровень биологической опасности, обеспечены необходимые меры изоляции. Получено документальное подтверждение разрешения на проведение упомянутых мероприятий от соответствующих уполномоченных федеральных органов исполнительной власти. Данная документация в наличии и доступна для проверки | п. 107. (5) Приложение №2 Правил Приказ Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | ||||
| 107. | для обеспечения постоянства свойств лекарственного препарата, содержащего допустимые примеси в определенном диапазоне, соблюдаются валидированные условия технологических процессов при росте клеток, экспрессии белка и очистке. Для лекарственных препаратов, производство которых предусматривает многократные сборы клеток при культивировании, его продолжительность находится в утвержденных пределах | п. 108. (1) Приложение №2 Правил Приказ Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | ||||
| 108. | процессы очистки от нежелательных продуктов, источником которых являются клетки хозяина, в частности от белков, нуклеиновых кислот, углеводов, вирусов и других примесей, проводится в рамках определенных валидированных пределов | п. 109. (2) Приложение №2 Правил Приказ Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | ||||
| 109. | для обеспечения безопасности и качества лекарственного препарата проводятся соответствующие мероприятия контроля в отношении исходных клеток и исходных материалов, используемых для создания гибридомы и (или) линии клеток. Особое внимание уделяется доказательству отсутствия вирусов в лекарственном препарате. Для доказательства пригодности лекарственных препаратов, произведенных на одной и той же технологической основе, возможно использование данных, полученных при испытании одного из них | п. 110. (1) Приложение №2 Правил Приказ Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | ||||
| 110. | проведена проверка того, что критерии на промежуточной и конечной стадиях производственного процесса контролируются и находятся в утвержденных пределах | п. 111. (2) Приложение №2 Правил Приказ Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | ||||
| 111. | производственные условия для приготовления субфрагментов антител и любых других модификаций соответствуют валидированным параметрам | п. 112. (3) Приложение №2 Правил Приказ Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | ||||
| 112. | обеспечение постоянства исходного материала, полученного из трансгенного источника, является более проблематичным, чем при использовании стандартных нетрансгенных биотехнологических источников. Соблюдаются повышенные требования для доказательства постоянства всех свойств лекарственного препарата от серии к серии | п. 113. Приложение №2 Правил Приказ Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | ||||
| 113. | для производства биологических лекарственных препаратов могут использоваться различные виды животных, в том числе могут проводиться взятие и очистка биологических жидкостей (например, молока). Животные имеют четкую и уникальную маркировку, предусмотрены дублирующие меры на случай утраты первичного идентифицирующего маркера | п. 114. (1) Приложение №2 Правил Приказ Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | ||||
| 114. | в условиях содержания и ухода за животными обеспечен наименьший возможный контакт животных с патогенными агентами и зоонозами. Разработаны соответствующие меры защиты окружающей среды. Разработана программа наблюдения за здоровьем животных с соответствующим внесением записей в документацию. Расследованы любые инциденты и определено их влияние на возможность дальнейшего использования животного и ранее полученных серий продукции | п. 115. (2) Приложение №2 Правил Приказ Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | ||||
| 115. | существует документация с родословной от животного-основателя до животных, использующихся для производства. Запрещается смешивание материалов, полученных из разных трансгенных линий животных | п. 116. (3) Приложение №2 Правил Приказ Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | ||||
| 116. | условия, при которых производится взятие материалов, соответствует нормам регистрационного досье и протокола клинических исследований. График взятия материала и условия, при которых животные могут быть исключены из процесса производства лекарственного препарата, соответствует утвержденным процедурам и критериям приемлемости | п. 117. (4) Приложение №2 Правил Приказ Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | ||||
| 117. | соблюдаются повышенные требования для доказательства постоянства всех свойств лекарственного препарата от серии к серии | п. 118. Приложение №2 Правил Приказ Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | ||||
| 118. | контроль стабильности гена проводится на протяжении определенного количества генераций | п. 119. (1) Приложение №2 Правил Приказ Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | ||||
| 119. | для обеспечения постоянства сбора урожая от разных культур растений растения имеется четкая и уникальная маркировка, и указаны их основные характеристики. В частности, состояние здоровья растений, входящих в культуру, контролируется с определенной периодичностью на протяжении периода выращивания | п. 120. (2) Приложение №2 Правил Приказ Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | ||||
| 120. | установлены меры предосторожности для защиты культур. Необходимо минимизировать их контаминацию микробиологическими агентами и перекрестную контаминацию растениями другого вида. Приняты меры для предотвращения контаминации лекарственного препарата такими материалами, как пестициды и удобрения. Разработана программа мониторинга с соответствующим внесением записей в документацию, расследованы любые инциденты и определено их влияние на возможность дальнейшего использования культуры в производственном процессе | п. 121. (3) Приложение №2 Правил Приказ Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | ||||
| 121. | четко описаны условия, определяющие случаи, когда растения могут быть исключены из производственного процесса. Установлены пределы приемлемости для материалов, которые могут помешать процедуре очистки продукции. Подтверждено, что результаты находятся в пределах утвержденных норм | п. 122. (4) Приложение №2 Правил Приказ Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | ||||
| 122. | зафиксированы условия окружающей среды, которые могут повлиять на качественные характеристики лекарственного препарата, а также на производственный выход рекомбинантного белка, начиная от времени посева, на протяжении культивирования и до момента сбора и промежуточного хранения собранных материалов. При оформлении указанной документации соблюдаются требования нормативных правовых актов Российской Федерации, регулирующих вопросы выращивания и сбора растений | п. 123. (5) Приложение №2 Правил Приказ Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | ||||
| 123. | существует документация с родословной от животного-основателя до животных, использующихся для производства. Запрещается смешивание материалов, полученных из разных трансгенных линий животных | п. 116. (3) Приложение №2 Правил Приказ Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | ||||
| 124. | условия, при которых производится взятие материалов, соответствует нормам регистрационного досье и протокола клинических исследований. График взятия материала и условия, при которых животные могут быть исключены из процесса производства лекарственного препарата, соответствует утвержденным процедурам и критериям приемлемости | п. 117. (4) Приложение №2 Правил Приказ Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | ||||
| 125. | соблюдаются повышенные требования для доказательства постоянства всех свойств лекарственного препарата от серии к серии | п. 118. Приложение №2 Правил Приказ Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | ||||
| 126. | контроль стабильности гена проводится на протяжении определенного количества генераций | п. 119. (1) Приложение №2 Правил Приказ Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | ||||
| 127. | для обеспечения постоянства сбора урожая от разных культур растений растения имеется четкая и уникальная маркировка, и указаны их основные характеристики. В частности, состояние здоровья растений, входящих в культуру, контролируется с определенной периодичностью на протяжении периода выращивания | п. 120. (2) Приложение №2 Правил Приказ Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | ||||
| 128. | установлены меры предосторожности для защиты культур. Необходимо минимизировать их контаминацию микробиологическими агентами и перекрестную контаминацию растениями другого вида. Приняты меры для предотвращения контаминации лекарственного препарата такими материалами, как пестициды и удобрения. Разработана программа мониторинга с соответствующим внесением записей в документацию, расследованы любые инциденты и определено их влияние на возможность дальнейшего использования культуры в производственном процессе | п. 121. (3) Приложение №2 Правил Приказ Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | ||||
| 129. | четко описаны условия, определяющие случаи, когда растения могут быть исключены из производственного процесса. Установлены пределы приемлемости для материалов, которые могут помешать процедуре очистки продукции. Подтверждено, что результаты находятся в пределах утвержденных норм | п. 122. (4) Приложение №2 Правил Приказ Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" | ||||
| 130. | зафиксированы условия окружающей среды, которые могут повлиять на качественные характеристики лекарственного препарата, а также на производственный выход рекомбинантного белка, начиная от времени посева, на протяжении культивирования и до момента сбора и промежуточного хранения собранных материалов. При оформлении указанной документации соблюдаются требования нормативных правовых актов Российской Федерации, регулирующих вопросы выращивания и сбора растений | п. 123. (5) Приложение №2 Правил Приказ Минпромторга России от 14.06.2013 № 916 "Об утверждении Правил надлежащей производственной практики" |
Подписи лиц, проводивших проверку:_______________________________________________________________________________________________________________
_____________________________________________________________________________________
_____________________________________________________________________________________
_____________________________________________________________________________________
С результатами проверки ознакомлен(а), копию проверочного листа получил(а):
______________________________________________________________________________________
_____________________________________________________________________________________
_____________________________________________________________________________________
(фамилия, имя, отчество (последнее - при наличии), должность руководителя, иного должностного лица или уполномоченного представителя юридического лица, индивидуального предпринимателя, его уполномоченного представителя)
«____»_____________________ 20____г
(подпись)
Рекомендации по заполнению контрольного листа (списка контрольных вопросов):
в позиции «ДА» проставляется отметка, если предъявляемое требование реализовано в полном объеме;
в позиции «НЕТ» проставляется отметка, если предъявляемое требование не реализовано или реализовано не в полном объеме;
в позиции «Не требуется» проставляется отметка, если предъявляемое требование не подлежит реализации проверяемым субъектом и (или) контролю (надзору) применительно к данному проверяемому субъекту);
в позиции «Примечание» отражаются поясняющие записи, если предъявляемое требование реализовано не в полном объеме, и иные пояснения.
-------------------------------------------
*(1) Используется следующие способы: 1) документарный; 2) визуальный; 3) дополнительные исследования/испытания (при необходимости)
Обзор документа
Планируется утвердить формы проверочных листов (списка контрольных вопросов), используемых территориальными органами Россельхознадзора при проведении плановых проверок в сфере обращения лекарственных средств для ветприменения.
В них отражаются вид госконтроля (надзора), предмет и место проведения плановой проверки юрлиц и ИП, перечень вопросов, отражающих содержание обязательных требований.
Форму проверочного листа можно будет использовать для самопроверки соблюдения обязательных требований.



(1).jpg)


