Решение Коллегии Евразийской экономической комиссии от 30 июня 2017 г. № 78 “О Требованиях к электронному виду заявлений и документов регистрационного досье, представляемых при осуществлении регистрации и экспертизы безопасности, качества и эффективности медицинских изделий” (не вступило в силу)
В соответствии с пунктом 11 Протокола об информационно-коммуникационных технологиях и информационном взаимодействии в рамках Евразийского экономического союза (приложение № 3 к Договору о Евразийском экономическом союзе от 29 мая 2014 года) и Правилами регистрации и экспертизы безопасности, качества и эффективности медицинских изделий, утвержденными Решением Совета Евразийской экономической комиссии от 12 февраля 2016 г. № 46 (далее - Правила регистрации), Коллегия Евразийской экономической комиссии решила:
1. Утвердить прилагаемые Требования к электронному виду заявлений и документов регистрационного досье, представляемых при осуществлении регистрации и экспертизы безопасности, качества и эффективности медицинских изделий (далее - Требования).
2. Установить, что разработка технических схем структур документов в электронном виде, предусмотренных Требованиями, и обеспечение их размещения в реестре структур электронных документов и сведений, опубликованном на официальном сайте Евразийского экономического союза (далее - Союз), осуществляются департаментом Евразийской экономической комиссии, в компетенцию которого входит координация работ по созданию и развитию интегрированной информационной системы Союза.
3. Установить, что при реализации в государствах - членах Союза электронной формы взаимодействия при выполнении процедур согласно Правилам регистрации применяются документы в электронном виде, предусмотренные Требованиями, в соответствии с техническими схемами структур таких документов, содержащимися в реестре структур электронных документов и сведений.
4. Настоящее Решение вступает в силу по истечении 30 календарных дней с даты его официального опубликования.
|
Председатель Коллегии Евразийской экономической комиссии |
Т. Саркисян |
УТВЕРЖДЕНЫ
Решением Коллегии
Евразийской экономической комиссии
от 30 июня 2017 г. № 78
Требования
к электронному виду заявлений и документов регистрационного досье, представляемых при осуществлении регистрации и экспертизы безопасности, качества и эффективности медицинских изделий
I. Общие положения
1. Настоящие Требования разработаны в целях создания равных условий для хозяйствующих субъектов государств - членов Евразийского экономического союза (далее соответственно - государства-члены, Союз) по представлению сведений в электронном виде в уполномоченные органы государств-членов (экспертные организации) при выполнении процедур регистрации и экспертизы безопасности, качества и эффективности медицинских изделий.
2. Понятия, используемые в настоящих Требованиях, применяются в значениях, определенных Протоколом об информационно-коммуникационных технологиях и информационном взаимодействии в рамках Евразийского экономического союза (приложение № 3 к Договору о Евразийском экономическом союзе от 29 мая 2014 года) и Правилами регистрации и экспертизы безопасности, качества и эффективности медицинских изделий, утвержденными Решением Совета Евразийской экономической комиссии от 12 февраля 2016 г. № 46 (далее - Правила регистрации).
3. Настоящие Требования определяют структуру и правила заполнения документов в электронном виде, представляемых заявителем в уполномоченные органы государств-членов при выполнении процедур, предусмотренных Правилами регистрации.
4. Структура документа в электронном виде «Сведения о заявлении на проведение регистрации медицинского изделия в рамках Евразийского экономического союза» (R.018) предназначена для представления в электронном виде следующих видов заявлений:
а) заявление о проведении экспертизы медицинского изделия в рамках Союза - в соответствии с приложением № 2 к Правилам регистрации (далее - заявление об экспертизе);
б) заявление о проведении регистрации медицинского изделия в рамках Союза, представляемого в соответствии с приложением № 3 к Правилам регистрации (далее - заявление о регистрации);
в) заявление о внесении изменений в регистрационное досье медицинского изделия в рамках Союза, представляемого в соответствии с приложением № 7 к Правилам регистрации (далее - заявление об изменении);
г) заявление об отмене (аннулировании) регистрационного удостоверения медицинского изделия, представляемого в соответствии с приложением № 10 к Правилам регистрации (далее - заявление об аннулировании);
д) заявление о выдаче дубликата регистрационного удостоверения медицинского изделия, представляемого в соответствии с приложением № 11 к Правилам регистрации (далее - заявление о выдаче дубликата).
5. Структура документа в электронном виде «Сведения о документах регистрационного досье медицинского изделия или документах, оформленных при рассмотрении регистрационного досье медицинского изделия» (R.020) предназначена для представления в электронном виде документов регистрационного досье медицинского изделия в соответствии с приложениями № 4 и 8 к Правилам регистрации, а также документов, оформленных при рассмотрении регистрационного досье медицинского изделия.
6. Перечень представляемых заявителем в электронном виде документов определяется Правилами регистрации.
7. Указанные в пунктах 4 и 5 настоящих Требований документы в электронном виде формируются в XML-формате в соответствии со стандартом «Extensible Markup Language (XML) 1.0 (Fifth Edition)» (опубликован в информационно-телекоммуникационной сети «Интернет» по адресу: http://www.w3.org/TR/REC-xml).
8. Указанные в пунктах 4 и 5 настоящих Требований cтруктуры документов в электронном виде представляют собой совокупность реквизитов, расположенных в иерархическом виде. Реквизиты структур документов в электронном виде могут включать в себя 1 или несколько вложенных реквизитов.
9. Описание структур документов в электронном виде и правила их заполнения приведены в табличной форме с указанием полного реквизитного состава с учетом уровней иерархии вплоть до простых (атомарных) реквизитов (таблицы 1 - 7 и 10).
10. Для указания обязательности заполнения реквизитов используются следующие обозначения в графе «Множественность» («Мн.») в таблицах 1 - 7 и 10:
0 - реквизит не заполняется;
1 - реквизит обязателен;
0..1 - реквизит опционален, повторения не допускаются;
0..* - реквизит опционален, может повторяться без ограничений;
1..* - реквизит обязателен, может повторяться без ограничений;
n..m - реквизит обязателен, должен повторяться не менее n раз и не более m раз (n > 1, m > n).
11. В графе «Наименование реквизита» указываются наименование реквизита, а также в скобках название соответствующего ему элемента данных в технической схеме структуры документа в электронном виде с указанием префикса пространства имен.
II. Требования к структуре документа в электронном виде «Сведения о заявлении о проведении регистрации медицинского изделия в рамках Евразийского экономического союза» (R.018)
12. Для указания правил заполнения реквизитов в зависимости от вида заявления используются следующие обозначения:
«+» - реквизит может быть заполнен для данного вида заявления в соответствии с его множественностью;
«+ (n..m)» - реквизит может быть заполнен для данного вида заявления и должен повторяться не менее n раз и не более m раз (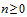 , m > n).
, m > n).
Если обозначение не указано, реквизит не заполняется для данного вида заявления.
13. Состав реквизитов структуры документа в электронном виде «Сведения о заявлении о проведении регистрации медицинского изделия в рамках Евразийского экономического союза» (R.018) и общие правила их заполнения в зависимости от вида заявления приведены в таблице 1.
14. Требования к формированию XML-документов в соответствии со структурой документа в электронном виде «Сведения о заявлении о проведении регистрации медицинского изделия в рамках Евразийского экономического союза» (R.018) приведены в таблице 9.
Таблица 1
Состав
реквизитов структуры документа в электронном виде «Сведения о заявлении о проведении регистрации медицинского изделия в рамках Евразийского экономического союза» (R.018)
| Наименование реквизита | Правило заполнения реквизита | Заявление о регистрации, заявление об экспертизе | Заявление об изменении | Заявление об аннулировании | Заявление о выдаче дубликата | Мн. | ||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1. Код электронного документа (сведений) (csdo:EDocCode) | указывается кодовое обозначение электронного документа (сведений) в соответствии с реестром структур электронных документов и сведений | + | + | + | + | 1 | ||||||
| 2. Идентификатор электронного документа (сведений) (csdo:EDocId) | указывается строка символов, однозначно идентифицирующая электронный документ (сведения) | + | + | + | + | 1 | ||||||
| 3. Идентификатор исходного электронного документа (сведений) (csdo:EDocRefId) | указывается идентификатор электронного документа (сведений), в ответ на который был сформирован данный электронный документ (сведения) | 0..1 | ||||||||||
| 4. Дата и время электронного документа (сведений) (csdo:EDocDateTime) | указываются дата и время создания электронного документа (сведений) | + | + | + | + | 1 | ||||||
| 5. Сведения о заявлении на проведение регистрации медицинского изделия и (или) | указываются сведения о заявлении на проведение регистрации медицинского изделия и (или) | + | + | + | + | 1 | ||||||
| связанных процедур (hccdo:MedicalDeviceApplicationDetails) | связанных с регистрацией процедур | |||||||||||
| 5.1. Номер заявления на регистрацию медицинского изделия (hcsdo:MedicalProductApplicationId) | указывается присвоенный уполномоченным органом референтного государства номер подаваемого заявления в виде строки длиной не более 20 символов без символов разрыва строки, перевода каретки и табуляции по шаблону в соответствии с пунктом 16 Порядка формирования и ведения информационной системы в сфере обращения медицинских изделий, утвержденного Решением Совета Евразийской экономической комиссии от 12 февраля 2016 г. № 30 | 0..1 | ||||||||||
| 5.2. Дата документа (csdo:DocCreationDate) | указывается дата подачи заявления в соответствии с ГОСТ ИСО 8601-2001 | + | + | + | + | 1 | ||||||
| 5.3. Код референтного государства (hcsdo:ReferenceUnifiedCountryCode) | указывается двухбуквенный код референтного государства, в котором предполагается обращение медицинского изделия, из классификатора стран мира в соответствии со стандартом ISO 3166-1 | + | + | + | + | 1 | ||||||
| а) идентификатор справочника (классификатора) (атрибут codeListId) | указывается значение «P.CLS.019» | + | + | + | + | 1 | ||||||
| 5.4. Код государства признания (hcsdo:RecognitionUnifiedCountryCode) | указывается двухбуквенный код государства признания, в котором предполагается обращение медицинского изделия, из классификатора стран мира в соответствии со стандартом ISO 3166-1 | + | + | + | + | 0..* | ||||||
| а) идентификатор справочника (классификатора) (атрибут codeListId) | указывается значение «P.CLS.019» | + | + | + | + | 1 | ||||||
| 5.5. Код вида заявления на проведение регистрации медицинского изделия и (или) связанных процедур (hcsdo:MedicalProductApplicationKindV2Code) | указывается код вида подаваемого заявления в соответствии с классификатором видов документов регистрационного досье медицинского изделия в виде строки длиной не более 10 символов без символов разрыва строки, перевода каретки и табуляции | + | + | + | + | 1 | ||||||
| 5.6. Описание способа получения информации о процедуре регистрации медицинского изделия (hcsdo:InformationObtainingMethodText) | указывается описание способа получения информации, связанной с процедурой регистрации медицинского изделия, в виде строки длиной не более 4 000 символов | + | 0..1 | |||||||||
| 5.7. Код способа получения регистрационного удостоверения на медицинское изделие (hcsdo:ReceptionKindCode) | указывается код способа получения регистрационного удостоверения на медицинское изделие в соответствии с перечнем возможных значений: 01 - на бумажном носителе лично; 02 - на бумажном носителе направить заказным почтовым отправлением с уведомлением о вручении; 03 - в форме электронного документа; 99 - другое | + | 0..1 | |||||||||
| 5.8. Наименование способа получения регистрационного удостоверения на медицинское изделие (hcsdo:ReceptionKindName) | в случае если реквизит «5.7. Код способа получения регистрационного удостоверения на медицинское изделие» заполнен значением «99» - «другое», указывается наименование способа получения регистрационного удостоверения на медицинское изделие в виде строки длиной не более 500 символов без символов разрыва строки, перевода каретки и табуляции | + | 0..1 | |||||||||
| 5.9. Причина обращения заявителя (hcsdo:ReasonText) | указывается описание причины отмены (аннулирования) или причина обращения за дубликатом регистрационного удостоверения медицинского изделия в виде строки длиной не более 4 000 символов | + | + | 1 | ||||||||
| 6. Сведения, подтверждающие оплату пошлины за проведение регистрации медицинского изделия и (или) связанных процедур (hccdo:DutyProofDocDetails) | указываются сведения об оплате пошлин за проведение регистрации медицинского изделия и (или) связанных с регистрацией процедур | + | + | 0..* | ||||||||
| 6.1. Код страны (csdo:UnifiedCountryCode) | указывается двухбуквенный код государства-члена из классификатора стран мира в соответствии со стандартом ISO 3166-1, в которое уплачена пошлина за проведение регистрации медицинского изделия и (или) связанных с регистрацией процедур | + | + | 1 | ||||||||
| а) идентификатор справочника (классификатора) (атрибут codeListId) | указывается значение «P.CLS.019» | + | + | 1 | ||||||||
| 6.2. Код вида пошлины за проведение регистрации медицинского изделия и (или) связанных процедур (hcsdo:DutyKindCode) | указывается код вида пошлины за проведение регистрации медицинского изделия и (или) связанных процедур в соответствии с перечнем возможных значений: 01 - пошлина за экспертизы медицинского изделия; 02 - пошлина за проведение регистрации медицинского изделия; 03 - пошлина за проведение экспертизы изменений в регистрационном досье; 04 - пошлина за выдачу дубликата регистрационного удостоверения медицинского изделия | + | + | 0..1 | ||||||||
| 6.3. Наименование вида пошлины за проведение регистрации медицинского изделия и (или) связанных процедур (hcsdo:DutyKindName) | если реквизит «6.2. Код вида пошлины за проведение регистрации медицинского изделия и (или) связанных процедур» не заполнен, указывается наименование вида пошлины за проведение регистрации медицинского изделия и (или) связанных с регистрацией процедур в виде строки длиной не более 500 символов без символов разрыва строки, перевода каретки и табуляции | + | + | 0..1 | ||||||||
| 6.4. Наименование документа (csdo:DocName) | указывается наименование документа, подтверждающего оплату пошлины за проведение регистрации медицинского изделия и (или) связанных с регистрацией процедур, в виде строки длиной не более 500 символов без символов разрыва строки, перевода каретки и табуляции | + | + | 1 | ||||||||
| 6.5. Номер документа (csdo:DocId) | указывается номер документа, подтверждающего оплату пошлины за проведение регистрации медицинского изделия и (или) связанных с регистрацией процедур, в виде строки длиной не более 50 символов без символов разрыва строки, перевода каретки и табуляции | + | + | 1 | ||||||||
| 6.6. Дата документа (csdo:DocCreationDate) | указывается дата выдачи документа, подтверждающего оплату пошлины за проведение регистрации медицинского изделия и (или) связанных с регистрацией процедур, в соответствии с ГОСТ ИСО 8601-2001 | + | + | 1 | ||||||||
| 7. Сведения о виде вносимого изменения в регистрационное досье медицинского изделия (hccdo:RegistrationDossierAmendingKindDetails) | указываются сведения о вносимом в регистрационное досье медицинского изделия изменении | + | 0..* | |||||||||
| 7.1. Код вида вносимого изменения в регистрационное досье медицинского изделия (hcsdo:RegistrationDossierAmendingKindCode) | указывается код вида изменения, вносимого в регистрационное досье медицинского изделия, из классификатора видов вносимых изменений в регистрационное досье медицинского изделия | + | 0..1 | |||||||||
| 7.2. Наименование вида вносимого изменения в регистрационное досье медицинского изделия (hcsdo:RegistrationDossierAmendingKindName) | если реквизит «7.1. Код вида вносимого изменения в регистрационное досье медицинского изделия» не заполнен, указывается наименование вида изменения, вносимого в регистрационное досье медицинского изделия, в виде строки длиной не более 4 000 символов | + | 0..1 | |||||||||
| 8. Сведения о регистрации медицинского изделия в стране-производителе или другой стране (hccdo:RegistrationDetails) | указываются сведения о регистрации медицинского изделия в стране-производителе или другой стране | + | + | + | + | 0..* | ||||||
| 8.1. Код страны (csdo:UnifiedCountryCode) | указывается двухбуквенный код страны из классификатора стран мира в соответствии со стандартом ISO 3166-1, в котором зарегистрировано медицинское изделие | + | + | + | + | 1..* | ||||||
| а) идентификатор справочника (классификатора) (атрибут codeListId) | указывается значение «P.CLS.019» | + | + | + | + | 1 | ||||||
| 8.2. Номер регистрационного удостоверения (hcsdo:RegistrationCertificateId) | указывается уникальный номер регистрационного удостоверения медицинского изделия | + | + | + | + | 1 | ||||||
| 8.3. Дата документа (csdo:DocCreationDate) | указывается дата выдачи регистрационного удостоверения медицинского изделия в соответствии с ГОСТ ИСО 8601-2001 | + | + | + | + | 1 | ||||||
| 8.4. Срок действия документа (csdo:DocValidityDuration) | указывается продолжительность срока действия регистрационного удостоверения медицинского изделия в соответствии с ГОСТ ИСО 8601-2001 | + | + | + | + | 0..1 | ||||||
| 9. Сведения о регистрируемом медицинском изделии (hccdo:MedicalDeviceRegistrationDetails) | указываются сведения о регистрируемом медицинском изделии. Для заявления о внесении изменений: в заявлении в электронном виде заполняется 2 экземпляра реквизита: в 1 экземпляре значение реквизита «Признак новой редакции сведений заявления» должно соответствовать значению «Сведения заявления не являются новой редакцией», во 2 экземпляре значение реквизита «Признак новой редакции сведений заявления» должно соответствовать значению «Сведения заявления являются новой редакцией» | + (1) | + (1..2) | + (1) | + (1) | 1..2 | ||||||
| 9.1. Признак новой редакции сведений заявления (hcsdo:NewEditionIndicator) | указывается признак, определяющий, являются ли сведения заявления новой редакцией: 1 - сведения заявления являются новой редакцией; 0 - сведения заявления не являются новой редакцией | + | 0..1 | |||||||||
| 9.2. Регистрируемое медицинское изделие (hccdo:RegisteredMedical DeviceDetails) | указываются сведения о регистрируемом медицинском изделии | + | + | + | + | 0..1 | ||||||
| 9.2.1. Наименование медицинского изделия (hcsdo:MedicalProductName) | указывается наименование медицинского изделия в виде строки длиной не более 500 символов без символов разрыва строки, перевода каретки и табуляции | + | + | + | + | 1 | ||||||
| 9.2.2. Описание назначения медицинского изделия (hcsdo:DevicePurposeText) | указываются сведения о назначении медицинского изделия в виде строки длиной не более 4 000 символов | + | + | + | + | 0..1 | ||||||
| 9.2.3. Код области применения медицинского изделия (hcsdo:MedicalProductUsageCode) | указывается код области применения медицинского изделия из классификатора областей применения медицинского изделия | + | + | + | + | 0..1 | ||||||
| 9.2.4. Наименование области применения медицинского изделия (hcsdo:MedicalProductUsageName) | если реквизит «9.2.3. Код области применения медицинского изделия» не заполнен, указывается наименование области применения медицинского изделия в виде строки длиной не более 500 символов без символов разрыва строки, перевода каретки и табуляции | + | + | + | + | 0..1 | ||||||
| 9.2.5. Код класса потенциального риска медицинского изделия (hcsdo:RiskClassCode) | указывается код класса потенциального риска применения медицинского изделия в соответствии с перечнем возможных значений: 1 - низкая степень; 2а - средняя степень; 2б - повышенная степень; 3 - высокая степень | + | + | + | + | 0..1 | ||||||
| 9.2.6. Код вида медицинского изделия (hcsdo:MedicalProductClassificationCode) | указывается значение 6-значного цифрового кода вида медицинского изделия из Номенклатуры медицинских изделий Евразийского экономического союза | + | + | + | + | 0..1 | ||||||
| 9.2.7 Наименование вида медицинского изделия (hcsdo:MedicalProductClassificationName) | указывается наименование вида медицинского изделия из Номенклатуры медицинских изделий Евразийского экономического союза в случае, если не заполнен код вида медицинского изделия в виде строки длиной не более 500 символов | + | + | + | + | 0..1 | ||||||
| 9.2.8. Описание технических и (или) эксплуатационных характеристик медицинского изделия (hcsdo:MedicalProductCharacteristicText) | указываются сведения о технических и (или) эксплуатационных характеристиках медицинского изделия в виде строки длиной не более 4 000 символов | + | 0..1 | |||||||||
| 9.2.9. Код требования стерилизации медицинского изделия (hcsdo:MedicalProduct SterilizationCode) | указывается код требования стерилизации медицинского изделия в соответствии с перечнем возможных значений: 01 - нестерильные медицинские изделия одноразового использования; 02 - стерильные медицинские изделия одноразового использования; 03 - стерилизуемые медицинские изделия многократного применения, стерильность которых обеспечивается как при первом применении, так и при каждом последующем применении с помощью соответствующих методов стерилизации; 04 - нестерильные медицинские изделия многократного применения; 05 - оборудование для стерилизации медицинских изделий | + | + | 0..* | ||||||||
| 9.2.10. Код технологии применения медицинского изделия (hcsdo:MedicalProduct UsageTechnology Code) | указывается код технологии применения медицинского изделия в соответствии с перечнем возможных значений: 01 - неактивные медицинские изделия, функционирование которых не требует источника энергии, за исключением энергии, генерируемой телом человека или силой тяжести (гравитацией); 02 - активные медицинские изделия, для функционирования которых необходимо использование источника энергии, отличной от генерируемой телом человека или силой тяжести (гравитацией); 03 - неактивные имплантируемые медицинские изделия; 04 - активные имплантируемые медицинские изделия; 05 - биомедицинские изделия, включающие такие материалы, как продукты клеточных технологий и тканевой инженерии, биоимплантаты, самодеградирующие биополимеры, тканевые клеи и шовные материалы; 06 - хирургические инструменты, предназначенные для хирургического вмешательства (резания, сверления, пиления, царапанья, скобления, скрепления, раздвигания, скалывания, прокалывания); 07 - протезно-ортопедические изделия; 08 - технические средства реабилитации инвалидов | + | + | 0..* | ||||||||
| 9.2.11. Признак наличия лекарственного средства в составе медицинского изделия (hcsdo:MedicalDrugAvailabilityIndicator) | указывается признак, определяющий наличие лекарственного средства в составе медицинского изделия: 1 - в составе медицинского изделия имеется лекарственное средство; 0 - в составе медицинского изделия отсутствует лекарственное средство | + | 0..1 | |||||||||
| 9.2.12. Сведения о комплектации медицинского изделия (hccdo:MedicalProductSetDetails) | указываются сведения о комплектации медицинского изделия | + | + | + | + | 0..* | ||||||
| 9.2.12.1. Код вида составной части комплектации медицинского изделия (hcsdo:MedicalProductSetKindCode) | указывается код вида составной части комплектации медицинского изделия в соответствии с перечнем видов составных частей медицинских изделий | + | + | + | + | 1 | ||||||
| 9.2.12.2. Наименование модели составной части медицинского изделия (hcsdo:ModelNumberName) | указывается наименование модели составной части медицинского изделия в виде строки длиной не более 500 символов без символов разрыва строки, перевода каретки и табуляции | + | + | + | + | 1 | ||||||
| 9.2.12.3. Сведения о производителе составной части медицинского изделия (hccdo:MedicalProductSetManufacturerDetails) | указываются сведения о производителе составной части медицинского изделия | + | + | 0..1 | ||||||||
| 9.2.12.3.1. Наименование хозяйствующего субъекта (csdo:BusinessEntityName) | указывается наименование производителя составной части медицинского изделия в виде строки длиной не более 500 символов без символов разрыва строки, перевода каретки и табуляции | + | + | 1 | ||||||||
| 9.2.12.3.2. Код страны (csdo:UnifiedCountryCode) | указывается двухбуквенный код страны из классификатора стран мира в соответствии с ISO 3166-1 | + | + | 1 | ||||||||
| а) идентификатор справочника (классификатора) (атрибут codeListId) | указывается значение «P.CLS.019» | + | + | 1 | ||||||||
| 9.2.12.4. Количество составных частей медицинского изделия (hcsdo:MedicalProductSetMeasure) | указывается количество экземпляров составной части в составе медицинского изделия в виде неотрицательного целого числа в десятичной системе счисления | + | + | + | + | 1 | ||||||
| а) единица измерения (атрибут measurementUnitCode) | указывается трехсимвольный код единицы измерения, соответствующий значению «штука» из классификатора единиц измерения | + | + | + | + | 1 | ||||||
| б) идентификатор справочника (классификатора) (атрибут measurementUnitCodeListId) | указывается идентификатор классификатора единиц измерения в системе единой нормативно-справочной информации Союза в виде строки длиной не более 20 символов без символов разрыва строки, перевода каретки и табуляции | + | + | + | + | 1 | ||||||
| 9.2.1.3. Описание показаний к применению (hcsdo:IndicationText) | указывается описание показаний к применению медицинского изделия в виде строки длиной не более 4 000 символов | + | 0..1 | |||||||||
| 9.2.1.4. Описание противопоказания к применению медицинского изделия (hcsdo:ContraindicationText) | указывается описание противопоказаний к применению медицинского изделия в виде строки длиной не более 4 000 символов | + | 0..1 | |||||||||
| 9.2.1.5. Описание побочных эффектов от применения медицинского изделия (hcsdo:ReactionText) | указывается описание побочных эффектов от применения медицинского изделия в виде строки длиной не более 4 000 символов | + | 0..1 | |||||||||
| 9.2.1.6. Срок хранения медицинского изделия (hcsdo:MedicalProductStorageDuration) | указывается продолжительность срока хранения медицинского изделия в соответствии с ГОСТ ИСО 8601-2001 | + | + | 0..1 | ||||||||
| 9.2.1.7. Гарантийный срок эксплуатации медицинского изделия (hcsdo:MedicalProductWarrantyDuration) | указывается продолжительность гарантийного срока эксплуатации медицинского изделия в соответствии с ГОСТ ИСО 8601-2001 | + | + | 0..1 | ||||||||
| 9.2.1.8. Описание условий хранения медицинского изделия (hcsdo:MedicalProductStorageConditionsText) | указывается описание условий хранения медицинского изделия в виде строки длиной не более 4 000 символов | + | + | 0..1 | ||||||||
| 9.3. Сведения о производстве регистрируемого медицинского изделия (hccdo:MedicalDeviceManufacturingDetails) | указываются сведения о производстве медицинского изделия | + | + | + | + | 0..1 | ||||||
| 9.3.1. Код степени участия организации в производстве медицинского изделия (hcsdo:ManufactureParticipationDegreeCode) | указывается код степени участия организации в производстве медицинского изделия в соответствии с перечнем степеней возможных значений: 01 - полностью на данном производстве; 02 - частично на данном производстве; 03 - полностью на другом производстве | + | + | + | + | 0..1 | ||||||
| 9.3.2. Сведения о производителе регистрируемого медицинского изделия (hccdo:MedicalDeviceManufacturerDetails) | указываются сведения о производителе регистрируемого медицинского изделия. Состав реквизитов и правила их заполнения приведены в таблице 2 | + | + | + | + | 1 | ||||||
| 9.3.3. Сведения о производственной площадке регистрируемого медицинского изделия (hccdo:MedicalDeviceManufacturingAreaDetails) | указываются сведения о производственной площадке регистрируемого медицинского изделия. Состав реквизитов и правила их заполнения приведены в таблице 2 | + | + | + | + | 0..* | ||||||
| 9.4. Сведения об уполномоченном представителе производителя медицинских изделий (hccdo:MedicalDeviceRepresentativeDetails) | указываются сведения об уполномоченном представителе производителя регистрируемого медицинского изделия. Состав реквизитов и правила их заполнения приведены в таблице 2 | + | + | + | + | 0..1 | ||||||
| 10. Признак, определяющий роль заявителя (hcsdo:ApplicantRoleIndicator) | указывается признак, определяющий является ли заявителем производитель медицинских изделий: 1 - заявителем является производитель медицинских изделий; 0 - заявителем является уполномоченный представитель производителя медицинских изделий | + | + | + | + | 1 | ||||||
Таблица 2
Описание состава реквизитов «Сведения о производителе регистрируемого медицинского изделия», «Сведения о производственной площадке регистрируемого медицинского изделия» и «Сведения об уполномоченном представителе производителя медицинских изделий»
| Наименование реквизита | Правило заполнения реквизита | Мн. |
|---|---|---|
| 1. Сведения о хозяйствующем субъекте (ccdo:BusinessEntityTypeCode) | состав реквизитов и правила их заполнения приведены в таблице 3 | 0..1 |
| 2. Сведения о разрешительном документе (hccdo:ManufacturePermitDocDetails) | состав реквизитов и правила их заполнения приведены в таблице 6 | 0..1 |
| 3. Сведения о сотруднике организации - производителя медицинских изделий (hccdo:OfficerDetails) | состав реквизитов и правила их заполнения приведены в таблице 7 | 1..* |
Таблица 3
Описание состава реквизита «Сведения о хозяйствующем субъекте»
| Наименование реквизита | Правило заполнения реквизита | Мн. | |
|---|---|---|---|
| 1. Код страны (csdo:UnifiedCountryCode) | указывается код страны хозяйствующего субъекта из классификатора стран мира в соответствии со стандартом ISO 3166-1 | 0..1 | |
| а) идентификатор справочника (классификатора) (атрибут codeListId) | указывается значение «P.CLS.019» | 1 | |
| 2. Наименование хозяйствующего субъекта (csdo:BusinessEntityName) | указывается полное наименование хозяйствующего субъекта в виде строки длиной не более 300 символов без символов разрыва строки, перевода каретки и табуляции | 0..1 | |
| 3. Краткое наименование хозяйствующего субъекта (csdo:BusinessEntityBriefName) | указывается краткое или фирменное наименование хозяйствующего субъекта в виде строки длиной не более 120 символов без символов разрыва строки, перевода каретки и табуляции | 0..1 | |
| 4. Код организационно-правовой формы (csdo:BusinessEntityTypeCode) | указывается код организационно-правовой формы из классификатора организационно-правовых форм в виде строки длиной не более 20 символов без символов разрыва строки, перевода каретки и табуляции | 0..1 | |
| а) идентификатор справочника (классификатора) (атрибут codeListId) | указывается идентификатор классификатора организационно-правовых форм в системе единой нормативно-справочной информации Союза в виде строки длиной не более 20 символов | 1 | |
| 5. Наименование организационно-правовой формы (csdo:BusinessEntityTypeName) | если реквизит «4. Код организационно-правовой формы» не заполнен, указывается наименование организационно-правовой формы организации в виде строки длиной не более 120 символов без символов разрыва строки, перевода каретки и табуляции без символов разрыва строки, перевода каретки и табуляции | 0..1 | |
| 6. Идентификатор хозяйствующего субъекта (csdo:BusinessEntityId) | указывается номер (код) записи по реестру (регистру) хозяйствующего субъекта, присвоенный при государственной регистрации в виде строки длиной не более 20 символов без символов разрыва строки, перевода каретки и табуляции | 0..1 | |
| а) метод идентификации (атрибут kindId) | до включения справочника методов идентификации хозяйствующих субъектов в состав ресурсов системы единой норматично-справочной информации Союза код метода идентификации хозяйствующих субъектов указывается в соответствии перечнем возможных значений: 01 - БИН (бизнес-идентификационный номер Республики Казахстан); 02 - ГРЮЛ (код государственной регистрации юридических лиц Республики Армения); 03 - ОГРН (основной государственный регистрационный номер в Российской Федерации); 04 - ОГРНИП (основной государственный регистрационный номер индивидуального предпринимателя в Российской Федерации); 05 - ОКОГУ ( код Общегосударственного классификатора Республики Беларусь «Органы государственной власти и управления»); 06 - ОКПО (код Общереспубликанского классификатора предприятий и организаций Кыргызской Республики); 07 - ОКЮЛП (код Общегосударственного классификатора Республики Беларусь «Юридические лица и индивидуальные предприниматели») | 1 | |
| 7. Уникальный идентификационный таможенный номер (csdo:UniqueCustomsNumberId) | указывается уникальный идентификационный номер хозяйствующего субъекта, предназначенный для целей таможенного контроля в виде строки длиной не более 17 символов без символов разрыва строки, перевода каретки и табуляции | 0..1 | |
| 8. Идентификатор налогоплательщика (csdo:TaxpayerId) | указывается идентификатор хозяйствующего субъекта в реестре налогоплательщиков страны регистрации налогоплательщика в виде строки длиной не более 20 символов без символов разрыва строки, перевода каретки и табуляции | 0..1 | |
| 9. Код причины постановки на учет (csdo:TaxRegistrationReasonCode) | указывается 9-символьный цифровой код, идентифицирующий причину постановки хозяйствующего субъекта на налоговый учет в Российской Федерации | 0..1 | |
| 10. Адрес (ccdo:SubjectAddressDetails) | состав реквизитов и правила их заполнения приведены в таблице 4 | 0..* | |
| 11. Контактный реквизит (ccdo:CommunicationDetails) | состав реквизитов и правила их заполнения приведены в таблице 5 | 0..* | |
Таблица 4
Описание состава реквизита «Адрес»
| Наименование реквизита | Правило заполнения реквизита | Мн. | |
|---|---|---|---|
| 1. Код вида адреса (csdo:AddressKindCode) | указывается код вида адреса из классификатора видов адресов в соответствии с перечнем возможных значений: 01 - адрес регистрации; 02 - фактический адрес; 03 - почтовый адрес | 0..1 | |
| 2. Код страны (csdo:UnifiedCountryCode) | указывается двухбуквенный код страны из классификатора стран мира в соответствии со стандартом ISO 3166-1 | 0..1 | |
| а) идентификатор справочника (классификатора) (атрибут codeListId) | указывается значение «P.CLS.019» | 1 | |
| 3. Код территории (csdo:TerritoryCode) | указывается код единицы административно-территориального деления в виде строки длиной не более 17 символов без символов разрыва строки, перевода каретки и табуляции | 0..1 | |
| 4. Регион (csdo:RegionName) | указывается наименование региона в виде строки длиной не более 120 символов без символов разрыва строки, перевода каретки и табуляции | 0..1 | |
| 5. Район (csdo:DistrictName) | указывается наименование района в виде строки длиной не более 120 символов без символов разрыва строки, перевода каретки и табуляции | 0..1 | |
| 6. Город (csdo:CityName) | указывается наименование города в виде строки длиной не более 120 символов без символов разрыва строки, перевода каретки и табуляции | 0..1 | |
| 7. Населенный пункт (csdo:SettlementName) | в случае если реквизит «6. Город» не заполнен указывается наименование населенного пункта в виде строки длиной не более 120 символов без символов разрыва строки, перевода каретки и табуляции | 0..1 | |
| 8. Улица (csdo:StreetName) | указывается наименование улицы в виде строки длиной не более 120 символов без символов разрыва строки, перевода каретки и табуляции | 0..1 | |
| 9. Номер дома (csdo:BuildingNumberId) | указывается обозначение дома, корпуса, строения в виде строки длиной не более 50 символов без символов разрыва строки, перевода каретки и табуляции | 0..1 | |
| 10. Номер помещения (csdo:RoomNumberId) | указывается обозначение офиса или квартиры в виде строки длиной не более 20 символов без символов разрыва строки, перевода каретки и табуляции | 0..1 | |
| 11. Почтовый индекс (csdo:PostCode) | указывается почтовый индекс предприятия почтовой связи в виде строки, состоящей из заглавных букв латинского алфавита или цифр, которые могут разделяться дефисом, без символов разрыва строки, перевода каретки и табуляции | 0..1 | |
| 12. Номер абонентского ящика (csdo:PostOfficeBoxId) | указывается номер абонентского ящика на предприятии почтовой связи в виде строки длиной не более 20 символов без символов разрыва строки, перевода каретки и табуляции | 0..1 | |
Таблица 5
Описание состава реквизита «Контактный реквизит»
| Наименование реквизита | Правило заполнения реквизита | Мн. |
|---|---|---|
| 1. Код вида связи (csdo:CommunicationChannelCode) | указывается код одного из видов связи («электронная почта», «телефакс», «телефон») в соответствии с перечнем возможных значений: AO - адрес сайта в информационно-телекоммуникационной сети Интернет; EM - электронная почта; FX - телефакс; TE - телефон; TG - телеграф; TL - телекс | 0..1 |
| 2. Наименование вида связи (csdo:CommunicationChannelName) | если реквизит «1. Код вида связи» не заполнен, указывается наименование одного из видов связи («электронная почта», «телефакс», «телефон» и др.) в виде строки длиной не более 120 символов без символов разрыва строки, перевода каретки и табуляции | 0..1 |
| 3. Идентификатор канала связи (csdo:CommunicationChannelId) | указывается номер телефона, номер факса или адрес электронной почты в зависимости от указанного вида связи в виде строки длиной не более 1 000 символов без символов разрыва строки, перевода каретки и табуляции | 1..* |
Таблица 6
Описание состава реквизита «Сведения о разрешительном документе»
| Наименование реквизита | Правило заполнения реквизита | Мн. |
|---|---|---|
| 1. Наименование документа (csdo:DocName) | указывается наименование разрешительного документа в виде строки длиной не более 500 символов без символов разрыва строки, перевода каретки и табуляции | 1 |
| 2. Номер документа (csdo:DocId) | указывается номер разрешительного документа в виде строки длиной не более 50 символов без символов разрыва строки, перевода каретки и табуляции | 1 |
| 3. Дата документа (csdo:DocCreationDate) | указывается дата выдачи разрешительного документа в соответствии с ГОСТ ИСО 8601-2001 | 1 |
| 4. Срок действия документа (csdo:DocValidityDuration) | указывается срок действия разрешительного документа в соответствии с ГОСТ ИСО 8601-2001 | 1 |
Таблица 7
Описание состава реквизита «Сведения о сотруднике»
| Наименование реквизита | Правило заполнения реквизита | Мн. | |
|---|---|---|---|
| 1. ФИО (ccdo:FullNameDetails) | указываются фамилия, имя и отчество сотрудника | 1 | |
| 1.1. Имя (csdo:FirstName) | указывается имя сотрудника в виде строки длиной не более 120 символов без символов разрыва строки, перевода каретки и табуляции | 0..1 | |
| 1.2. Отчество (csdo:MiddleName) | указывается отчество сотрудника в виде строки длиной не более 120 символов без символов разрыва строки, перевода каретки и табуляции | 0..1 | |
| 1.3. Фамилия (csdo:LastName) | указывается фамилия сотрудника в виде строки длиной не более 120 символов без символов разрыва строки, перевода каретки и табуляции | 0..1 | |
| 2. Код страны (csdo:UnifiedCountryCode) | указывается двухбуквенный код страны из классификатора стран мира в соответствии со стандартом ISO 3166-1 | 1 | |
| а) идентификатор справочника (классификатора) (атрибут codeListId) | указывается значение «P.CLS.019» | 1 | |
| 3. Код должности (hcsdo:PositionCode) | указывается код должности из классификатора должностей служащих в виде строки длиной не более 10 символов без символов разрыва строки, перевода каретки и табуляции | 0..1 | |
| 4. Наименование должности (csdo:PositionName) | в случае если реквизит «3. Код должности» не заполнен, указывается наименование должности в виде строки длиной не более 120 символов без символов разрыва строки, перевода каретки и табуляции | 0..1 | |
| 5. Контактный реквизит (ccdo:CommunicationDetails) | состав реквизитов и правила их заполнения приведены в таблице 5 | 0..* | |
Таблица 8
Требования к формированию XML-документов в соответствии со структурой документа в электронном виде «Сведения о заявлении на проведение регистрации медицинского изделия в рамках Евразийского экономического союза» (R.018)
| № п/п | Обозначение элемента | Описание |
|---|---|---|
| 1 | 2 | 3 |
| 1 | Код используемой для формирования XML-документа структуры электронных документов (сведений) в реестре структур электронных документов и сведений | R.018 |
| 2 | Используемая версия структуры электронных документов (сведений) | 1.0.0 |
| 3 | Корневой элемент XML-документа | MedicalProductApplicationDetails |
| 4 | Идентификатор пространства имен XML-документа | urn:EEC:R:MedicalProductApplicationDetails:v1.0.0 |
| 5 | Имя файла XML-схемы | EEC_R_MedicalProductApplicationDetails _v1.0.0.xsd |
| 6 | Импортируемые пространства имен | перечень импортируемых пространств имен приведен в таблице 9. Символы «X.X.X» в импортируемых пространствах имен соответствуют номерам версий базисной модели данных и модели данных предметной области, использованных при разработке схем структуры электронного документа (сведений) в соответствии с пунктом 2 Решения Коллегии Евразийской экономической комиссии от 30 июня 2017 г. № 78 |
Таблица 9
Импортируемые пространства имен
| № п/п | Идентификатор пространства имен | Префикс |
|---|---|---|
| 1 | 2 | 3 |
| 1 | urn:EEC:M:ComplexDataObjects:vX.X.X | ccdo |
| 2 | urn:EEC:M:HC:ComplexDataObjects:vX.X.X | hccdo |
| 3 | urn:EEC:M:HC:SimpleDataObjects:vX.X.X | hcsdo |
| 4 | urn:EEC:M:SimpleDataObjects:vX.X.X | csdo |
III. Требования к структуре документа в электронном виде «Сведения о документах регистрационного досье медицинского изделия или документах, оформленных при рассмотрении регистрационного досье медицинского изделия» (R.020)
15. Состав реквизитов и общие требования к заполнению реквизитов структуры документа в электронном виде «Сведения о документах регистрационного досье медицинского изделия или документах, оформленных при рассмотрении регистрационного досье медицинского изделия» (R.020) приведены в таблице 10.
16. При представлении в электронном виде документов регистрационного досье, для которых не определены требования к структуре, включенный в состав структуры файл в формате *.pdf должен содержать текстовый слой.
17. Требования к формированию XML-документа в соответствии со структурой документа в электронном виде «Сведения о документах регистрационного досье медицинского изделия или документах, оформленных при рассмотрении регистрационного досье медицинского изделия» (R.020) приведены в таблице 11.
Таблица 10
Описание состава реквизитов структуры документа в электронном виде «Сведения о документах регистрационного досье медицинского изделия или документах, оформленных при рассмотрении регистрационного досье медицинского изделия» (R.020)
| Наименование реквизита | Правило заполнения реквизита | Мн. | ||
|---|---|---|---|---|
| 1. Код электронного документа (сведений) (csdo:EDocCode) | указывается кодовое обозначение электронного документа (сведений) в соответствии с реестром структур электронных документов и сведений | 1 | ||
| 2. Идентификатор электронного документа (сведений) (csdo:EDocId) | указывается строка символов, однозначно идентифицирующая электронный документ (сведения) | 1 | ||
| 3. Идентификатор исходного электронного документа (сведений) (csdo:EDocRefId) | указывается идентификатор электронного документа (сведений), в ответ на который был сформирован данный электронный документ (сведения) | 0..1 | ||
| 4. Дата и время электронного документа (сведений) (csdo:EDocDateTime) | указывается дата и время создания электронного документа (сведений) | 1 | ||
| 5. Код страны (csdo:UnifiedCountryCode) | указывается двухбуквенный код страны, направившей документ, из классификатора стран мира в соответствии со стандартом ISO 3166-1 | 1 | ||
| а) идентификатор справочника (классификатора) (атрибут codeListId) | указывается значение «P.CLS.019» | 1 | ||
| 6. Номер заявления на регистрацию медицинского изделия (hcsdo:MedicalProductApplicationId) | указывается присвоенный уполномоченным органом референтного государства номер заявления о регистрации или проведении иных процедур, связанных с регистрацией медицинского изделия, в виде строки длиной не более 20 символов без символов разрыва строки, перевода каретки и табуляции по шаблону в соответствии с пунктом 16 Порядка формирования и ведения информационной системы в сфере обращения медицинских изделий, утвержденного Решением Совета Евразийской экономической комиссии от 12 февраля 2016 г. № 30 | 0..1 | ||
| 7. Номер регистрационного удостоверения (hcsdo:RegistrationCertificateId) | указывается номер регистрационного удостоверения в виде строки длиной не более 50 символов без символов разрыва строки, перевода каретки и табуляции | 0..1 | ||
| 8. Сведения о документе, оформленном при рассмотрении регистрационного досье на медицинское изделие, или документа, содержащегося в регистрационном досье на медицинское изделие (hccdo:MedicalProductRegistrationDossierDetails) | указываются сведения о документе, оформленном при рассмотрении регистрационного досье на медицинское изделие, или документа, содержащегося в регистрационном досье на медицинское изделие. Реквизит состоит из значений вложенных реквизитов, указанных в пунктах 8.1 - 8.11 настоящей таблицы | 1..* | ||
| 8.1. Признак принадлежности документа к регистрационному досье (hcsdo:MedicalRegistrationFileIndicator) | указывается признак, определяющий принадлежность документа к регистрационному досье: 1 - документ регистрационного досье; 0 - документ, оформляемый при рассмотрении регистрационного досье | 0..1 | ||
| 8.2. Номер документа (csdo:DocId) | указывается номер документа регистрационного досье или документа, оформленного при рассмотрении регистрационного досье, в виде строки длиной не более 50 символов без символов разрыва строки, перевода каретки и табуляции | 0..1 | ||
| 8.3. Наименование документа (csdo:DocName) | указывается наименование документа регистрационного досье или документа, оформленного при рассмотрении регистрационного досье, в виде строки длиной не более 500 символов без символов разрыва строки, перевода каретки и табуляции | 0..1 | ||
| 8.4. Код вида документа, содержащегося в регистрационном досье на медицинское изделие (hcsdo:MedicalProductRegistrationDocCode) | указывается код вида документа регистрационного досье на медицинское изделие из классификатора видов документов регистрационного досье на медицинское изделие в виде строки длиной не более 10 символов без символов разрыва строки, перевода каретки и табуляции | 0..1 | ||
| 8.5. Наименование вида документа, содержащегося в регистрационном досье на медицинское изделие (hcsdo:MedicalProductRegistrationDocName) | если реквизит «8.4. Код вида документа регистрационного досье на медицинское изделие» не заполнен, указывается наименование вида документа регистрационного досье на медицинское изделие в виде строки длиной не более 500 символов без символов разрыва строки, перевода каретки и табуляции | 0..1 | ||
| 8.6. Код вида документа, оформленного при рассмотрении регистрационного досье на медицинское изделие (hcsdo:MedicalProductRegistrationFileCode) | указывается код вида документа регистрационного досье на медицинское изделие из классификатора видов документов, оформляемых при рассмотрении регистрационного досье, в виде строки длиной не более 10 символов без символов разрыва строки, перевода каретки и табуляции | 0..1 | ||
| 8.7. Наименование вида документа, оформленного при рассмотрении регистрационного досье на медицинское изделие (hcsdo:MedicalProductRegistrationFileName) | если реквизит «8.6. Код вида документа, оформленного при рассмотрении регистрационного досье на медицинское изделие» не заполнен, указывается наименование наименование вида документа, оформляемого при рассмотрении регистрационного досье на медицинское изделие, в виде строки длиной не более 500 символов без символов разрыва строки, перевода каретки и табуляции | 0..1 | ||
| 8.8. Дата документа (csdo:DocCreationDate) | указывается дата выдачи документа регистрационного досье или документа, оформленного при рассмотрении регистрационного досье, в соответствии с ГОСТ ИСО 8601-2001 | 1 | ||
| 8.9. Дата истечения срока действия документа (csdo:DocValidityDate) | указывается дата истечения срока действия документа регистрационного досье или документа, оформленного при рассмотрении регистрационного досье, в соответствии с ГОСТ ИСО 8601-2001 | 0..1 | ||
| 8.10. Наименование хозяйствующего субъекта (csdo:BusinessEntityName) | указывается наименование организации, выдавшей документ регистрационного досье или документа, оформленного при рассмотрении регистрационного досье, в виде строки длиной не более 300 символов без символов разрыва строки, перевода каретки и табуляции | 0..1 | ||
| 8.11. Описание элемента документа регистрационного досье или документа, оформленного при рассмотрении регистрационного досье (hcsdo:MedicalAttributeEnumText) | указывается описание дополнительного признака документа регистрационного досье или документа, оформленного при рассмотрении регистрационного досье, в виде строки длиной не более 4 000 символов | 0..* | ||
| а) код вида элемента документа регистрационного досье или документа, оформленного при рассмотрении регистрационного досье (атрибут MedicalAttributeKindEnumCode) | указывается кодовое обозначение вида дополнительного признака документа регистрационного досье или документа, оформленного при рассмотрении регистрационного досье, в соответствии с перечнем возможных значений: 01 - срок ответа на запрос; 02 - номер документа основания; 03 - вид документа регистрационного досье, в отношении которого направляется запрос; 04 - вид документа, оформленного при рассмотрении регистрационного досье, в отношении которого направляется запрос; 05 - путь к файлу в структуре досье; 06 - имя заменяемого файла; 99 - другое | 0..1 | ||
| б) наименование вида элемента документа (атрибут AttributeKindName) | если реквизит «а) код вида элемента документа» не заполнен, указывается наименование вида дополнительного признака документа регистрационного досье или документа, оформленного при рассмотрении регистрационного досье, в виде строки символов длиной не более 500 символов без символов разрыва строки, перевода каретки и табуляции | 0..1 | ||
| 8.12. Документ в бинарном формате (hcsdo:DocCopyBinaryText) | указывается документ регистрационного досье или документ, оформленный при рассмотрении регистрационного досье, в виде файла в формате *.pdf (сканированная копия), для которого не определены требования к электронному виду, в виде последовательности двоичных октетов (байтов). Заполняется обязательно, если не заполнен реквизит «8.11. Документ в формате XML» | 0..1 | ||
| а) код формата данных (атрибут mediaTypeCode) | указывается кодовое обозначение вида формата данных «*.pdf» | 1 | ||
| 8.13. Документ в формате XML (ccdo:AnyDetails) | указывается документ регистрационного досье или документ, оформленный при рассмотрении регистрационного досье, в формате XML, для которого определены требования к электронному виду, в виде последовательности двоичных октетов (байтов). Заполняется обязательно, если не заполнен реквизит «8.13. PDF-документ» | 0..1 | ||
| 8.13.1. XML-документ | указывается XML-документ произвольной структуры | 1..* | ||
| 9. Примечание (csdo:NoteText) | указывается дополнительный поясняющий текст в виде строки длиной не более 4 000 символов | 0..1 | ||
Таблица 11
Требования к формированию XML-документа в соответствии со структурой документа в электронном виде «Сведения о документах регистрационного досье медицинского изделия или документах, оформленных при рассмотрении регистрационного досье медицинского изделия» (R.020)
| № п/п | Обозначение элемента | Описание |
|---|---|---|
| 1 | 2 | 3 |
| 1 | Код используемой для формирования XML-документа структуры электронных документов (сведений) в реестре структур электронных документов и сведений | R.020 |
| 2 | Используемая версия структуры электронных документов (сведений) | 1.0.0 |
| 3 | Корневой элемент XML-документа | MedicalProductRegistrationDocumentDetails |
| 4 | Идентификатор пространства имен XML-документа | urn:EEC:R: MedicalProductRegistrationDocumentDetails:v1.0.0 |
| 5 | Имя файла XML-схемы | EEC_R_MedicalProductRegistrationDocumentDetails _v1.0.0.xsd |
| 6 | Импортируемые пространства имен | перечень импортируемых пространств имен приведен в таблице 12. Символы «X.X.X» в импортируемых пространствах имен соответствуют номерам версий базисной модели данных и модели данных предметной области, использованных при разработке схем структуры электронного документа (сведений) в соответствии с пунктом 2 Решения Коллегии Евразийской экономической комиссии от 30 июня 2017 г. № 78 |
Таблица 12
Импортируемые пространства имен
| № п/п | Идентификатор пространства имен | Префикс |
|---|---|---|
| 1 | 2 | 3 |
| 1 | urn:EEC:M:ComplexDataObjects:vX.X.X | ccdo |
| 2 | urn:EEC:M:HC:ComplexDataObjects:vX.X.X | hccdo |
| 3 | urn:EEC:M:HC:SimpleDataObjects:vX.X.X | hcsdo |
| 4 | urn:EEC:M:SimpleDataObjects:vX.X.X | csdo |
Обзор документа
Установлены требования к электронному виду заявлений и документов регистрационного досье, представляемых при регистрации и проведении экспертизы безопасности, качества и эффективности медизделий в рамках ЕЭАС.
Определены структура и правила заполнения следующих документов. Это заявления о проведении экспертизы медизделия, его регистрации, внесении изменений в регистрационное досье, отмене (аннулировании) регистрационного удостоверения, выдаче его дубликата. Также это документы регистрационного досье медизделия и документы, оформленные при его рассмотрении.
Решение вступает в силу через 30 календарных дней с даты его официального опубликования.



(1).jpg)


