Приказ Министерства сельского хозяйства РФ от 10 января 2017 г. N 2 "Об утверждении методических рекомендаций по детекции и идентификации специфических последовательностей ДНК генно-инженерно-модифицированных организмов методом полимеразной цепной реакции в режиме реального времени в матричном формате"
В целях реализации статьи 21 Федерального закона от 17 декабря 1997 г. N 149-ФЗ "О семеноводстве" (Собрание законодательства Российской Федерации, 1997, N 51, ст. 5715; 2016, N 27, ст. 4291) и поручения Президента Российской Федерации В.В. Путина от 22 июня 2016 г. N Пр-1178, приказываю:
1. Утвердить прилагаемые методические рекомендации по детекции и идентификации специфических последовательностей ДНК генно-инженерно-модифицированных организмов методом полимеразной цепной реакции в режиме реального времени в матричном формате (далее - методические рекомендации).
2. ФГБУ "Госсорткомиссия" проводить экспертизу на наличие генно-инженерных конструкций в сортах сельскохозяйственных растений, заявляемых на проведение государственных испытаний и использовать методические рекомендации в работе.
3. Контроль за исполнением настоящего приказа возложить на Первого заместителя Министра сельского хозяйства Российской Федерации Д.Х. Хатуова.
| Министр | А.Н. Ткачев |
Методические рекомендации
по детекции и идентификации специфических последовательностей ДНК генно-инженерно-модифицированных организмов методом полимеразной цепной реакции в режиме реального времени в матричном формате
(утв. приказом Министерства сельского хозяйства РФ от 10 января 2017 г. N 2)
1. Настоящие методические рекомендации разработаны с целью выявления генно-инженерно-модифицированных организмов (далее - ГМО) в тканях растений, растительном сырье и продуктах его переработки методом полимеразной цепной реакции (далее - ПЦР) в режиме реального времени в матричном формате.
2. Назначение и область применения ПЦР-матриц:
2.1. Назначение ПЦР-матриц
Микроматрицы (ПЦР-матрицы) с иммобилизованными реактивами предназначены для выявления специфических последовательностей ДНК генно-инженерно-модифицированных организмов в тканях растений (семена, плоды, корнеплоды, зеленая масса), растительном сырье и продуктах его переработки. Детекция и идентификация осуществляется методом ПЦР с гибридизационно-флуоресцентной детекцией продуктов ПЦР в режиме реального времени с использованием амплификатора нуклеиновых кислот "АриаДНА" или аналогичных.
2.2. Генетические элементы, определяемые с помощью ПЦР-матриц
Перечень тест-систем, для выявления специфичных для ГМО генетических элементов и определения видовой принадлежности образца, приведен в приложении N 1 к настоящим методическим рекомендациям.
Тест-системы могут быть иммобилизованы в ячейках ПЦР-матрицы в произвольном порядке. Схема ПЦР-матрицы описана в сопроводительной документации к каждому набору матриц.
Пример схемы ПЦР-матрицы приведен в приложении N 2 к настоящим методическим рекомендациям.
3. Оборудование и материалы
3.1. Используемое оборудование:
а) амплификатор нуклеиновых кислот в реальном времени, обеспечивающий проведение термоциклирования в микрореакторах, объемом до 1,5 мкл ("АриаДНА", Люмэкс-маркетинг, Россия или аналогичный);
б) ламинарный бокс или бокс для ПЦР со встроенной системой УФ-облучения;
в) спектрофотометр с рабочими длинами волн 260, 280 нм;
г) холодильник бытовой электрический, с температурой морозильной камеры минус 20°С;
д) микроцентрифуга настольная под пробирки вместимостью 1,5 мл, скорость вращения не менее 13000 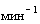 ;
;
е) аппарат для встряхивания типа "Вортекс" или микроцентрифугавортекс, скорость вращения до 3000 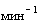 ;
;
ж) термостат твердотельный под одноразовые конические полипропиленовые пробирки с крышкой вместимостью 0,5 и 1,5 мл, диапазон поддерживаемых температур от 15°С до 120°С, количество гнезд - не менее 20 каждого типа, точность поддержания температуры - 0,2°С, разность температур между соседними ячейками - не более 0,5°С;
з) весы лабораторные общего назначения 2-го класса точности с наибольшим пределом взвешивания 200 г;
и) гомогенизатор лабораторный;
к) облучатель бактерицидный настенный;
л) дозаторы механические с переменным объёмом дозирования: 0,2-2,5 мкл с шагом 0,01 мкл; 0,5-10,0 мкл с шагом 0,01 мкл; 2-20 мкл с шагом 0,01 мкл; 20-200 мкл с шагом 0,1 мкл; 100-1000 мкл с шагом 1 мкл; 2-10 мл с шагом 0,1 мл;
м) дозатор электронный с переменным объемом дозирования 0,5-10,0 мкл, обеспечивающий функцию диспенсирования (повторного дозирования);
н) штативы для микропробирок объемом 0,5 мл и 1,5 мл.
3.2. Расходные материалы и реактивы
а) пробирки одноразовые конические полипропиленовые микроцентрифужные вместимостью 0,2; 0,5; 1,5 мл;
б) наконечники одноразовые с фильтром для дозаторов с переменным объёмом дозирования до: 10; 20; 200; 1000 мкл;
в) микроматрицы (ПЦР-матрицы) с иммобилизованными реактивами, предподготовленные для детекции и идентификации ГМО в том числе в их смесях (ГенБит, Россия). Также могут использоваться ПЦР-матрицы для скрининговых исследований и специализированные ПЦР-матрицы для конкретных видов растений;
г) буферный раствор для ПЦР с 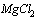 , концентрированный (10х);
, концентрированный (10х);
д) вода деионизированная;
е) герметизирующая жидкость для предотвращения испарения реакционной смеси в процессе термоциклирования;
ж) набор реактивов для выделения ДНК;
з) перчатки медицинские одноразовые, неопудренные.
4. Отбор образца семян для проведения анализа
Материал для анализа должен быть получен из достоверного, репрезентативного источника. Образец семян сельскохозяйственных культур отбирается в соответствии с ГОСТом согласно приложению N 3 к настоящим методическим рекомендациям.
5. Порядок подготовки проб для проведения анализа методом ПЦР
Материалом для проведения ПЦР в режиме реального времени служат пробы ДНК, полученные из образцов семян, растительного материала, продуктов питания, продовольственного сырья, кормов и других источников.
5.1. Выделение ДНК из образцов
Выделение ДНК осуществляется в соответствии с инструкцией по применению к используемому набору реактивов для выделения. Полученный препарат очищенной ДНК следует хранить при +4°С (кратковременное хранение, не более 6 часов) или в морозильной камере при -20°С (длительное хранение, до 6 месяцев).
Образец ДНК считается пригодным для анализа, если не содержит значительного количества примесей-ингибиторов ПЦР. Критерием оценки чистоты раствора ДНК следует считать следующее соотношение:
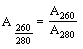
где 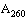 - коэффициент поглощения раствора ДНК при длине волны 260 нм;
- коэффициент поглощения раствора ДНК при длине волны 260 нм;
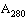 - коэффициент поглощения раствора ДНК при длине волны 280 нм.
- коэффициент поглощения раствора ДНК при длине волны 280 нм.
Образец ДНК считается пригодным для анализа, если 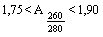 .
.
6. Процедура проведения анализа
6.1. Подготовка ПЦР-матрицы
6.1.1 Перед использованием микроматрицы, необходимо убедиться в ее целостности, наличии штрихкода и отсутствии трещин и сколов в реакционной зоне и на рабочей поверхности. Запрещено касаться реакционной зоны пальцами.
6.1.2 Аккуратно удалить защитную пленку с микроматрицы. Следить за сохранностью штрихкода.
6.1.3 Вставить микроматрицу в картридж. Все манипуляции по введению растворов в микрореакторы проводить только в картридже.
6.1.4 Перед проведением анализа реакционную зону микроматрицы покрыть герметизирующей жидкостью в объеме 620 мкл для избежания испарения реакционной смеси во время термоциклирования. Герметизирующая жидкость должна покрывать всю реакционную зону однородным слоем, недопустимо образование пузырьков на поверхности жидкости.
После герметизации микроматрицы все дальнейшие манипуляции с картриджем должны обеспечивать ее горизонтальное расположение. Необходимо следить, чтобы герметизирующая жидкость не вытекала за пределы реакционной зоны через края подложки.
6.2. Подготовка проб
6.2.1. Отобрать и промаркировать микропробирки в соответствии с количеством анализируемых образцов и схемой ПЦР-матрицы.
6.2.2. В пробирки внести по (N х 0,15) мкл буферного раствора и по (N х 1,35) мкл очищенного препарата ДНК, где N - количество реакций (микрореакторов), в которых будет производиться анализ каждого из образцов.
6.2.2.1. В случае, если имеющегося объема препарата ДНК недостаточно для приготовления рабочей смеси, допускается разбавление раствора ДНК деионизованной водой в соотношении "ДНК:деионизованная вода" не более 1:2 (v/v).
6.2.3. В случае, если схема микроматрицы предполагает проведение контрольных реакций ПЦР, в отдельную пробирку внести по (N x 0,15) мкл буферного раствора и по (N x 1,35) мкл деионизованной воды, где N - количество контрольных реакций (микрореакторов) ПЦР.
6.2.4. Полученные смеси тщательно перемешать, капли со стенок пробирок осадить кратким центрифугированием на центрифуге/вортексе (3 с).
6.2.5. В соответствии с топологией микроматрицы ввести смеси с образцами, подготовленными согласно подпункту 6.2.2., в соответствующие микрореакторы в объеме 1,2 мкл под слой герметизирующей жидкости (Рис. 1). Для этого наконечник с реакционной смесью погрузить под слой герметизирующей жидкости, подвести как можно ближе ко дну микрореактора и осторожно выдавить заранее определенный объем смеси в микрореактор. Реакционная зона ПЦР-матрицы имеет специальное покрытие, обеспечивающее попадание капли в микрореактор за счет гидрофобных взаимодействий.
Аналогично в микрореакторы для контрольных реакций ввести смесь, подготовленную согласно подпункту 6.2.3.
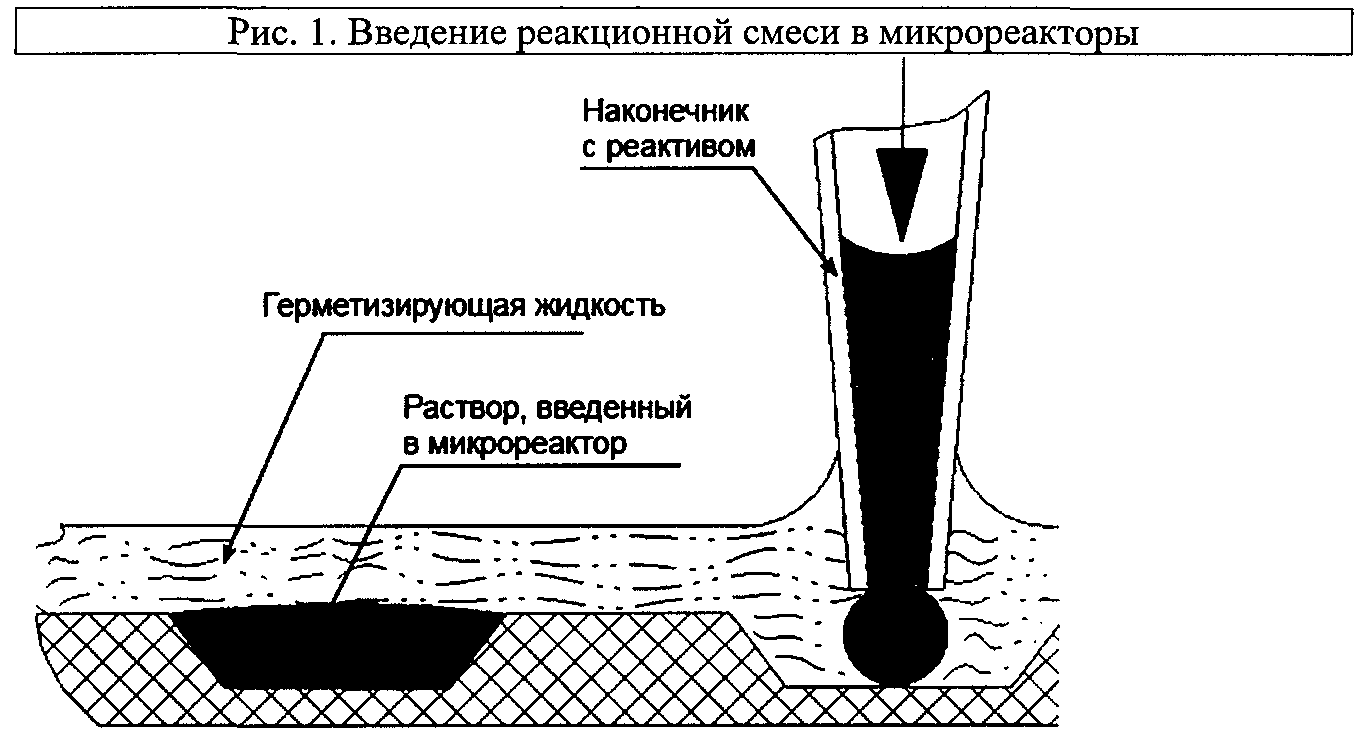
6.3. Проведение амплификации с детекцией в режиме реального времени
Управление амплификатором "АриаДНА", в том числе и проведение анализа образцов, осуществляется при помощи программного обеспечения "Ariadna". Полная информация о проведении анализа представлена в Руководстве пользователя к программному обеспечению амплификатора нуклеиновых кислот в режиме реального времени "АриаДНА".
6.3.1. Поместить картридж с микропластиной в термоблок амплификатора. Во время проведения анализа термоблок должен быть плотно закрыт.
6.3.2. В основном окне программы выбрать меню "Анализ" (для создания нового проекта необходимо выбрать меню "Проект"). Во вкладке "Терморежим" меню "Анализ" установить программу амплификации:
| Этап | Температура, °С | Время, с | Количество циклов |
|---|---|---|---|
| 1 | 94 | 120 | 1 |
| 2 | 94 | 5 | 45 |
| 60* | 30 |
______________________________
* - на этом этапе происходит регистрация сигнала
6.3.3. Назначить детекцию флуоресцентного сигнала в конце цикла амплификации. Во вкладке "Детектор" по двум каналам для флуорофоров FAM и ROX установить следующие параметры:
| Канал | Выдержка, мс | Усиление | Задержка, мс |
|---|---|---|---|
| FAM | 1500 | 100 | 0 |
| ROX | 1000 | 100 | 0 |
6.3.4. Во вкладке "Шаблоны" определить микрореакторы микроматрицы по образцу и каналам в соответствии со схемой микроматрицы. Запустить программу амплификации.
6.3.5. После проведения анализа необходимо утилизировать использованную микроматрицу. Для этого необходимо извлечь картридж с микроматрицей из амплификатора. Извлечь микроматрицу из картриджа и поместить в утилизационную емкость, заполненную дезинфицирующим раствором.
6.3.6 После утилизации отработанной микроматрицы необходимо провести очистку картриджа безворсовой салфеткой, смоченной дезинфицирующим раствором.
6.4. Регистрация и интерпретация результатов
Регистрация результатов амплификации происходит в режиме реального времени. Изменение уровня флуоресценции в зависимости от номера цикла по каналам FAM и ROX отображается в закладке "Графики".
6.4.1. Анализ результатов проводится с помощью программного обеспечения амплификатора нуклеиновых кислот в режиме реального времени "АриаДНА".
6.4.2 В меню "Настройки графиков" необходимо отметить флажком опцию "Сглаживание" и установить следующие настройки расчетов:
| Параметр | Значение |
|---|---|
| Длина волны циклов | 2 |
| Удалять фон | Экспоненциальный фон |
| Количество выбросов | 2 |
6.4.3 Расчет пороговых циклов (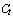 ) производится программным обеспечением амплификатора автоматически. Номер рассчитанного порогового цикла доступен в закладке "Графики" (Рис. 2). Красными рамками выделены ячейки таблицы, соответствующие номеру микрореактора, названию исследуемого образца и пороговому циклу.
) производится программным обеспечением амплификатора автоматически. Номер рассчитанного порогового цикла доступен в закладке "Графики" (Рис. 2). Красными рамками выделены ячейки таблицы, соответствующие номеру микрореактора, названию исследуемого образца и пороговому циклу.
6.4.4 Результат анализа считается достоверным, если выполнены следующие условия:
1) Для положительного контроля ПЦР (в случае использования микрореактора с положительным контролем) по каналам FAM и ROX значения порогового цикла ( ) не превышают 35;
) не превышают 35;
2) Для отрицательного контроля ПЦР (в случае использования микрореактора с отрицательным контролем) по каналам FAM и ROX флуоресцентный сигнал не регистрируется.
В противном случае результаты анализа считаются недействительными и рекомендуется повторная постановка.
6.4.5 Исследуемая специфичная ДНК обнаружена, если для соответствующего микрореактора значения порогового цикла 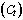 не превышают 35.
не превышают 35.
6.4.6 Исследуемая специфичная ДНК не обнаружена, если для соответствующего микрореактора флуоресцентный сигнал не регистрируется или значение порогового (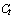 ) цикла превышает 35.
) цикла превышает 35.
6.5. Определение содержания в образце ГМ-линий по выявленной комбинации генетических элементов
Если в образце обнаружены универсальные генетические элементы ГМО и маркеры видовой принадлежности, но не обнаружены конкретные ГМ-линии (трансформационные события), то образец содержит в своем составе не зарегистрированные на территории Таможенного союза ГМ-линии. Определение ГМ-линий, содержащихся в образце, по комбинации выявленных генетических элементов возможно с использованием базы данных ГМ-культур (ГенБит, Россия) или других баз данных (GMOseek Software, http://www.gmoseek.com/gmoseek, CERA GMO Database http://cera-gmc.org/GMCropDatabase).
По окончании анализа распечатывается протокол исследований. Пример протокола приведен в приложении 4 к настоящим методическим рекомендациям.
Приложение N 1
к Методическим рекомендациям
по детекции и идентификации
специфических последовательностей
ДНК генно-инженерно-
модифицированных организмов
методом полимеразной цепной
реакции в режиме реального времени
в матричном формате
Перечень тест-системы, для выявления специфичных для ГМО генетических элементов и определения видовой принадлежности образца
| Код тест-системы | Описание |
|---|---|
| Линии генно-инженерно-модифицированной сои (ГМ-сои) | |
| GTS 40-3-2 | трансформационное событие GTS 40-3-2 |
| MON89788 | трансформационное событие MON89788 |
| MON87701 | трансформационное событие MON87701 |
| SYHT0H2 | трансформационное событие SYHT0H2 |
| А5547-127 | трансформационное событие А5547-127 |
| А2704-12 | трансформационное событие A2704-12 |
| FG72 | трансформационное событие FG72 |
| BPS CV-127-9 | трансформационное событие BPS-CV127-9 |
| Линии ГМ-кукурузы | |
| MON810 | трансформационное событие MON810 |
| NK603 | трансформационное событие NK603 |
| MON863 | трансформационное событие MON863 |
| GA 21 | трансформационное событие GA21 |
| MON88017 | трансформационное событие MON88017 |
| МON89034 | трансформационное событие MON89034 |
| Т25 | трансформационное событие Т25 |
| 3272 | трансформационное событие 3272 |
| ВТ 11 | трансформационное событие Bt11 |
| MIR604 | трансформационное событие MIR604 |
| ВТ176 | трансформационное событие Bt176 |
| ТС1507 | трансформационное событие ТС1507 |
| MIR162 | трансформационное событие MIR162 |
| 5307 | трансформационное событие 5307 |
| MZHG0JG | трансформационное событие MZHG0JG |
| Линии других ГМ-культур | |
| LLRICE62 | ГМ-рис, трансформационное событие LL62 |
| GT 73 | ГМ-рапс, трансформационное событие GT73 |
| Н7-1 | ГМ - сахарная свекла, трансформационное событие Н7-1 |
| Универсальные генетические элементы ГМО | |
| 35S | 35S промотор вируса мозаики цветной капусты |
| FMV | Промотор вируса мозаики норичника |
| pSsuAra | Промотор SsuAra A.thaliana |
| рТА29 | Промотор, специфичный для пыльцы из N.tabacum |
| pNOS | NOS-промотор A. tumefaciens |
| pActin1* | Промотор гена актина 1 риса |
| pUbiZM1** | Промотор гена убиквитина кукурузы |
| tNOS | NOS-терминатор A. tumefaciens |
| t35S | 35S терминатор вируса мозаики цветной капусты |
| tE9 | Терминатор Е9 гороха |
| tOCS | Терминатор гена октопин-синтазы A.tumefaciens |
| tg7 | Терминатор g7 A.tumefaciens |
| bar | Ген устойчивости к фосфинотрицину |
| Код тест-системы | Описание |
| Универсальные генетические элементы ГМО | |
| pat | Ген устойчивости к фосфинотрицину |
| gox/gox247 | Ген глифосат-оксидазы |
| ср4 epsps | Ген устойчивости к глифосату |
| mepsps | Ген устойчивости к глифосату, мутантный |
| cry1Ab | Ген токсина cry1Ab B.thuringiensis |
| cry1Ac | Ген токсина cry1Ac B.thuringiensis |
| cry1F | Ген токсина cry1F B.thuringiensis |
| cry2Ab | Ген токсина cry2Ab B.thuringiensis |
| сry3А | Ген токсина сry3А B.thuringiensis |
| mcry3А | Модифицированный ген токсина cry3А B.thuringiensis |
| cry3Bb1 | Ген токсина cry3Bb1 B.thuringiensis |
| cry34Ab | Ген токсина cry34Ab B.thuringiensis |
| cry35Ab | Ген токсина cry35Ab B.thuringiensis |
| cry9c | Ген токсина cry9c B.thuringiensis |
| cry1A.105 | Ген токсина cry1А.105 B.thuringiensis |
| nptll | Ген неомицин-фосфотрансферазы |
| bla | Ген бета-лактамазы |
| gus | Ген бета-глюкуронидазы |
| Маркеры видовой принадлежности | |
| lec | Специфичная видовая последовательность сои |
| zea | Специфичная видовая последовательность кукурузы |
| Osat | Специфичная видовая последовательность риса |
| Bnap | Специфичная видовая последовательность рапса |
| Bvul | Специфичная видовая последовательность свеклы |
| Stub | Специфичная видовая последовательность картофеля |
| LAT | Специфичная видовая последовательность томата |
| TUB1 | Специфичная видовая последовательность подсолнечника |
| ALMT1 | Специфичная видовая последовательность пшеницы |
| AdhC | Специфичная видовая последовательность хлопчатника |
| SAD | Специфичная видовая последовательность льна |
| ACT | Специфичная видовая последовательность цикория |
______________________________
* Результат определения данного генетического элемента не учитывается, если в образце содержится ДНК риса (определен маркер видовой принадлежности риса)
** Результат определения данного генетического элемента не учитывается, если в образце содержится ДНК кукурузы (определен маркер видовой принадлежности кукурузы)
Приложение N 2
к Методическим рекомендациям
по детекции и идентификации
специфических последовательностей
ДНК генно-инженерно-
модифицированных организмов
методом полимеразной цепной
реакции в режиме реального времени
в матричном формате
Пример схемы ПЦР-матрицы
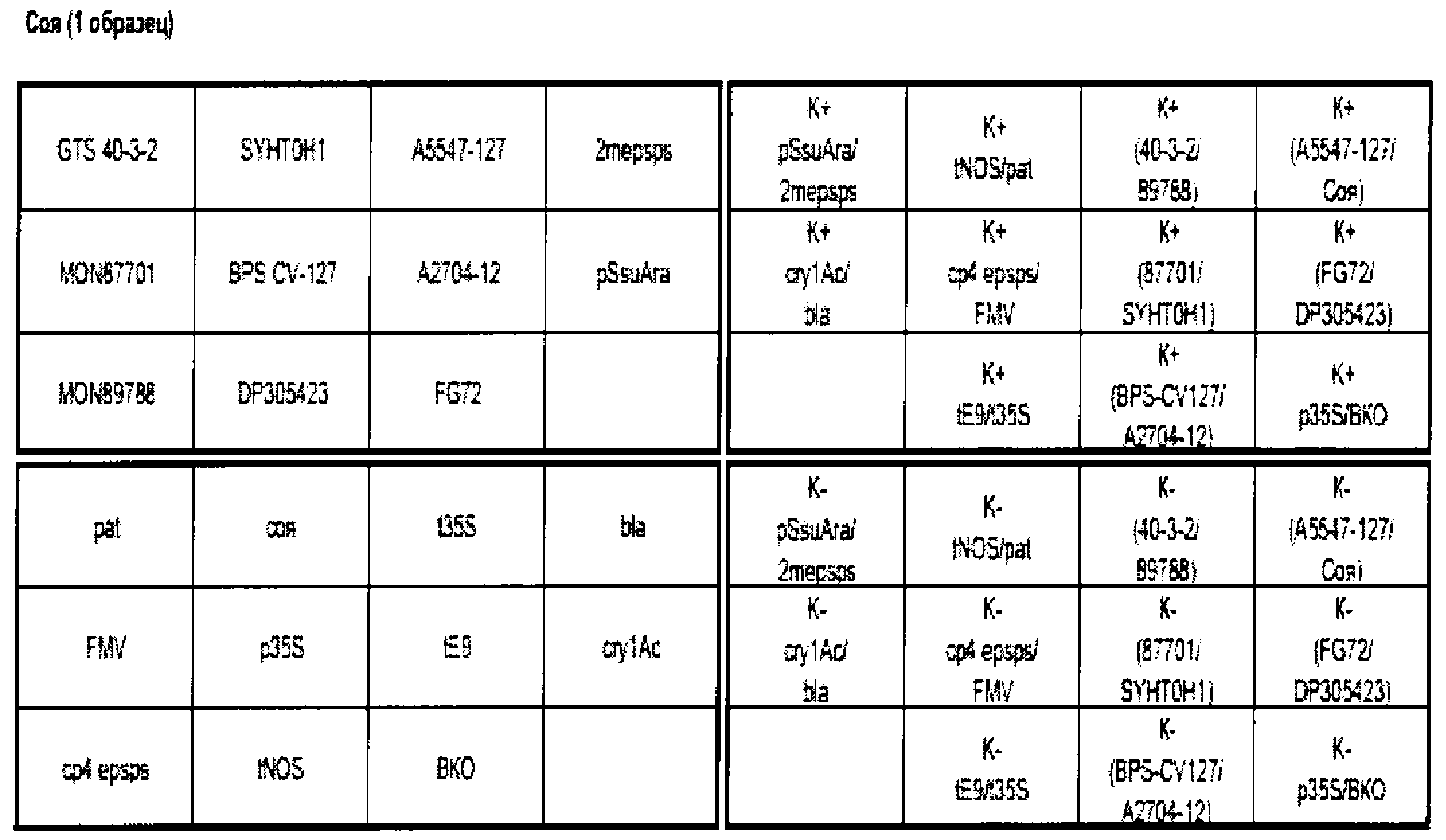
Приложение N 3
к Методическим рекомендациям
по детекции и идентификации
специфических последовательностей
ДНК генно-инженерно-
модифицированных организмов
методом полимеразной цепной
реакции в режиме реального времени
в матричном формате
Перечень государственных стандартов используемых для отбора проб семян сельскохозяйственных культур
|
N п/п |
Наименование культуры | N ГОСТа | Наименование ГОСТа |
|---|---|---|---|
| 1. | Сельскохозяйственные культуры, за исключением хлопчатника, сахарной свеклы, цветочных культур | ГОСТ 12036-85 | Семена сельскохозяйственных культур. Правила приемки и методы отбора проб |
| 2 | Сахарная свекла | ГОСТ 22617.0-77 | Семена сахарной свеклы. Правила приемки и методы отбора проб |
| 3. | Цветочные культуры | ГОСТ 24933.0-81 | Семена цветочных культур. Правила приемки и методы отбора проб |
| 4. | Картофель семенной | ГОСТ Р 55329-2012 | Картофель семенной. Приемка и методы анализа |
| 5. | Хлопчатник | ГОСТ 21820.0-76 | Хлопок-сырец семенной и семена хлопчатника. Методы отбора проб |
Приложение N 4
к Методическим рекомендациям
по детекции и идентификации
специфических последовательностей
ДНК генно-инженерно-
модифицированных организмов
методом полимеразной цепной
реакции в режиме реального времени
в матричном формате
Пример протокола исследований

Обзор документа
Методические рекомендации подготовлены в целях выявления генно-инженерно-модифицированных организмов (ГМО) в тканях растений, растительном сырье и продуктах его переработки методом полимеразной цепной реакции в режиме реального времени в матричном формате.
ФГБУ "Госсорткомиссия" поручено проводить экспертизу на наличие генно-инженерных конструкций в сортах сельскохозяйственных растений, заявляемых на проведение госиспытаний.
Отметим, что законом запрещено ввозить в Россию и использовать для посева (посадки) семена растений, генетическая программа которых изменена с использованием методов генной инженерии и которые содержат генно-инженерный материал (кроме посева (посадки) таких семян при проведении экспертиз и научно-исследовательских работ).



(1).jpg)


